miR-29c通过调控SIRT1表达介导动脉粥样硬化氧化应激与炎症反应
李贞贞,唐海涛,王 怡,周 青,汪 渊,朱华庆
动脉粥样硬化(atherosclerosis, AS)是一种脂质堆积在动脉壁进而发生粥样病变并导致血管管腔狭窄的慢性炎症性疾病,严重危害人类健康。AS所致的冠状动脉疾病、中风、外周动脉疾病等心血管疾病是人类高发病率和死亡率的主要原因[1-2]。沉默信息调节因子2相关酶类1(silent mating type information regulation 2 homolog-1, SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性的组蛋白去乙酰化酶。研究[3]表明,SIRT1可通过去乙酰化下游靶分子来调节细胞代谢、减缓衰老,抑制氧化应激,减少炎症反应。
微RNA(microRNA, miRNA)是一种内源性的、长约22 nt、单链非编码的小RNA,通过与靶基因mRNA的3’-非编码区(3’-UTR)结合,降解或抑制其翻译,从而调控基因表达[4]。近年来,越来越多的研究表明miRNA在AS的发生发展过程中起关键作用。其中,文献[5]报道miR-29可参与多种疾病或病理状态的发生发展过程,并且miR-29c在AS形成中可能发挥多方面的重要作用,但具体的作用机制尚不清楚。因此研究miR-29c在AS形成过程中的作用机制具有重要意义。
1 材料与方法
1.1 主要材料与试剂清洁级雄性C57BL/6J小鼠与C57BL/6J ApoE-/-小鼠各6只,体质量(14±1.8)g,购自北京协和医学院基础研究所;人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)购自美国ATCC细胞库;DMEM高糖培养基干粉与胎牛血清(FBS)购自美国Gibco公司;二甲亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司;氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)购自广州Yiyuan Biotechnologies;Mimic与TransMessenger Transfection Reagent试剂盒购自德国Qiagen;Antagomir购自上海GenePharma;活性氧(reactive oxygen species, ROS)检测试剂盒购自上海BestBio公司;TNF-α检测试剂盒购自美国Adipo Bioscience公司;BCA试剂盒购自上海碧云天生物技术公司;还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶活性化学发光法定量检测试剂盒购自上海宸功生物技术有限公司;总RNA提取试剂盒购自北京天根生化科技有限公司;逆转录试剂盒购自日本Takara公司;一抗SIRT1购自英国Abcam公司,内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)购自美国Santa Cruz公司;二抗购自北京中杉金桥公司。
1.2 主要仪器酶标仪(Thermo MultiskanGO,美国Thermo-Fisher公司);低温离心机(Sorvall Legend Micro 21R,美国ThermoFisher Scientific);电泳仪(DYY-11型,北京六一仪器厂);-80 ℃冰箱(MDF-U73V,日本sanyo);CO2细胞培养箱(MCO-20AIC,日本Panasonic公司);超净工作台(SW-CJ-1F型,蘇州净化);正置显微镜(DM4000B,德国Leica公司);立式压力蒸汽灭菌器(BXM-30R,上海博讯公司);制冰机(AF100,意大利SCOTSMAN公司);电子天平(DC-120AS,南京苏测计量仪器有限公司);摇床(TS-1型,海门其林贝尔仪器制造有限公司);全自动数码凝胶成像系统(ChemiQ 4600,上海欧翔公司);恒温水浴锅(DK-8D型,上海跃进医疗器械厂);PCR仪(T-Gradient Thermoblock,德国Biometra)。
1.3 方法
1.3.1建立模型 清洁级ApoE-/-小鼠与C57BL/6J小鼠各6只,常规方法建立AS模型,即小鼠于4周龄断奶后,采用明暗(12 h ∶12 h),温度(22±1) ℃,湿度50%~60%条件下以普通饲料(4%脂肪和0%胆固醇)进行适应性饲养,AS组ApoE-/-小鼠于6周龄时采用高脂饲料(21%脂肪和0.15%胆固醇)喂养。以C57BL/6J为正常对照组(正常组),给予普通饲料进行饲养。12周后处死分离主动脉进行相关实验。
1.3.2细胞的培养与分组 复苏HUVEC细胞后,以高糖DMEM培养基(含10% FBS、1% 青链霉素混合液)于37 ℃、5% CO2恒温培养箱中培养,当细胞密度达80%时用0.25%胰酶进行消化传代。采用oxLDL (50 μg/ml)刺激HUVEC细胞进行后续细胞实验。细胞分组:空载体转染组(对照组)、Antagomir组、Mimic组、oxLDL组、oxLDL+Antagomir组、oxLDL+Mimic组。
1.3.3细胞转染miR-29c的过表达与抑制 HUVEC细胞转染miR-29c mimic和antagomir。转染前1 d,消化对数生长期HUVEC细胞,以1.0×106~2.0×106/孔接种于6孔板中,加入培养基(含10% FBS),摇匀后放置37 ℃培养箱。根据TransMessenger Transfection Reagent试剂盒说明书进行细胞转染,3~4 h后换成完全培养基,于CO2恒温培养箱中继续培养。
1.3.4ROS检测 组织ROS检测:取50 mg动脉,加入1 ml匀浆缓冲液A,置于研磨器中研磨,充分匀浆后于4 ℃离心机中离心(1 000 r/min,10 min),弃去沉淀,吸取上清液。在96孔板中加入190 μl匀浆上清液和10 μl探针,混匀后37 ℃孵育30 min后置于荧光酶标仪在激发波长488 nm、发射波长520 nm下进行检测。细胞ROS检测:根据试剂盒说明书进行操作,荧光探针DCFH-DA用无血清培养液进行稀释(1 ∶1 000),收集细胞后加入稀释好的DCFH-DA中制成悬液,于37 ℃培养箱中孵育20 min,用无血清培养液洗涤3次,洗去未进入细胞的荧光探针,在激发波长488 nm、发射波长525 nm条件下测定荧光强度。采用BCA蛋白定量法进行蛋白定量。
1.3.5肿瘤坏死因子(tumor necrosis factor-α,TNF-α )测定 取细胞培养的上清液,于4 ℃离心机(2 000 r/min、5 min)进行离心,收集上清液于-80 ℃保存待测。根据TNF-α 检测试剂盒说明书进行实验,测定样品的吸光度值,根据所绘标准曲线计算出样品的相应浓度。
1.3.6NADPH氧化酶活性检测 准备组织及细胞,分别按组织与细胞NADPH氧化酶活性化学发光法定量检测试剂盒说明书实验步骤进行实验,背景对照测定后检测样品总活性以及样品非特异性活性,最后计算出样品中NADPH氧化酶的实际活性。
1.3.7Real time PCR 根据总RNA提取试剂盒说明书进行操作,提取总RNA后,用逆转录试剂盒进行逆转录。GAPDH为内标,逆转录的cDNA为模板,采用SYBR green对各基因进行实时PCR。各基因相对表达量用2-ΔΔCt表示,每个样品重复3次。
1.3.8Western blot法检测 已处理细胞达80%后,PBS洗3次,加入100 μl含蛋白酶抑制剂的蛋白裂解液,冰上裂解30 min后收集细胞蛋白,4 ℃、14 000 r/min离心30 min,取上清液,用BCA法测定蛋白浓度,用蛋白裂解液配成同体积同浓度液体,再加入蛋白上样缓冲液,混匀,然后煮沸使蛋白变性,-80 ℃保存。配制SDS-PAGE凝胶,等量上样进行电泳,然后转移到PVDF膜上。置摇床室温封闭2 h(5%脱脂牛奶),一抗SIRT1(1 ∶10 000)4 ℃摇床孵育过夜,二抗兔抗(1 ∶5 000)室温孵育2 h后进行显影。用QuantityOne软件分析各条带的灰度值,以GAPDH为参照,计算相对灰度值。
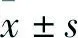
2 结果
2.1 AS中 miR-29c、TNF-α mRNA、ROS、NADPH氧化酶水平升高与正常组相比,miR-29c在AS小鼠主动脉中的表达明显升高;TNF-α mRNA水平显著升高,并且ROS水平和NADPH氧化酶活性也明显提高,即炎症和氧化应激水平明显提高。见表1。

表1 主动脉miR-29c水平以及TNF-α mRNA水平、ROS水平和NADPH氧化酶活性
2.2 miR-29c可增加oxLDL诱导的HUVEC细胞中TNF-α表达、ROS生成与NADPH氧化酶活性与对照组比较,oxLDL组细胞内的TNF-α水平、ROS水平与NADPH氧化酶活性均明显提高;转染Mimic和Antagomir后细胞的TNF-α水平、ROS生成与NADPH氧化酶活性较对照组无明显变化。此外,oxLDL刺激细胞后,Antagomir组细胞的TNF-α水平、ROS生成与NADPH氧化酶活性较对照组均明显降低,而Mimic组细胞的TNF-α水平、ROS生成与NADPH氧化酶活性较对照组均明显升高。见表2。

表2 各组细胞TNF-α含量、ROS水平与NADPH氧化酶活性
与对照组比较:*P<0.05;与oxLDL组比较:#P<0.05
2.3 oxLDL诱导下HUVEC 细胞的SIRT1活性和表达降低Real time PCR与Western blot法检测结果显示,与对照组相比,oxLDL组SIRT1 mRNA和蛋白表达均明显降低,差异有统计学意义(t=4.260,P=0.013;t=4.905,P=0.008)。见图1。
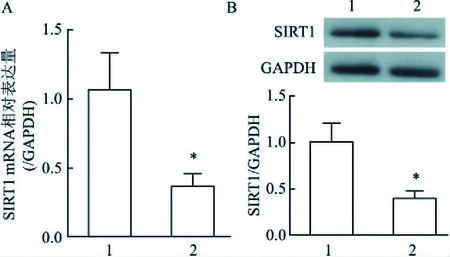
图1 HUVEC中SIRT1 mRNA水平及蛋白表达A:细胞中SIRT1 mRNA水平;B:细胞中SIRT1蛋白表达;1:对照组;2:oxLDL组;与对照组比较:*P<0.05
2.4 miR-29c调控SIRT1表达Real time PCR与Western blot法检测结果显示,与对照组比较,Antagomir组和Mimic组细胞的SIRT1 mRNA水平并无明显变化,差异无统计学意义(t=0.583,P=0.591;t<0.001,P=1.000),见图2A、2B;然而,Antagomir组细胞的SIRT1蛋白表达显著升高,而Mimic组细胞的SIRT1 蛋白表达则明显降低,差异有统计学意义(t=12.422,P<0.001;t=4.691,P=0.009)。见图2C、2D。
3 讨论
miR-29c属miR-29家族,在人类癌症中大多下调。近年来有研究[6]表明,miR-29c可以通过靶向细胞外基质蛋白如胶原蛋白3A1和胶原蛋白4A5的mRNA来调节AS。此外,miR-29c可通过抑制胰岛素样生长因子1来抑制内皮细胞的迁移和血管生成[7]。最近,miR-29c被报道可作为鉴别AS患者的生物标志物[8]。以上研究表明,miR-29c在AS发展过程中发挥重要作用。
oxLDL可引起内皮细胞功能障碍,是AS发生的主要危险因素。本研究采用oxLDL 刺激HUVEC模拟高脂血症损伤模型,研究miR-29c在AS发展中的潜在作用。数据显示,与正常组相比,miR-29c在AS小鼠主动脉的表达明显上调。此外,课题组对SIRT1下游的炎症和氧化应激指标如TNF-α、ROS、NADPH氧化酶活性作了检测。结果显示,与正常组相比,AS小鼠主动脉的TNF-α mRNA水平、ROS生成与NADPH氧化酶活性明显增高。在HUVEC培养中,经oxLDL刺激后,与对照组比较,转染miR-29c antagomir的细胞中TNF-α的表达、ROS生成与NADPH氧化酶活性均明显降低,而转染miR-29c mimic的细胞中TNF-α的表达、ROS生成与NADPH氧化酶活性均明显升高,差异均有统计学意义。由此可见,miR-29c水平与关键炎症因子TNF-α水平、ROS、NADPH氧化酶活性显著相关。
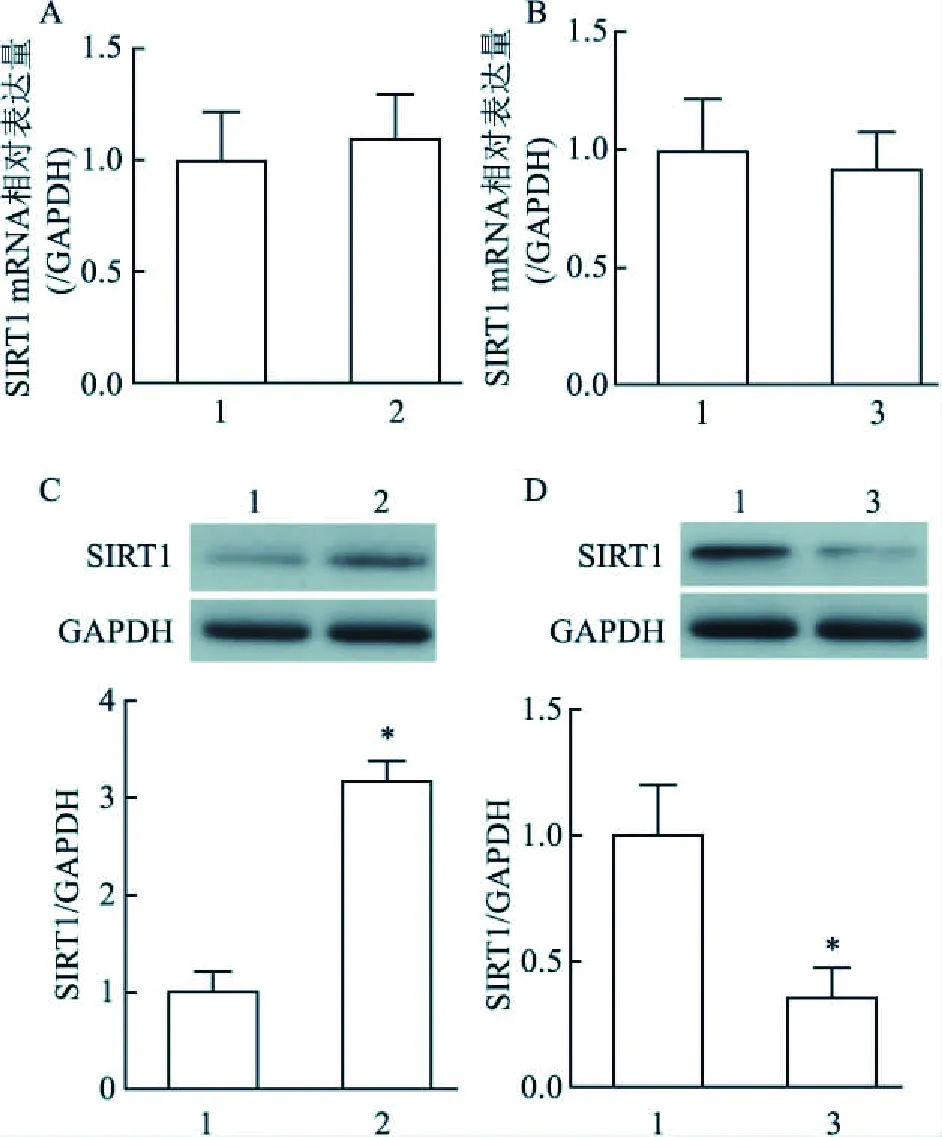
图2 转染miR-29c Mimic或Antagomir后细胞的SIRT1 mRNA水平以及蛋白表达A、B:细胞中SIRT1 mRNA水平;C、D:细胞中SIRT1蛋白表达;1:对照组;2:Antagomir组;3:Mimic组;与对照组比较:*P<0.05
SIRT1是sirtuin家族成员之一,在内皮细胞中高度表达,具有组蛋白脱乙酰酶的活性,可参与细胞的生长、凋亡等许多生物过程[9]。有研究[10]表明,SIRT1可抑制NADPH氧化酶活性,减少ROS产生,从而保护血管内皮功能。此外,SIRT1的特异性激活剂SIRT1720可通过抑制NF-κB信号传导,减少血管紧张素Ⅱ诱导的多种促炎因子如TNF-α、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)等的表达,减少炎症细胞浸润,从而发挥抗AS作用[11]。因此,SIRT1缺陷会增加炎症和氧化应激,促进AS发生。有研究[12]报道,在肝癌中miR-29c通过直接靶向SIRT1抑制肝癌细胞生长从而起到肿瘤抑制剂的作用。此外,抑制miR-29可通过升高SIRT1的活性和表达来抑制脂肪的生成[13]。本研究显示,oxLDL刺激后,与对照组相比,HUVEC的SIRT1 mRNA和蛋白表达水平均降低,并且在转染miR-29c mimic细胞中SIRT1蛋白的表达明显降低,转染miR-29c antagomir细胞中SIRT1的表达显著上升。然而,转染miR-29c mimic和antagomir细胞中的SIRT1 mRNA水平较对照组差异无统计学意义,提示miR-29c对SIRT1的调控处于翻译后水平。
综上,miR-29c在AS发展过程中高表达,抑制miR-29c可上调SIRT1的表达,进而抑制NADPH氧化酶活性,减少ROS生成及炎性因子TNF-α表达,从而减弱AS氧化应激和炎症反应。得出结论:miR-29c可下调SIRT1表达进而增强AS中氧化应激及炎症反应。未来有必要进一步探讨miR-29c调控SIRT1参与AS氧化应激和炎症过程的具体作用机制,对防治AS有重要意义。

