大鼠原代肺动脉平滑肌细胞的分离鉴定及低氧对其增殖的影响
张凤玉,姚德山,李如君,王 军,丁昌平
肺动脉高压(pulmonary arterial hypertension, PAH)是由多病因所致,主要以肺动脉压力增高为特点的进行性和致命性疾病,通过血管收缩、肺血管重构,最终诱发右心衰竭和死亡[1]。一旦确诊,生存时间一般仅为2~8年[2]。目前PAH的判定标准是:静息状态下平均肺动脉压力≥3.325 kPa,运动状态下≥3.99 kPa[3]。PAH主要分为动脉型、左心疾病型、呼吸系统疾病及低氧相关型等疾病类型,其中低氧性或称缺氧性PAH最为常见[4-6]。肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs) 作为肺血管壁的重要组成成分,其异常增殖是肺血管重构的主要原因[6]。近年来研究[7]开始以PASMCs作为细胞模型来探讨PAH的分子机制。该研究改进组织块贴壁法原代分离及培养大鼠原代PASMCs,通过N2诱导低氧培养,拟研究低氧对于原代分离培养PASMCs的增殖影响。为研究PAH体外细胞水平研究提供良好的模型。
1 材料与方法
1.1 实验动物2只8~ 10周龄的清洁级Sprague-Dawley雌性大鼠由扬州大学医学实验动物中心提供,体质量(160±10)g,普通饲料喂养,自由采光,饮食,室温控制在20 ℃左右。
1.2 实验仪器与试剂YCP系列三气厌氧培养箱购自长沙华曦电子公司;倒置显微镜、荧光显微镜购自日本OLYMPUS公司;CO2孵育箱购自美国Thermo公司。水合氯醛购自生工生物公司;高糖DMEM粉末和胰酶购自美国GIBCO公司;胎牛血清购自杭州四季青公司;青-链霉素购自上海碧云天生物公司;4%多聚甲醛购自北京索莱宝公司;anti-α-SMA抗体购自美国abcam公司,FITC标记的羊抗鼠二抗和DAPI染液购自美国CST公司,CCK-8试剂盒购自日本东仁化学公司。
1.3 实验方法
1.3.1大鼠原代PASMCs分离培养 课题组根据实际操作改进如下:水合氯醛(300 mg/kg)腹腔注射大鼠,麻醉后大鼠75%乙醇浸泡5 min,无菌手术台上开胸取出肺组织,无菌PBS漂洗3次。固定肺叶两端,手术显微镜下用显微弯镊顺着肺血管走向将肺动脉及三级以下分支分离出来,剥净血管周围的肺组织、神经及筋膜等,分离干净的肺血管转移至新100 mm平板中。显微剪纵行剪开肺血管,内膜面向上,用显微弯镊轻轻刮拭内层,去除内皮细胞层。眼科剪剪成约1 mm3的小块,再接种到含1 ml DMEM培养基(含20%血清、100 U/ml青-链霉素)的平皿中,轻摇培养液,使每块组织块间距约为0.8~1.0 cm。静置于37 ℃、5% CO2培养箱中2 h,等组织贴牢后,缓慢添加DMEM培养液(20%血清、100 U/ml青-链霉素)完全覆盖住组织块,继续培养。
1.3.2大鼠原代PASMCs形态及生长特点的观察 细胞从组织块周围爬出后,换液间歇在倒置相差显微镜下仔细观察PASMCs形态及生长特点,拍照。
1.3.3细胞免疫荧光鉴定 PASMCs消化后,以约5×105个/ml的密度接种到放有盖玻片的6孔板中,待PASMCs贴壁且密度达到30%~50%时,取出6孔板,弃去培养基,PBS清洗2次,4%多聚甲醛室温固定15 min,0.3%Triton-X 100室温破膜10 min,5% BSA(0.1% Triton-X 100配制)室温封闭30 min,200 μl一抗α-SMA(1 ∶400,3% BSA、0.1% Triton-X 100配制)滴加于盖玻片上,4 ℃过夜孵育。第2天室温平衡1 h, PBST清洗5 min×3次,FITC标记的二抗室温避光孵育1 h,PBST清洗5 min×3次。DAPI避光染色10 min,PBST清洗5 min×3次。荧光显微镜下拍照。
1.3.4低氧培养PASMCs PASMCs消化后分为低氧组和常氧组培养。低氧组持续低流量通入纯N2,通过数字监控器实时控制O2浓度为1.0%,而常氧组为正常O2浓度培养。
1.3.5CCK-8检测PASMCs增殖 96孔板中接种PASMCs约103个/孔,分为常氧组和低氧组,每组设6个复孔。分别在常氧和低氧下培养0、2、4、6、8、24、48、72 h后,取出培养板,每孔加入100 μl含有10 μl CCK-8溶液的DMEM培养基,37 ℃继续孵育2 h,检测425 nm处的吸光度值(optical density, OD)。
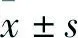
2 结果
2.1 PASMCs形态及生长特点倒置相差显微镜下观察大鼠原代PASMCs在第5 d时从组织块周围爬出,第7天时细胞呈放射状排列,大小不等,形态多样主要有梭形、多角形、纤维形等(图1A)。细胞传代第5天,部分融合交织成网状,多数呈长梭形,有分支状突起,细胞部分区域多层重叠生长,高低起伏,成“峰-谷”样(图1B)。反复传代3~5代均可保持良好的形态结构和功能。
2.2 PASMCs的α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)免疫荧光鉴定荧光显微镜检测Dapi标记的所有细胞核呈椭圆形发蓝色荧光(图2B)。检测FITC标记的平滑肌中α-SMA,仅平滑肌细胞呈阳性反应,发绿色荧光,在平滑肌细胞胞质中平行于细胞长轴呈细丝状表达(图2A)。细胞平均纯度达95%。
2.3 常氧与低氧组PASMCs形态差异PASMCs分别于常氧和低氧下培养,培养2 d后如图3所示,常氧下PASMCs正常稳定生长,细胞形态呈梭形或多角形,细胞比较圆润(图3A)。低氧下PASMCs数量变少,细胞变细变长,细胞间隙增宽(图3B)。

图1 PASMCs在倒置显微镜下的形态学特征 ×100A:肺动脉组织爬块第7天PASMCs形态;B:传代第5天PASMCs形态
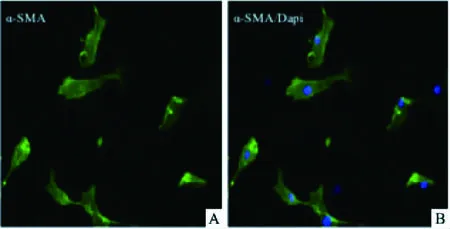
图2 PASMCs的免疫荧光结果 IF×200A:α-SMA细胞免疫荧光染色阳性;B:α-SMA与Dapi染色后合并图
图3 PASMCs在常氧和低氧条件下细胞形态特征 ×100A:常氧组PASMCs生长状态;B:低氧组PASMCs生长状态
2.4 常氧与低氧组PASMCs增殖能力差异CCK-8法检测PASMCs生长曲线。如图4所示:不论是否缺氧PASMCs的OD值都会随着时间增加而逐渐增高。但常氧组整体OD值(1.354 0±0.221 8,n=8)显著高于低氧组(0.814 3±0.086 52,n=8),常氧组PASMCs生长较低氧组快,增殖速度也明显强于低氧组(t=2.268,P<0.05)。

图4 PASMCs在常氧与低氧条件下生长曲线图与低氧组比较:*P<0.05
3 讨论
体外原代分离培养细胞可以排除众多因素干扰,也可以模拟在体实验结果,故而大量疾病模型的体外试验开始应用体外原代分离组织细胞。本课题组为研究PAH的致病机制,改进组织贴壁法, 成功分离并原代培养出PASMCs,利用α-SMA鉴定第3代PASMCs的纯度高达90%以上。
PAH形成主要归因于PASMCs的异常增殖等。目前所有在体实验均证实, 低氧可促进PASMCs异常增殖,诱发PAH。但体外细胞培养结果却不一致[1]。研究[8-9]显示低氧会抑制新生小牛PASMCs增殖; 有研究者认为低氧不直接诱导体外培养的PASMCs增殖, 只有预先用佛波酯激活细胞的蛋白激酶C, 低氧培养的PASMCs数目才会明显增加[9-11];徐敦全 等[12]也认为雌激素会显著降低低氧下PASMCs的增殖。本实验显示低氧培养不同时间点,PASMCs的增殖情况有较大差异, 相对于常氧培养,短期低氧并不会改变PASMCs的生长状况,而长时间低氧培养对PASMCs的增殖并没有促进作用。众所周知, 应对同样的低氧环境,肺动脉对低氧的收缩反应会因血管内径大小的不同而有差异, 有研究者发现低氧下内径200~600 μm的猫肺动脉收缩反应最明显, 而内径>800 μm的猫肺动脉平滑肌细胞肌球蛋白轻链对低氧的刺激不发生磷酸化, 基本无收缩反应[10-11]。于天正 等[8]发现内径为300~400 μm的PASMCs在低氧下增殖反应最明显, 500~800 μm的PASMCs次之, 而内径>1 000 μm的PASMCs基本无增殖, 提示低氧对PASMCs的促增殖作用会因内径的不同而不同。
本文分离的原代PASMCs来源于雌性大鼠肺血管,研究[12-14]显示,雌性大鼠的肺血管对低氧表现出较轻的收缩反应,细胞水平试验亦证实,取自雌激素水平较高的动物的原代PASMCs低氧增殖反应较低,则是因为离体的肺动脉血管与原代细胞仍表达或分泌一定水平的雌激素[12];膜性受体介导内源性雌激素降低低氧性肺动脉血管的收缩作用。雌激素抑制低氧反应增殖的可能机制为:① 内源性雌激素在大鼠PAH发生过程中发挥拮抗性作用,通过非基因组作用途径(GPR30受体途径)降低肺动脉压力和基因组途径抑制肺血管重构和PASMCs的增殖,发挥其拮抗PAH的作用[12];② 雌激素刺激血管生成NO,通过PI3K信号途径激活cAMP,从而抑制平滑肌细胞的增殖迁移[13];③ 雌激素通过调节miRNA-21来调控雌激素受体对肺血管的保护作用[14]。故而雌激素可抑制低氧诱导的肺血管增殖。

