南极罗斯海沉积物中可培养菌株的分离及胞外水解酶活性检测
王飞 丛柏林 张朝晖 杨黄浩
研究论文
南极罗斯海沉积物中可培养菌株的分离及胞外水解酶活性检测
王飞1丛柏林2张朝晖2杨黄浩1
(1福州大学, 福建 福州 350108;2自然资源部第一海洋研究所, 山东 青岛 266061)
研究了南极罗斯海地区沉积物中可培养微生物多样性, 并检测了菌株胞外酶活性, 为开发利用南极资源奠定基础。采用Zobell 2216E培养基、土豆培养基(PDA)及稀释平板划线法分离并获得纯培养的细菌和真菌, 分别通过16S rDNA、18S/ITS序列鉴定分析了可培养微生物的多样性和系统发育。从南极罗斯海沉积物样品中获得78株细菌和54株真菌, 细菌、真菌的优势菌株分别为嗜冷杆菌属()、枝孢属(); 78株细菌菌株中有2株与模式菌株的16S rDNA基因序列相似性小于97%, 可能是潜在的细菌新物种。细菌API20NE生理生化和真菌产胞外酶活性结果表明, 获得的细菌和真菌大多数可检测到胞外水解酶活性。本研究丰富了南极可培养微生物资源, 为南极罗斯海地区可培养微生物的多样性研究以及南极微生物资源的应用研究奠定了基础。
南极罗斯海 可培养菌株 胞外酶
0 引言
南极位于地球的最南端, 由陆地和海洋两部分构成, 终年被冰雪覆盖, 气候酷寒干燥、强光辐射、盐度变化大, 是地球上最冷最干的地区[1]。由于南极特殊的地理位置和气候特征, 生存于其中的微生物也具备了独特的生物学机制和生理生化特性, 如具有耐低温、耐高盐、抗辐射等特点。这些微生物可以在低温下通过调节它们的新陈代谢以在严酷的南极环境中繁衍生存[2]。研究南极地区微生物的多样性, 特别是获得可培养的南极微生物资源, 为将来开发利用南极微生物提供重要的参考依据[3], 也可以为人类了解低温微生物在南极自然环境下的物质循环、生物地球化学过程等提供重要的线索[4]。
由于低温微生物及其相关产物如低温酶类、胞外多糖、色素、抗生素等的研究意义以及它们在现代生物工程中的潜在价值, 近年来对低温酶的研究已经成为研究热点[5]。低温酶主要由生活在极地、深海、高山、永冻土等寒冷环境的低温微生物产生, 人类已获得了一些可培养的低温活性菌株。Olivera等[6]从亚南极埃斯塔多斯岛海洋沉积物中分离出了19株产低温蛋白酶的菌株。另外从南极土壤[7-8]、阿拉斯加冻土[9]以及深层地下水[10]等环境中分离到产低温酶的菌株, 并对其基因和酶学特性进行了研究。低温酶在食品、洗涤剂、化妆品、水产饲料等工业上被广泛应用[11-12]。如蛋白酶可被应用于奶酪成熟、牛奶加工、洗涤剂等; 淀粉酶可被应用于果汁加工、蔬菜加工、糖浆制造等[13]。
罗斯海(Ross Sea)位于罗斯海湾北部、南极太平洋扇形区, 是南极地区最容易接近的边缘海之一[14]。罗斯海地区是南极岩石圈、冰冻圈、生物圈和大气圈相互作用最集中的区域, 对全球气候变化响应最敏感, 生态系统脆弱, 具有重要的研究价值, 是开展科学考察的理想之地。国内外学者对罗斯海地区地质、海冰、地球物理、气候及地球化学等方面做了大量的研究工作, 包括在地震层序[15]、油气潜力[16]、海冰特征[17]、构造演化[18]、古气候[19]、有机物[20-21]等方面进行了深入探讨。但对于罗斯海地区沉积物中的可培养微生物多样性及胞外酶活性等方面的研究较少, 本文通过纯化培养及分子鉴定, 从南极罗斯海地区中获得一批可培养的细菌和真菌, 并对其酶活力进行了鉴定, 评估了其应用潜力, 研究中还发现了潜在的新的细菌菌种资源。这对于了解南极罗斯海地区沉积物中可培养微生物的多样性、发现新的微生物菌种资源以及开发利用其特殊的功能基因和生物活性物质都具有重要意义。
3 材料与方法
3.1 样品来源及实验涉及的仪器及试剂
实验样品来源于中国第33次南极科学考察队的考察地罗斯海地区的6个采样点(表1和图1)。用箱式取样器采集罗斯海地区的沉积物, 将沉积物存放于无菌离心管中, 4°C低温保存。
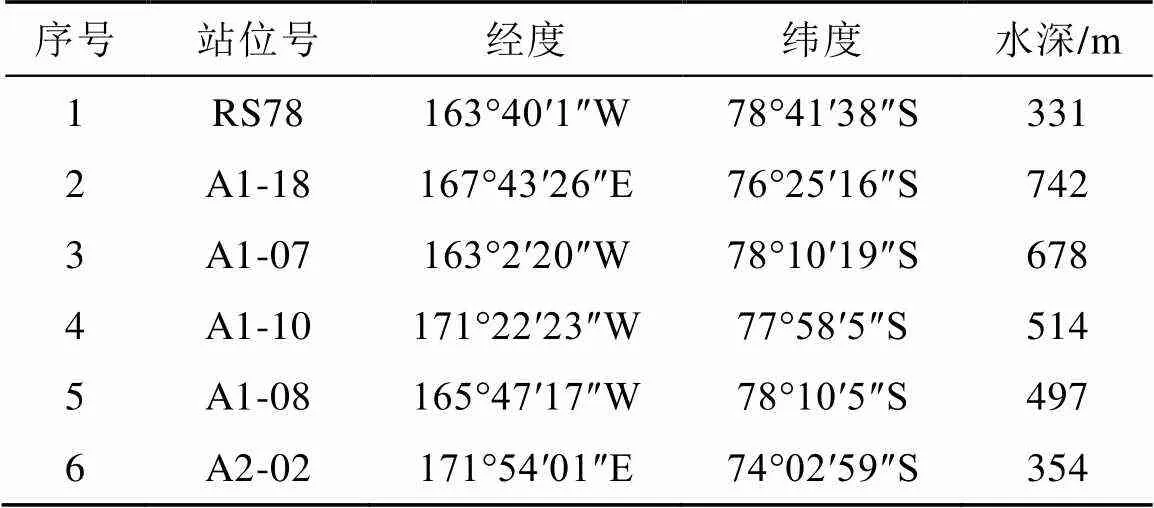
表1 样品采集站位信息
实验中所使用的主要仪器及试剂有: SW-CJ 超净工作台(苏州安提空气技术有限公司)、SPX 系列生化培养箱(宁波江南仪器厂)、ELGA超纯水仪(英国ELGA公司)、XW-80A 旋涡振荡仪(海门市其林贝尔仪器制造有限公司)、D3024离心机(Eppendorf有限公司)、YXQG02高压蒸汽灭菌锅(致微仪器有限公司)、细菌DNA提取试剂盒(中国天根生化科技有限公司)、真菌DNA提取试剂盒(北京方程生物科技有限公司)、API20NE (bioMerieux, 法国)、PCR反应试剂(大连宝生物工程有限公司)。
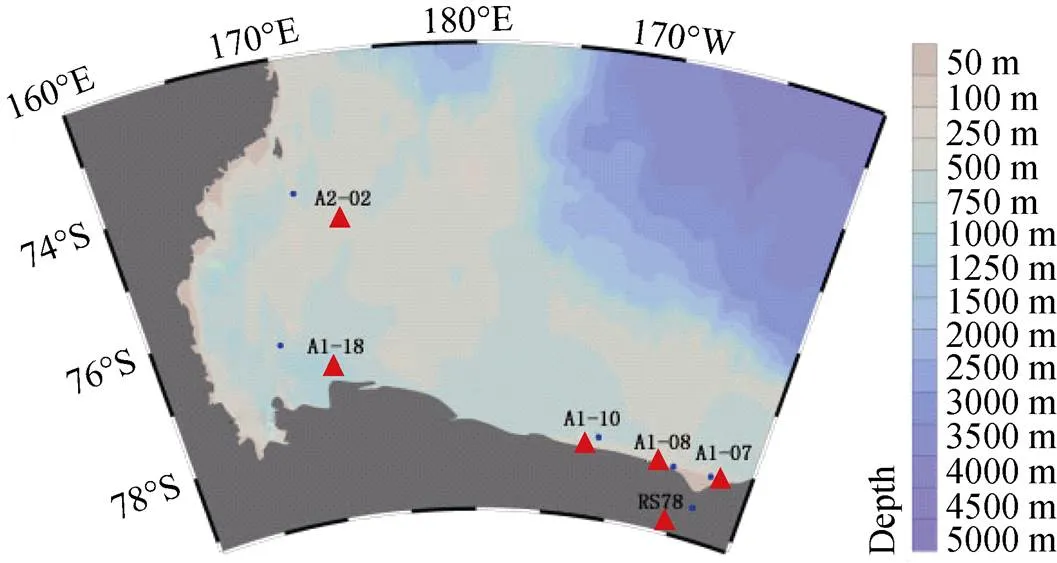
图1 样品采集站位图
Fig. 1. Sample collection stations
1.2 培养基
细菌培养基(2216E培养基): 蛋白胨5 g, 酵母粉1 g, 琼脂18 g, 陈海水1 000 mL, 高温高压灭菌20 min。真菌培养基(PDA培养基): 土豆200 g, 葡萄糖10 g, 琼脂17 g, 陈海水1 000 mL, 高温高压湿热灭菌20 min。产酶培养基分别为: 产淀粉酶培养基[22], 产酪蛋白酶培养基[23], 产纤维素酶培养基[24]。
1.3 细菌、真菌的分离培养及菌种保藏
将采集的南极沉积物样品称取约1 g于10 mL无菌海水中, 取5 mL混匀后的样品悬液加到等体积无菌海水中, 混匀静置过夜。
将预处理后的样品悬液系列稀释至原来的10–1、10–2、10–3, 分别取100 µL涂布于细菌和真菌培养基平板, 于12℃培养。培养7—10 d后, 根据菌落形态、色素、干燥等特征, 挑取形态差异较大的菌落进行划线纯化。挑取纯化后的单菌落, 分别在4°C下用斜面培养基保种和在﹣80°C下用30%甘油保种。
1.4 鉴定及系统发育分析
1.4.1 16S rDNA扩增
按照细菌基因组DNA提取试剂盒(中国天根生化科技有限公司)的操作手册进行DNA的提取。将提取的DNA作为DNA模板。采用通用引物27F: 5′-AGAGTTTGATCCTGGCTCAG-3′及1492R: 5′-GGTTACCTTGTTACGACTT-3′,扩增16S rRNA序列[25]。PCR反应体系为: 2×Taq PCRSuperMix(Tiangen)25 µL, 双蒸水21 µL, 引物各1 µL, 模板DNA 2 µL。PCR反应程序: 94°C预变性5 min, 94°C变性30 s; 55°C退火30 s; 72°C延伸90 s; 30个循环, 最后72°C延伸10 min。
1.4.2 真菌18S/ITS基因序列扩增
将筛选纯化的真菌在PDA培养基上培养7—10 d后, 刮取50 mg左右菌苔, 在研钵中间断地加入液氮研磨, 参照中国天根生化科技有限公司植物基因组DNA提取试剂盒的操作说明书提取真菌DNA。
18S/ITS区段的扩增采用通用引物18S/ITS1: 5′-TCCGTAGGTGAACCTGCGG-3′和18S/ITS4: 5′-TCCTCCGCTTATTGATATGC-3′(引物由生工生物工程股份有限公司合成)进行扩增。PCR反应体系为: 2×Taq PCRSuperMix(Tiangen)25 µL, 双蒸水21 µL, 引物各2 µL, 模板DNA 3 µL。扩增程序为: 94°C DNA双链预变性5 min, 94°C变性30 s; 55°C退火30 s; 72°C延伸40 s; 共30个循环, 最后72°C延伸10 min。各取10 µLPCR扩增产物经1%琼脂糖凝胶电泳检测, 有特异性明亮条带的PCR产物送擎科生物技术有限公司(山东青岛)测序。
1.4.3 系统发育树的构建
将测定细菌的16S rDNA和真菌18S/ITS基因序列提交到NCBI的GenBank数据库进行BLAST序列比对(http://www.ncbi.nlm.nih.gov/blast/ blast.cgi), 选择与GenBank中的参考菌株的16S rDNA 序列进行比较分析。采用MEGA6.0软件的邻接法进行系统发育分析, 构建系统发育树[26]。
1.5 胞外水解酶活性检测
1.5.1 细菌API20NE鉴定
细菌的理化性质采用非发酵G-杆菌鉴定试剂盒API20NE (bioMerieux, 法国)。根据分子鉴定结果选取细菌每个种属的代表性菌株进行测定,操作过程在室温下进行。具体操作步骤依照API20NE说明书。
1.5.2 真菌产胞外酶活性
(1) 淀粉酶(amylase)活性初筛: 将每一个平板平分成四份, 菌株用灭菌牙签在淀粉培养基上点种4株, 12°C培养4—7 d, 每天观察。在菌落周围滴加新鲜配制的碘液。菌落周围出现无色透明圈的说明菌株具有淀粉酶活性, 为阳性, 透明圈的大小表示淀粉酶活性的强弱[27]; 菌落周围未出现无色透明圈的, 说明菌株无淀粉酶活性, 为阴性。
(2) 酪蛋白酶(caseinase)活性初筛: 将每一个平板平分成四份, 菌株用灭菌牙签在酪蛋白酶的培养基上点种4株, 12°C培养4—7 d, 每天观察。在长出菌落的培养基上, 覆盖40%的三氯乙酸10— 15 min后, 倒去三氯乙酸溶液, 菌落周围呈现透明圈者说明菌株具有酪蛋白酶活性, 为阳性, 透明圈的大小表示酪蛋白酶活性强弱[28]; 菌落周围未出现无色透明圈的, 说明菌株无酪蛋白酶活性, 为阴性。
(3) 纤维素酶(cellulase)活性初筛: 将每一个平板平分成四份, 菌株用灭菌牙签在纤维素酶的培养基上点种4株, 12°C培养4—7 d, 每天观察。在长出菌落的培养基上, 覆盖1 mg·mL–1的刚果红溶液, 静置10—15 min后, 倒去刚果红溶液, 加入1 mol·L–1的NaCl溶液, 15 min后倒掉NaCl溶液, 菌落周围出现无色透明圈者说明菌株具备纤维素酶活性, 为阳性, 透明圈的大小表示纤维素酶活性强弱[29]; 菌落周围未出现无色透明圈者说明菌株无纤维素酶活性, 为阴性。
2 结果
2.1 可培养菌株的分子鉴定
从罗斯海采集的沉积物样品中分离的微生物, 根据菌落形态特征进行纯化, 共分离获得78株细菌、54株真菌, 部分细菌、真菌照片如图2、图3所示。分别进行16S rRNA和18S/ITS鉴定, 得到13个属的78株细菌、5个属的54株真菌, 具体见表2、表3。
78株细菌中, 嗜冷杆菌属()为优势类群, 有20株; 黄杆菌属()17株; 希瓦氏菌属()14株; 假单胞菌属()9株; 科贝特氏菌属()6株; 盐单胞菌属()3株; 苏特氏菌()2株; 噬冷菌()2株; 海旋菌()1株; 类芽胞八叠球菌()1株; 鞘脂菌属()1株; 动球菌属()1株; 柠檬胞菌()1株。
54株真菌中, 枝孢属()为优势类群, 有33株; 链格孢属() 13株; 青霉菌属() 5株; 壳二孢属() 2株; 金担子菌属() 1株。
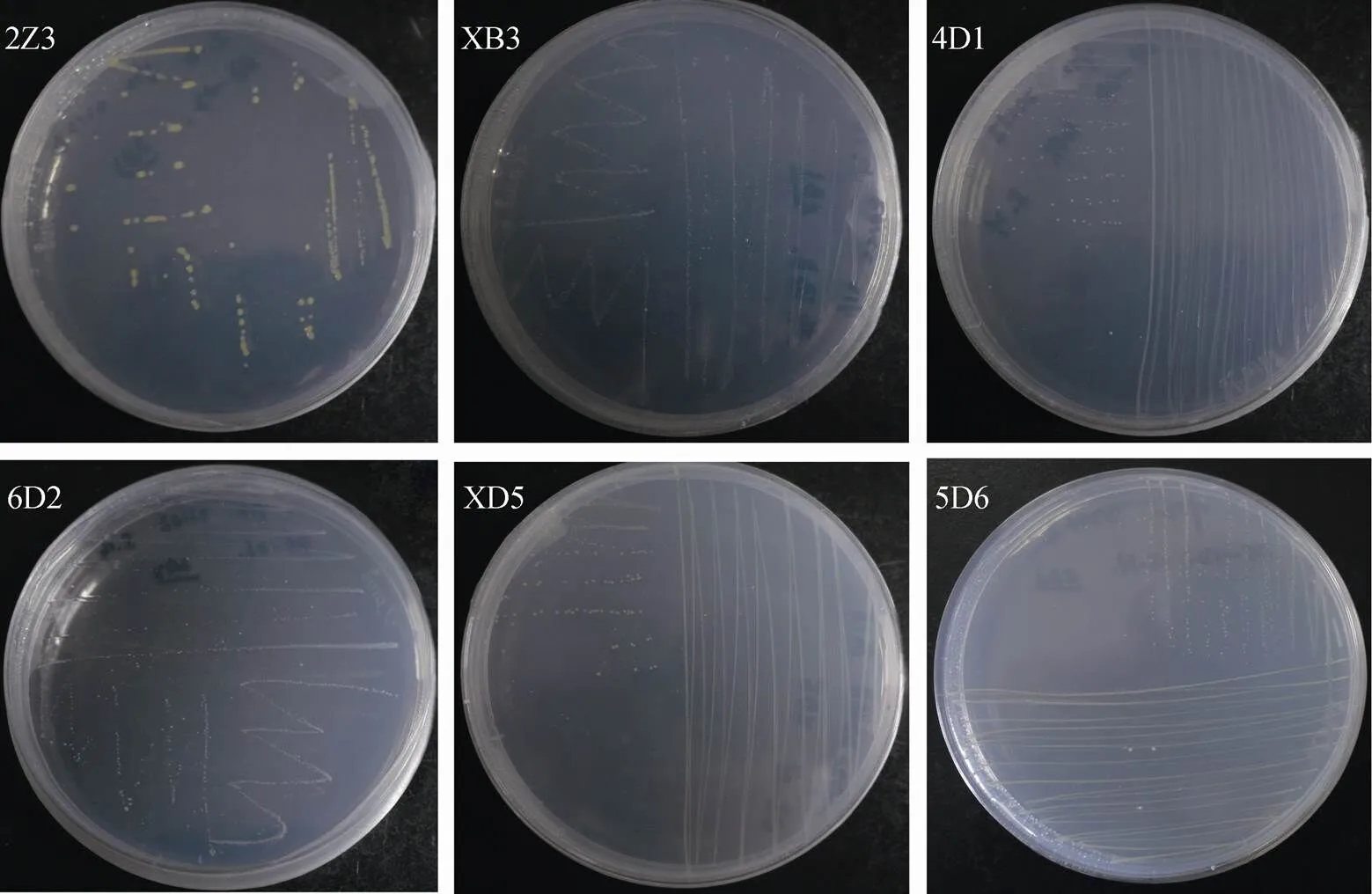
图2 部分细菌菌落图片. 2Z3: Flavobacterium sp; XB3: Cobetia sp.; 4D1: Shewanella sp.; 6D2: Psychrobacter sp.; XD5: Flavobacterium sp.;5D6: Sphingobium sp.
Fig.2. Partial pictures of bacteria. 2Z3:sp; XB3:sp; 4D1:sp; 6D2:sp; XD5:sp;5D6:sp
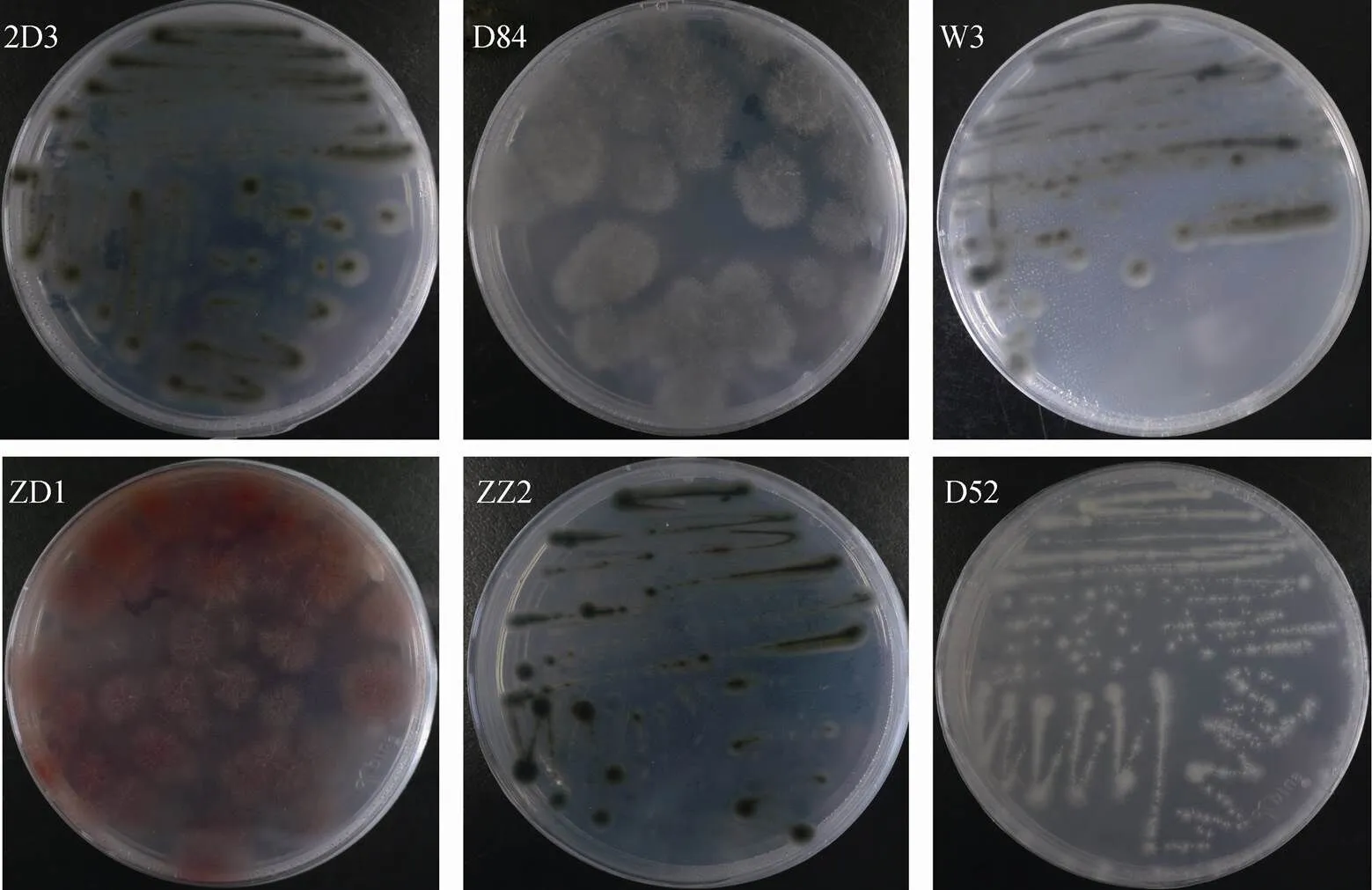
图3 部分真菌菌落图片. 2D3: Cladosporium sp.;D84: Alternaria sp.; W3: Cladosporium sp.; 2D1: Ascochyta sp.;ZZ2: Cladosporium sp.;D52: Penicillium sp.
Fig.3. Partial pictures of fungi. 2D3:sp;D84:sp; W3:sp; 2D1:sp;ZZ2:sp;D52:sp

表2 罗斯海沉积物中可培养细菌的分离鉴定

续表2
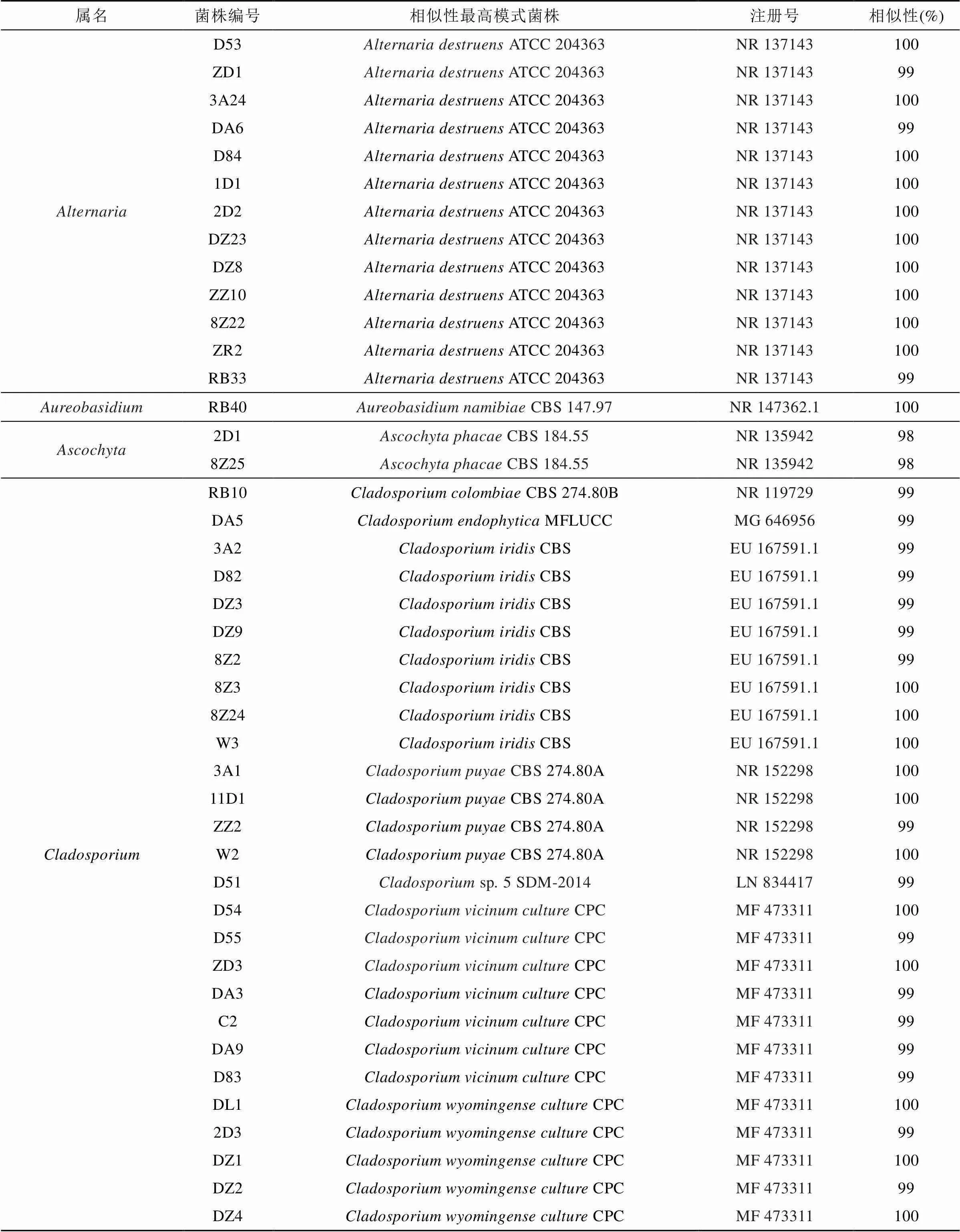
表3 罗斯海沉积物中可培养真菌的分离鉴定
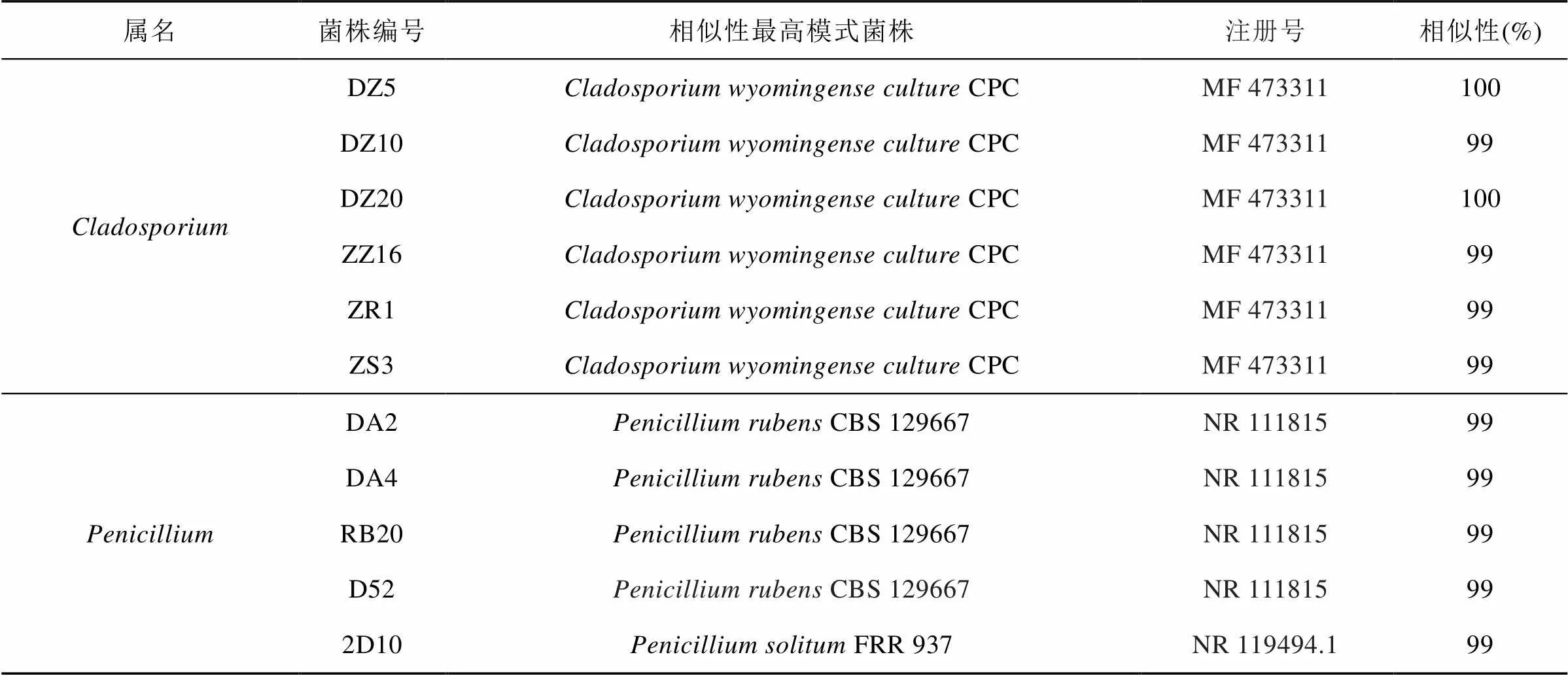
续表
将测得的细菌、真菌基因序列通过Blast程序与GenBank中核酸数据库进行对比分析, 使用N-J法建树, 构建的菌株系统进化树分别如图4、图5所示。获得的78株细菌(数据根据鉴定表来确定)的序列在NCBI中选择与GenBank中的参考菌株16S rDNA 序列进行比较分析后, 其相似度均在98%—100%之间, 而XD2、3D1这2株菌株相似度分别为97%、95%, 可能代表了潜在的细菌新物种[30]。54株真菌(数据根据鉴定表来确定)的序列在NCBI中选择与GenBank 中的参考菌株的ITS序列进行比较分析后, 其相似度均在98%—100%之间。
2.2 胞外水解酶活性检测
2.2.1 细菌API20NE鉴定
从沉积物样品中分离到的细菌中选取代表性菌株, 采用API20NE非发酵G-杆菌鉴定试剂盒测定其理化性质, 具体见表4。
结果表明, 100%的菌株都能将硝酸盐还原成亚硝酸盐和氮气, 几乎所有的菌株不能产生吲哚、脲酶、β-半乳糖苷酶等反应; XD1、DC20等10株菌可产生精氨酸双水解酶活性; XD1、DC20、2Z1等菌株具有脲酶活性。XB3菌株可产生蛋白酶。实验菌株具有代谢各种化合物的能力, 如菌株3D1能将硝酸盐还原成亚硝酸盐和氮气, 能产生精氨酸水解酶、脲酶, 同化葡萄糖、阿拉伯糖、甘露糖、甘露醇、葡萄糖酸钾、己二酸、苹果酸; 菌株XB3能将硝酸盐还原成亚硝酸盐和氮气, 能产生精氨酸水解酶、脲酶、蛋白酶和β-半乳糖苷酶(对硝基苯-β-D-半乳糖吡喃糖苷酶), 同化甘露醇、麦芽糖、葡萄糖酸钾。
2.2.2 可培养真菌产胞外酶活性测定
依据分子鉴定结果选择不同种的可培养真菌进行胞外酶活性测定, 结果表明: 54株真菌中, 有18株真菌产生淀粉酶, 43株真菌产酪蛋白酶, 35株真菌产纤维素酶, 有16株菌同时产生三种酶, 其中DA2、DA4菌株产生的透明圈非常清晰。具体见表5。部分酶活筛选平板如图6所示。
3 讨论
获得可培养微生物是微生物资源利用的基础, 在南极可培养微生物多样性研究方面, 目前取得了一定的研究成果。本研究通过对南极罗斯海区域沉积物的细菌、真菌进行分离、纯化和培养, 基于16S rDNA、ITS基因序列进行了系统发育分析, 最终获得含有13个属的细菌78株、5个属的真菌54株。Bowman等[31]也利用16S rDNA分子鉴定, 发现南极海冰中细菌种群的主要部分是类群。本研究鉴定的真菌菌属类别与陈皓文等[32]、孔华忠和齐祖国[33]鉴定出的真菌菌属类别不完全一致, 例如本研究分离出的链格孢属、壳二孢属、金担子菌属与陈皓文等[32]、孙华忠和齐祖国[33]鉴定出的曲霉菌属、散子囊菌属、布鲁迪帚霉、梅林瓶霉等菌属类的不同, 这种差异可能是由于采样地点、采样时间、样品处理等因素的影响造成的, Arenz和Blanchette[34]采用分离培养的方法对比分析了南极干谷、罗斯海地区和南极半岛三个南极无冰区土壤中的真菌多样性, 发现采集地区不同, 分离得到真菌的种类不同, Tabacchioni等[35]、Sørheim等[36]的研究也发现用不同的培养基分离培养获得的菌株间差异较大, 因而有可能导致真菌多样性存在一定差异。
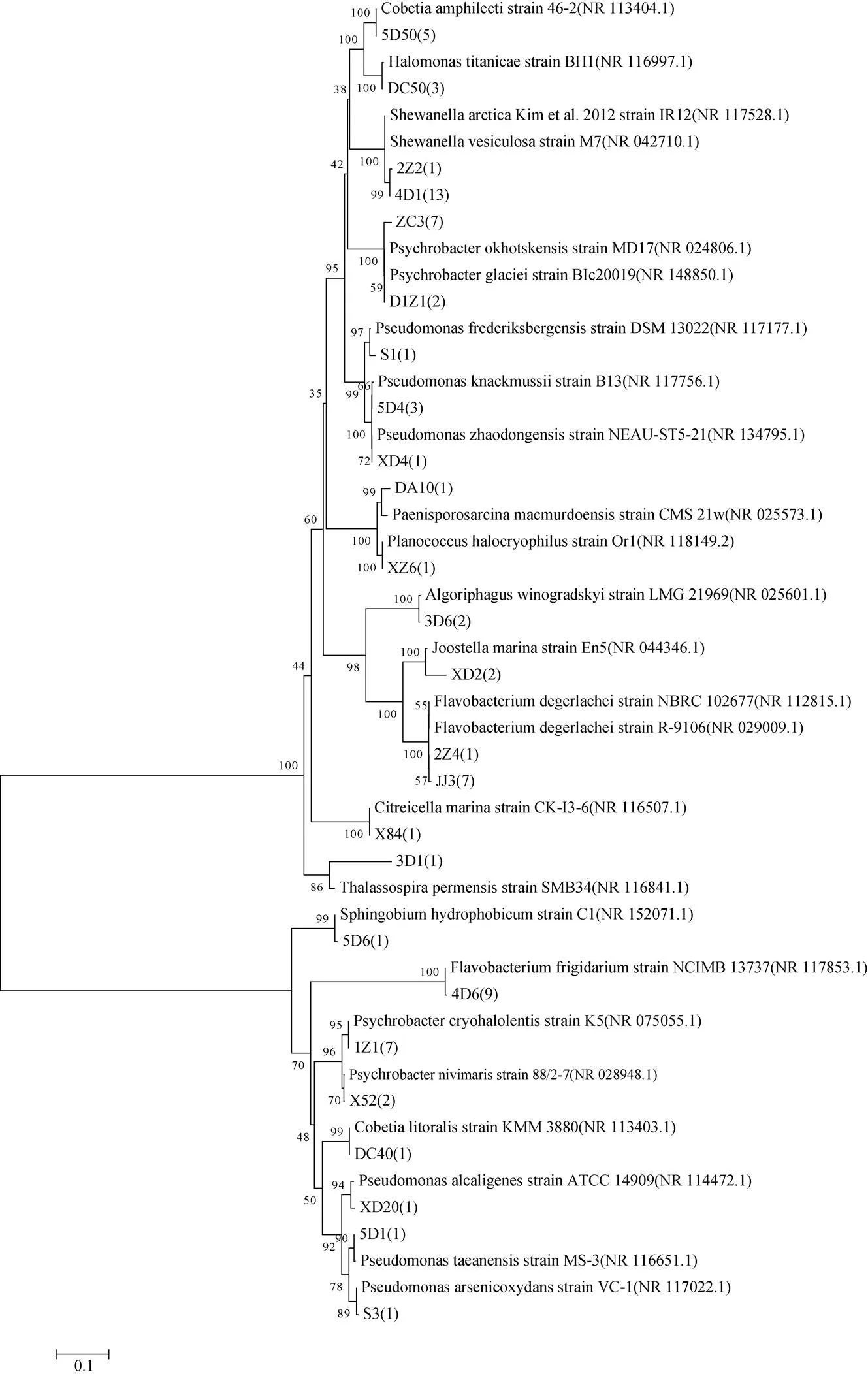
图4 南极罗斯海区域细菌16S rRNA基因序列构建的菌株系统进化树(bootstrap=1000)
Fig.4. The phylogenetic tree based on 16S rRNA sequences of bacteria isolated from Ross Sea region of Antarctica (bootstrap=1000)
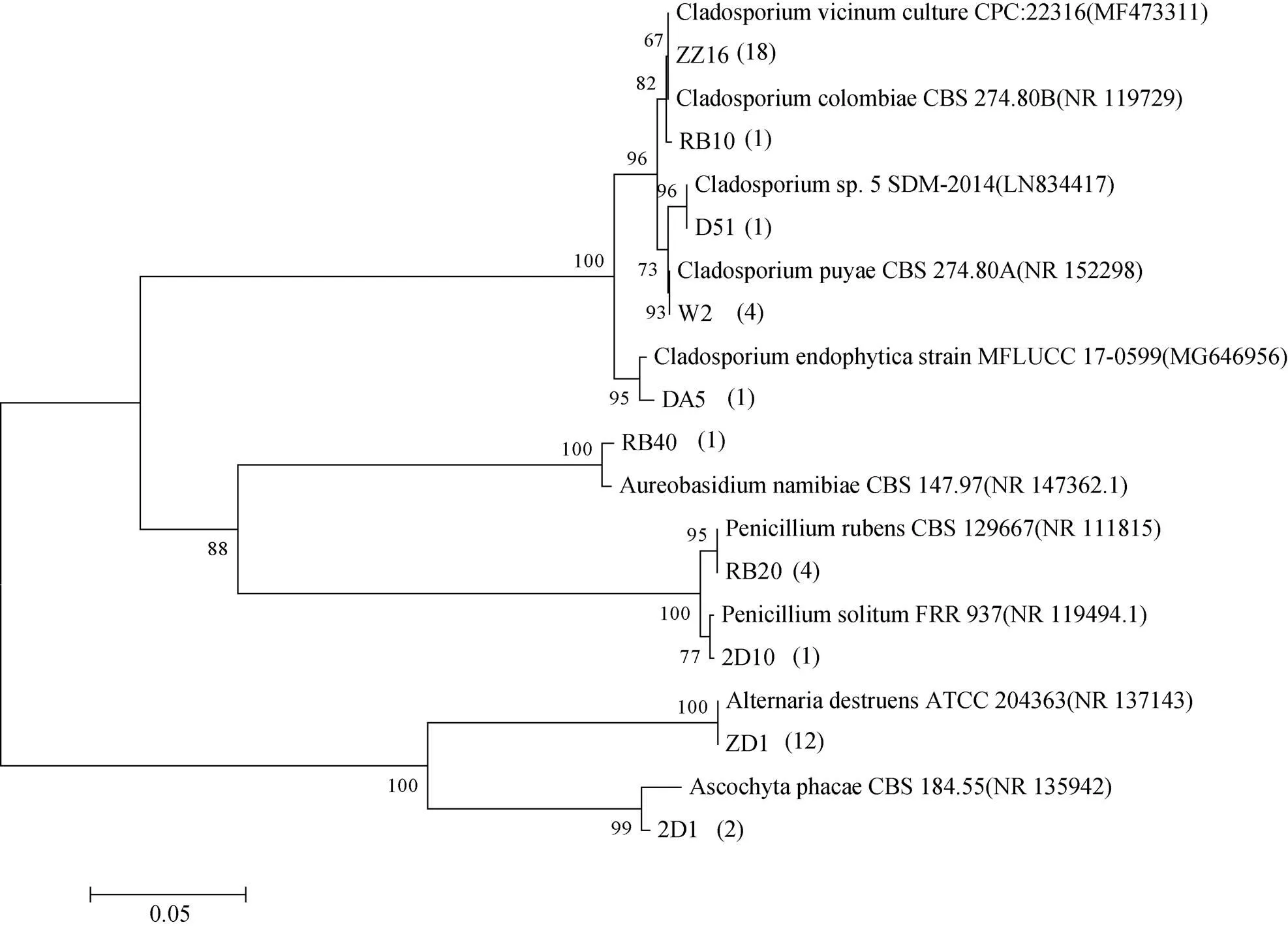
图5 南极罗斯海区域真菌18S/ITS基因序列构建的菌株系统进化树(bootstrap=1000)
Fig.5. The phylogenetic trees based on 18S/ITS sequences of fungus isolated from Ross Sea region of Antarctica and the closely related sequences (bootstrap=500)

表4 可培养细菌API生理生化测定结果
注: (1) N03、TRP、、、、ESC、GEL、PNPG分别代表硝酸盐还原、吲哚产生、葡萄糖发酵、精氨酸双水解、脲酶、水解α-葡萄糖苷酶、水解(蛋白酶)和β-半乳糖苷酶反应。(2) GLU、ARA、MNE、MAN、NAG、MAL、GNT、CAP、ADI、MLT、CIT、PAC分别代表葡萄糖、阿拉伯糖、甘露糖、甘露醇、乙酰葡萄糖胺、麦芽糖、葡萄糖酸钾、羊蜡酸、己二酸、苹果酸、枸橼酸钠、苯乙酸。(3) +为阳性反应, —为阴性反应
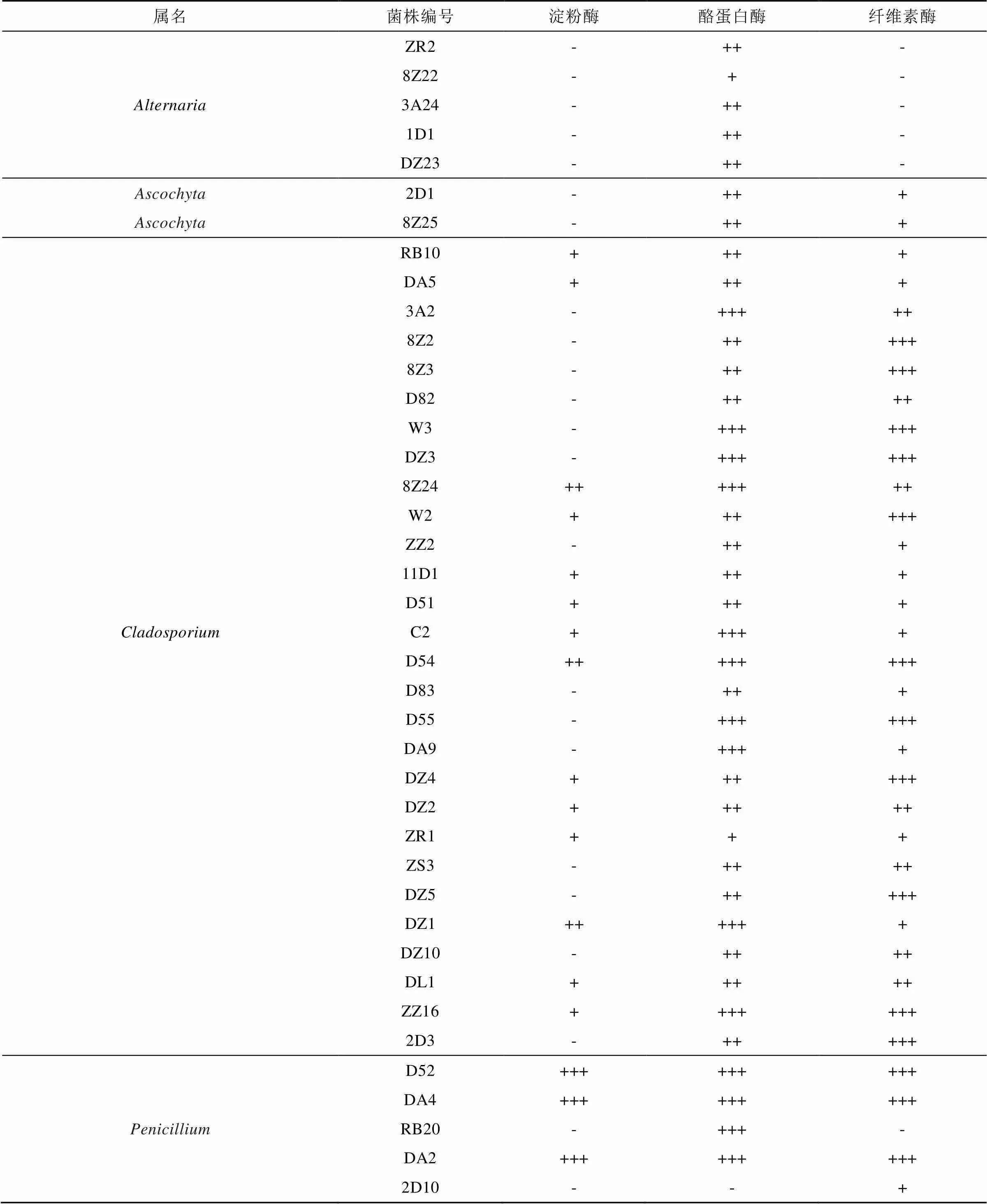
表5 可培养真菌产胞外酶活性测定结果
注: “+++”表示透明圈非常大, “++”表示透明圈较大, “+”表示透明圈较小, “-”表示无透明圈
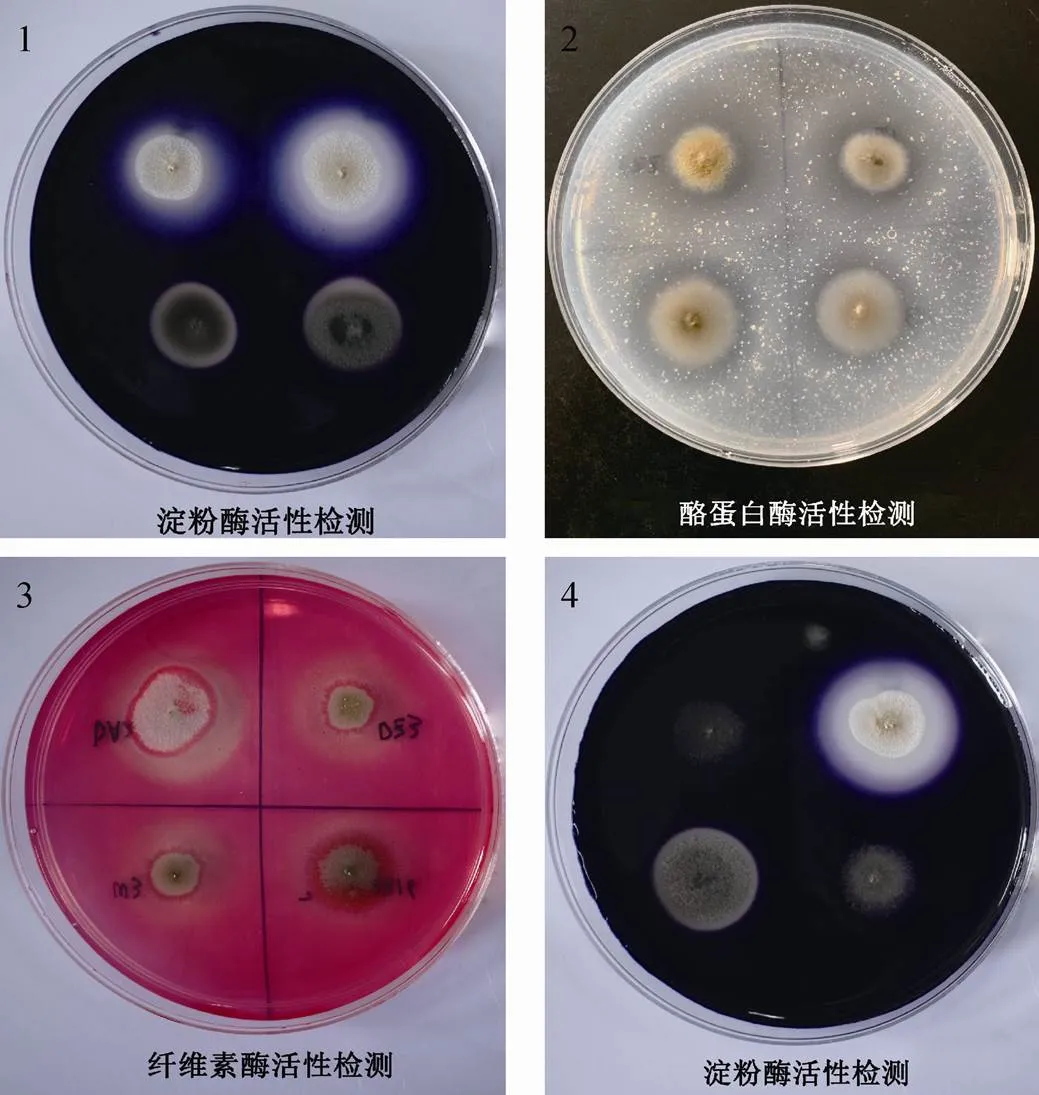
图 6 部分酶活性检测结果
南极是产新型生物活性物质和先导化合物(酶、抗生素等)菌株的重要来源地[37]。近年来对南极可培养微生物产酶性能的研究已经成为研究热点。如王全福等[38]发现生长在南极低温环境下的嗜冷菌和适冷菌为了适应低温环境, 使代谢系统中的酶在低温下保持较高活性, 它的最适酶活温度会比相应中温酶低。李昭和孙谧[39]对分离出的187株细菌全部进行了过氧化氢酶活性检测, 共有96株细菌具有过氧化氢酶活性, 67株细菌具有弱过氧化氢酶活性。从本研究对可培养细菌理化性质的鉴定和真菌产胞外低温酶活性初步测定的实验结果可看出, 细菌具有硝酸盐还原酶活性、精氨酸双水解酶活性、脲酶活性及蛋白酶活性, 蛋白酶是可水解蛋白质的一系列工业生物催化剂, 筛选出的可产蛋白酶的菌株为蛋白质的降解提供潜在的利用资源。真菌中大多数菌株产生淀粉酶、酪蛋白酶和纤维素酶, 由透明圈大小可显示出酶活力较好, 但具体的酶活性有待进一步验证。
本实验对南极罗斯海区域沉积物样品中可培养微生物的多样性、理化性质和酶活性进行研究, 结果说明南极罗斯海区域沉积物中可培养微生物具有良好的多样性和丰富性, 获得的细菌中有潜在的新种。这在理论上丰富了我们对南极微生物资源的认知, 并获得了一批可培养的、经过标准化鉴定的南极菌株, 未来可以深入探究南极菌在进化、生物学特性等方面的特点, 深入研究菌种个体的生物活性, 进而揭示南极生物适应南极特殊环境的规律; 亦可以利用现在获得的菌种资源, 在低温酶、药物先导化合物等方面进行应用潜力研究, 为南极微生物的开发利用奠定基础。
1 刘春影, 丛柏林, 王能飞, 等. 南极菲尔德斯半岛可培养土壤微生物多样性及理化性质鉴定[J]. 海洋学报, 2016(6): 69-81.
2 郑洲, 缪锦来, 李光友. 南极微生物中特殊酶类的研究进展[J]. 中国海洋药物, 2005, 24(4): 49-55.
3 屈建航, 李宝珍, 袁红莉. 沉积物中微生物资源的研究方法及其进展[J]. 生态学报, 2007, 27(6): 2636-2641.
4 丁新彪, 丛柏林, 张扬, 等. 南极普里兹湾及邻近海域沉积物微生物多样性与生理生化研究[J]. 海洋科学进展, 2014, 32(2): 209-218.
5 刘晨光, 刘成圣, 刘万顺, 等. 海洋生物酶的研究和应用[J]. 海洋科学, 2000, 24(7): 24-26.
6 OLIVERA N L, SEQUEIROS C, NIEVAS M L. Diversity and enzyme properties of protease-producing bacteria isolated from sub-Antarctic sediments of Isla de Los Estados, Argentina[J]. Extremophiles, 2007, 11(3): 517-526.
7 FELLER G, THIRY M, ARPIGNY J L, et al. Lipases from psychrotropic Antarctic bacteria[J]. FEMS Microbiology Letters, 1990, 66(1/2/3): 239-243.
8 ARPIGNY J L, FELLER G, GERDAY C. Cloning, Sequence and Structural Features of a Lipase from the Antarctic Facultative Psychrophile Psychrobacter Immobilis B10[J]. Biochimica Et Biophysica Acta, 1993, 1171(3): 331-333.
9 CHOO D W. A cold-adapted lipase of an Alaskan psychrotroph, Pseudomonas sp. strain B11-1 : gene cloning and enzyme purification and characterization[J]. Appl. Environ. Microbiol. 1998, 64(2): 486-491.
10 RASHID N, SHIMADA Y, EZAKI S, et al. Low-temperature lipase from psychrotrophic Pseudomonas sp. strain KB700A[J]. Appl Environ Microbiol, 2001, 67(9): 4064-4069.
11 陈秀兰, 张玉忠, 王运涛, 等. 深海适冷菌SM9913产生的低温蛋白酶[J]. 海洋科学, 2001, 25(1): 4-9.
12 张刚, 汪天虹, 张臻峰, 等. 产低温淀粉酶的海洋真菌筛选及研究[J]. 海洋科学, 2002, 26(2): 3-5.
13 林学政, 侯旭光, 李光友. 南极微生物低温酶的研究进展[J]. 海洋科学, 2002(10): 38-42.
14 郑雷, 郑苗壮. 南极罗斯海海洋保护区的发展趋势研究[J]. 中国海洋大学学报(社会科学版), 2014(6): 20-24.
15 HINZ K, DOSTMANN H, FRITSCH J. The continental margin of Morocco: seismic sequences, structural elements and geological development[J]. Geology of the Northwest African Continental Margin, 1982: 34-60.
16 ANDERSON J B. Geology and hydrocarbon potential of the Antarctic continental margin[J]. Mineral Resources Potential of Antarctica, Antarct Res Ser, 1990, 51: 175-201.
17 赵杰臣, 张林, 田忠翔,等. 南极罗斯海2012年夏季海冰特征分析[J]. 极地研究, 2014, 26(3): 342-351.
18 BLACKMAN D K, VON HERZEN R P, LAWVER L A. Heat flow and tectonics in the western Ross Sea, Antarctica[J]. Circum Pacific Council Publications, 1987: 179.
19 TAVIANI M, BEU A G. The palaeoclimatic significance of Cenozoic marine macrofossil assemblages from Cape Roberts Project drillholes, McMurdo Sound, Victoria Land Basin, East Antarctica[J]. Palaeogeography Palaeoclimatology Palaeoecology, 2003, 198(1): 131-143.
20 WEI Y, JIN J, NIE Y, et al. Sources of organic matter and paleo-environmental implications inferred from carbon isotope compositions of lacustrine sediments at Inexpressible Island, Ross Sea, Antarctica[J]. Advances in Polar Science, 2016, 27(4): 233-244.
21 王家凯, 李铁刚, 熊志方, 等. 南极罗斯海氧化还原敏感元素沉积地球化学特征及其古海洋意义[J]. 海洋地质与第四纪地质, 2018, 38(5): 115-124.
22 陈金春, 陈国强, 雷明光, 等. 高等院校生命科学与技术实验教材, 微生物学实验指导[M]. 北京: 清华大学出版社, 2005.
23 杨天波. 蛋白酶水解酪蛋白透明圈初筛方法的条件探索与应用效应[J]. 河北大学学报(自然科学版), 1982, 2(2): 19-23.
24 AGUILAR R, J.A RAMIREZ, GARROTE G, et al. Kinetic study of the acid hydrolysis of sugar cane bagasse[J]. Journal of Food Engineering, 2002, 55(4): 309-318.
25 BOSSHARD P P, SANTINI Y, GRÜTER D, et al. Bacterial diversity and community composition in the chemocline of the meromictic alpine Lake Cadagno as revealed by 16S rDNA analysis[J]. FEMS Microbiology Ecology, 2000, 31(2): 173-182.
26 KOICHIRO T, GLEN S, DANIEL P, et al. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
27 张晓华. 海洋微生物学[M]. 青岛: 中国海洋大学出版社, 2007.
28 常显波. 不同环境海洋放线菌多样性研究及2株放线菌新菌的分类鉴定[D]. 青岛: 中国海洋大学, 2011.
29 TEATHER R M, WOOD P J. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J]. Applied and Environmental Microbiology, 1982, 43(4): 777-780.
30 WEISBURG W G S, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703.
31 BOWMAN J P. Biodiversity, community structural shifts, and biogeography of prokaryotes within Antarctic continental shelf sediment[J]. Appl Environ Microbiol, 2003, 69(5): 2463-2483.
32 陈皓文, 袁峻峰, 曹俊杰, 等. 南极菲尔德斯半岛环境微生物含量估计[J]. 海洋科学进展, 2001, 19(1): 49-54.
33 孔华忠, 齐祖国. 南极乔治王岛的丝状真菌[J]. 真菌学报, 1991,10(1): 57-60.
34 ARENZ B E, BLANCHETTE R A. Distribution and abundance of soil fungi in Antarctica at sites on the Peninsula, Ross Sea Region and McMurdo Dry Valleys[J]. Soil Biology & Biochemistry, 2011, 43(2): 308-315.
35 TABACCHIONI S, CHIARINI L, BEVIVINO A, et al. Bias caused by using different isolation media for assessing the genetic diversity of a natural microbial population[J]. Microbial Ecology, 2000, 40(3): 169-176.
36 SØRHEIM R, TORSVIK V L, GOKSØYR J. Phenotypical divergences between populations of soil bacteria isolated on different media[J]. Microbial Ecology, 1989, 17(2): 181-192.
37 曾胤新, 陈波. 南极低温微生物研究及其应用前景[J]. 极地研究, 1999, 11(2): 143-152.
38 王全富, 缪锦来, 李光友, 等. 南极微生物产低温蛋白酶菌株的筛选、分子鉴定及部分酶活特性[J]. 中国水产科学, 2005, 12(4): 437-444.
39 李昭, 孙谧. 南极海水可培养微生物及其过氧化氢酶活性研究[C]//全国第二届海洋与陆地多糖多肽及天然创新药物研发学术会议论文集, 2015.
ISOLATION OF CULTURABLE STRAINS FROM ANTARCTIC ROSS SEA SEDIMENTS AND STUDY OF EXTRACELLULAR HYDROLASE ACTIVITY
Wang Fei1, Cong Bailin2, Zhang Zhaohui2, Yang Huanghao1
(1Fuzhou University, Fu Zhou 350108, China;2First Institute of Oceanography, Ministry of Natural Resources, Qingdao 266061, China)
To evaluate the potential of Antarctic microbial resources for exploitation, we isolated culturable bacteria from sediments collected from the Ross Sea region in Antarctica and examined their diversity and extracellular enzyme activities. Pure cultured bacteria and fungi were isolated using Zobell 2216E medium and potato dextrose agar(PDA). Diversity and phylogeny of culturable microorganisms were analyzed using 16S rDNA and 18S/ITS sequencing. We found 79 strains of bacteria and 54 strains of fungi, of whichandwere dominant. Phenotypic similarity with model strain was low (less than 97%) in two bacterial strains, indicating the potential discovery of new species. Results from API20NE tests show that most strains have extracellular hydrolase activity. This study provides new information on culturable microbial resources in Antarctica and lays the foundation for exploitation of Antarctic microbial resources.
Ross Sea, culturable strains, ectoenzyme
2019 年9 月收到来稿, 2019 年11 月收到修改稿
“十三五”国家重点研发计划(2018YFC1406701)资助
王飞, 女, 1991 年出生。硕士研究生, 主要从事极地微生物研究。E-mail: wangfeiguofen@163.com
丛柏林, E-mail: biolin@fio.org.cn
10. 13679/j.jdyj.20190051

