滇龙胆8-羟香叶醇氧化还原酶基因的克隆与表达分析
王伟妍 李彩霞 李湫 鄢秋紫 张晓东

摘要: 滇龍胆主要药效成分为龙胆苦苷,而8-羟香叶醇氧化还原酶基因Gr8HGO是龙胆苦苷生物合成途径的结构基因。为了研究Gr8HGO基因的功能,该文克隆了滇龙胆Gr8HGO基因,并进行表达分析。结果表明:(1)共克隆到5个Gr8HGO基因,其GenBank登录号分别为KP722029.1(Gr8HGO-1)、KP722030.1(Gr8HGO-2)、KP722031.1(Gr8HGO-3)、KP722032.1(Gr8HGO-4)、KP723852.1(Gr8HGO-5)。(2)Gr8HGO-1基因全长1 062 bp,编码353个氨基酸,其他4个基因全长1 131 bp,编码376个氨基酸;理化性质分析结果表明5个蛋白单体相对分子质量约40 kD,理论等电点在5.47~5.95之间,均为疏水稳定蛋白。(3)信号序列分析结果表明5个蛋白均不含信号肽、跨膜螺旋和叶绿体转运肽;亚细胞定位分析结果表明5个蛋白可能定位于细胞质;结构域预测结果表明除Gr8HGO-1蛋白仅包含乙醇脱氢酶N端结构域(IPR013154)和C端结构域(IPR013149)外,其他4个蛋白还包含聚酮合酶、烯酰还原酶结构域(IPR020843)。(4)系统发育分析结果表明这些Gr8HGO蛋白与长春花Cr8HGO蛋白亲缘关系最近。(5)qPCR结果表明Gr8HGO基因主要在叶中表达,在根和茎中表达量很低。该研究为后续龙胆苦苷生物合成途径的解析奠定基础。
关键词: 滇龙胆, 8-羟香叶醇氧化还原酶, 克隆, 生物信息学, 基因表达
中图分类号: Q786文献标识码: A
文章编号: 1000-3142(2020)02-0200-10
Abstract: Gentiopicroside is the main active ingredient in Gentiana rigescens, while 8-hydroxygeraniol oxidoreductase gene Gr8HGO is a structural gene involved in gentiopicroside biosynthesis. In order to study the function of Gr8HGO gene, the Gr8HGO gene in G. rigescens was cloned and its expression analysis was conducted in this study. The results were as follows: (1) Five Gr8HGO genes were cloned and their GenBANK accession numbers were KP722029.1 (Gr8HGO-1), KP722030.1 (Gr8HGO-2), KP722031.1 (Gr8HGO-3), KP722032.1 (Gr8HGO-4) and KP723852.1 (Gr8HGO-5), separately. (2) The length of Gr8HGO-1 gene was 1 062 bp encoding 353 amino acids, while the other four genes were 1 131 bp encoding 376 amino acids; The results from physicochemical analysis showed that the relative molecular weight of these five Gr8HGO proteins were approximately 40 kD, and their theoretical pI ranged from 5.47 to 5.95, which were all hydrophobic stable proteins. (3) Signal sequence analysis showed that five proteins did not contain signal peptides, transmembrane helixes and chloroplast transit peptides; Subcellular localization analysis indicated that these five proteins might be localized in cytoplasm; Domain prediction results showed that beside the Gr8HGO-1 contained only alcohol dehydrogenase N-terminal (IPR013154) and C-terminal (IPR013149) conserved domains, the other four also contained polyketide synthase, enoylreductase domain (IPR020843). (4) Phylogenic analysis showed that these five Gr8HGO proteins had the closest relationship with Cr8HGO in Catharanthus roseus. (5) The results of qPCR suggested that Gr8HGO gene was mainly expressed in leaves, but very low in roots and stems. This study will lay a foundation for further analysis of the biosynthesis pathway of gentiopicroside.
Key words: Gentiana rigescens, 8-hydroxygeraniol oxidoreductase, cloning, bioinformatics, gene expression
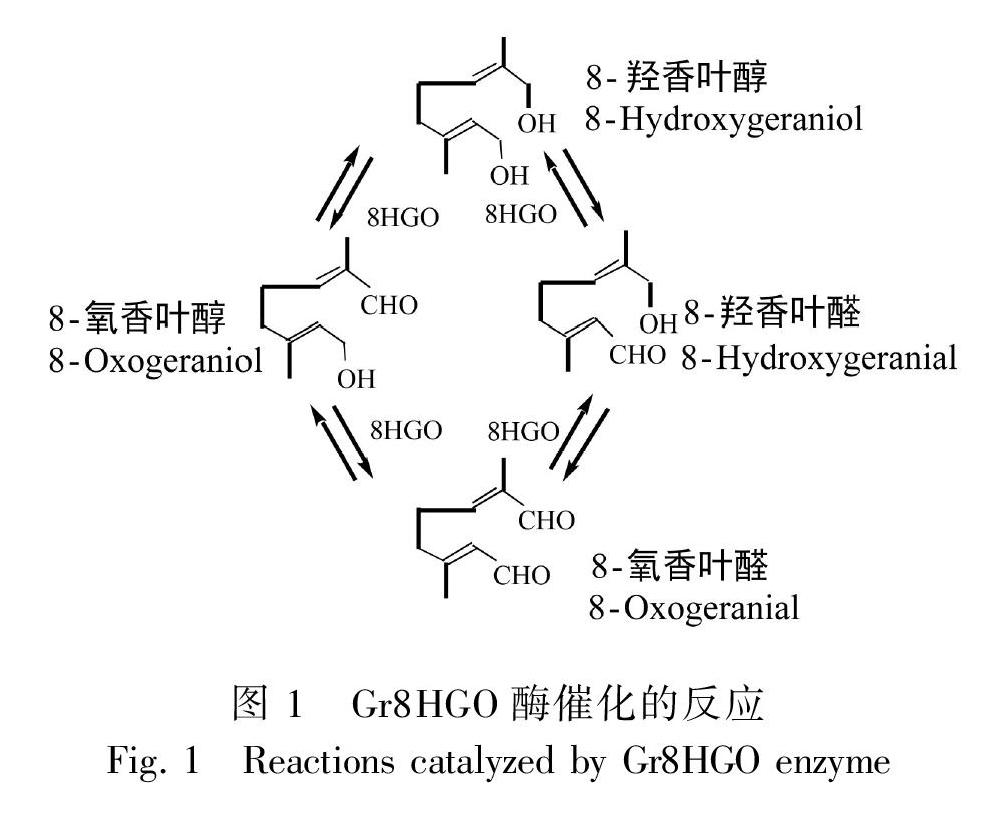
滇龙胆(Gentiana rigescens)为龙胆科(Gen-tianaceae)龙胆属(Gentiana)植物,主要分布于我国西南地区的云南、四川、贵州等地(中国植物志编委会, 1988)。在传统中药中,滇龙胆药用部位为根,具有清热燥湿、泻肝胆火的作用(国家药典委员会, 2015)。现代研究表明滇龙胆根部主要药用成分为一种单萜类化合物龙胆苦苷(Zhang et al., 2015; 张晓东等, 2016)。在植物中,龙胆苦苷的生物合成可分为三个阶段。第一阶段是由质体2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径和胞质甲羟戊酸(MVA)途径合成原料异戊二烯焦磷酸(IPP)和二甲基丙烯基焦磷酸(DMAPP)(Hua et al., 2014);第二阶段是以IPP和DMAPP为原料,经过缩合、氧化、还原、糖基化、甲基化等步骤,生成裂环番木鳖苷(Miettinen et al., 2014; Munkert et al., 2015);第三阶段是是萜类化合物经过修饰形成龙胆苦苷(黄璐琦和刘昌孝, 2015)。8-羟香叶醇氧化还原酶(8-hydroxygeraniol oxidoreductase,EC 1.1.1.324,在已报道文献中简写为8HGO、10HGO)是龙胆苦苷生物合成途径第二阶段中的第四个催化酶,能够催化8-羟香叶醇、8-羟香叶醇、8-氧香叶醛和8-氧香叶醛之间的转化(Ikeda et al., 1991; Salim et al., 2013; De Luca et al., 2014; Miettinen et al., 2014; Dugé De Bernonville et al., 2015; Liu et al., 2015; Padhan et al., 2015; Cao et al., 2016; Rai et al., 2017)。
鉴于8HGO在单萜生物合成中的重要性,8HGO基因已从长春花(Miettinen et al., 2014)、喜树(Valletta et al., 2010)、川西獐牙菜(Liu et al., 2017)、秦艽(Cao et al., 2016)、大花胡麻草等多种植物中分离。但是,目前8HGO基因仅在长春花中的研究最为清楚。在长春花中,Cr8HGO蛋白在8-羟香叶醇、8-羟香叶醛、8-氧香叶醇、NAD+存在的条件下,根据组合和培养时间的不同,产生以上三种复合物和8-氧香叶醛的混合物的相对比例不同,因此,该酶被命名为8-羟香叶醇氧化还原酶(图1)(Miettinen et al., 2014)。在NAD+辅因子存在下,Cr8HGO蛋白不能转换8-氧香叶醛,在辅因子NADP+/NADPH存在下,Cr8HGO蛋白不能催化8-羟香叶醇、8-羟香叶醛、8-氧香叶醇三个底物(Miettinen et al., 2014)。有趣的是,Cr8HGO蛋白对香叶醇、反式-2-己烯醇、法尼醇、橙花醇、异苯基苄醇、辛醇等初级醇也具有相对较高的活性(Miettinen et al., 2014)。由于存在4种相互转化的化合物和8种可能的反应,反应动力学相当复杂,因此反应常数无法确定(Miettinen et al., 2014)。在基因表达方面,长春花Cr8HGO基因的表达受非生物因素的影响。在长春花悬浮培养细胞中,Cr8HGO基因能够被茉莉酸甲酯(MeJA)强烈诱导表达;而在幼苗中,Cr8HGO基因在MeJA处理6 h后被轻微诱导表达;在悬浮细胞中过表达ORCA2(硬脂酸应答的长春花花分生组织决定基因2/乙烯响应因子)并不能诱导Cr8HGO的表达,过表达ORCA3反而抑制Cr8HGO基因的表达(Miettinen et al., 2014)。在UV-B胁迫15 min和60 min下,长春花幼苗叶片中Cr10HGO基因表达上调0.75倍;在UV-B胁迫后,黑暗培养72 h,Cr10HGO蛋白含量是对照组的1.98倍,其下游产物异胡豆苷增加约5倍(Zhu et al., 2015)。
为了探究滇龙胆Gr8HGO基因是否参与龙胆苦苷生物合成、其他单萜的生物合成等代谢过程,为龙胆苦苷和单萜类生物合成提供优质基因资源,本研究根据前期本课题组的滇龙胆叶和根的转录组数据库,设计引物,对滇龙胆Gr8HGO基因进行克隆,并进行序列分析、原核表达载体构建和组织器官特异性表达分析,为今后阐明Gr8HGO基因在龙胆苦苷合成中的作用奠定基础。
1材料与方法
1.1 材料
滇龙胆(Gentiana rigescens)植株采自于临沧耀阳生物医药有限公司后箐基地,种植于玉溪师范学院后勤基地。使用滇龙胆幼叶进行RNA提取,使用土壤栽培两年生滇龙胆的根、茎和叶进行基因表达分析,取样日期为2018年4月30日。
1.2 方法
1.2.1 叶片总RNA提取、反转录及Gr8HGO基因ORF的克隆使用植物RNA提取试剂盒MiniBEST Plant RNA Extraction Kit(Takara,大連)进行滇龙胆幼叶总RNA的提取;使用逆转录试剂盒PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit(Takara,大连)进行cDNA的合成。参照pET32a原核表达载体的多克隆位点和滇龙胆转录组数据库中Gr8HGO基因序列,设计一对特异性引物Gr8HGOBamHI-F:GGATCCATGACTAAAACCATTA
CTCCTGC(下划线为BamHI酶切位点),Gr8HGOXhoI-R:CTCGAGTTAAAACTTAATTACAA
CCTTAACAC(下划线为XhoI酶切位点)。以上述cDNA为模板进行PCR扩增,扩增产物经回收后克隆到pMD19-T载体(Takara,大连)。转化大肠杆菌DH5α感受态细胞(Takara,大连)后。挑取菌落后,提质粒,经双酶切检测正确后送生工生物工程上海股份有限公司进行DNA测序,获得重组质粒pMD19-Gr8HGO。
1.2.2 原核表达载体构建使用双酶切、连接的方法构建原核表达载体pET32a-Gr8HGO(张晓东等, 2016)。
1.2.3 Gr8HGO基因及其编码蛋白的序列分析使用NCBI-BLASTp软件进行蛋白同源性比对,使用离线软件DNAMAN 7进行多序列比对;使用MEGA X离线软件的Clustal W进行多序列比对,然后使用NJ法创建系统发育树,Bootstrap=1 000;利用網络软件对基因稀有密码子进行分析(张晓东等, 2016)。使用ChloroP v1.1预测叶绿体转运肽;使用在线InterPro软件预测蛋白保守结构域;使用在线软件ProtScale分析蛋白的亲疏水性;使用在线软件SPOMA预测蛋白的二级结构;使用在线软件Phyre2预测蛋白的三级结构;使用SWISS-MODEL进行同源建模分析;利用Expasy中的TMHMM服务器V2.0预测蛋白的跨膜螺旋区;利用Plant-mPLoc、WOLF PSORT和ProtComp 9.0三个软件对蛋白的亚细胞定位情况进行预测。
1.2.4 Gr8HGO基因的表达分析分别提取两年生滇龙胆的根、茎和叶的总RNA,使用反转录试剂盒PrimeScriptTM RT Master Mix (Perfect Real Time)(Takara,大连)合成第一链cDNA。根据Gr8HGO基因序列设计一对特异性引物qGr8HGO-F(5′-AGGACAAACAGTGTACCACC-3′)和qGr8HGO-R(5′-CAACCTCTCTCCAAGCTGCC-3′),用于所有Gr8HGO基因的表达分析。以滇龙胆GrACTIN基因为内参,使用嵌合荧光检测试剂盒TB GreenTM Premix Ex TaqTM Ⅱ(Takara,大连)进行qPCR。每个反应重复3次。反应在LightCycler 480 Ⅱ荧光定量PCR仪(Roche,瑞士)上进行扩增,扩增结果使用内参基因校准后,采用比较Ct值的“2-△△Ct”的方法自动计算出根、茎、叶中Gr8HGO基因相对表达量。
2结果与分析
2.1 滇龙胆Gr8HGO基因序列的克隆
以逆转录获得的cDNA为模板,使用基因特异黑色表示相似性等于100%;粉红色表示75%≤相似性<100%;浅蓝色表示50%≤相似性<75%。
性引物共克隆到5个Gr8HGO基因,分别为Gr8HGO-1(KP722029.1)、Gr8HGO-2(KP722030.1)、Gr8HGO-3(KP722031.1)、Gr8HGO-4(KP722032.1)、Gr8HGO-5(KP722052.1),其中Gr8HGO-1基因ORF长1 062 bp,编码353个氨基酸;其余4条基因ORF长1 131 bp,编码376个氨基酸。
2.2 Gr8HGO基因的生物信息学分析
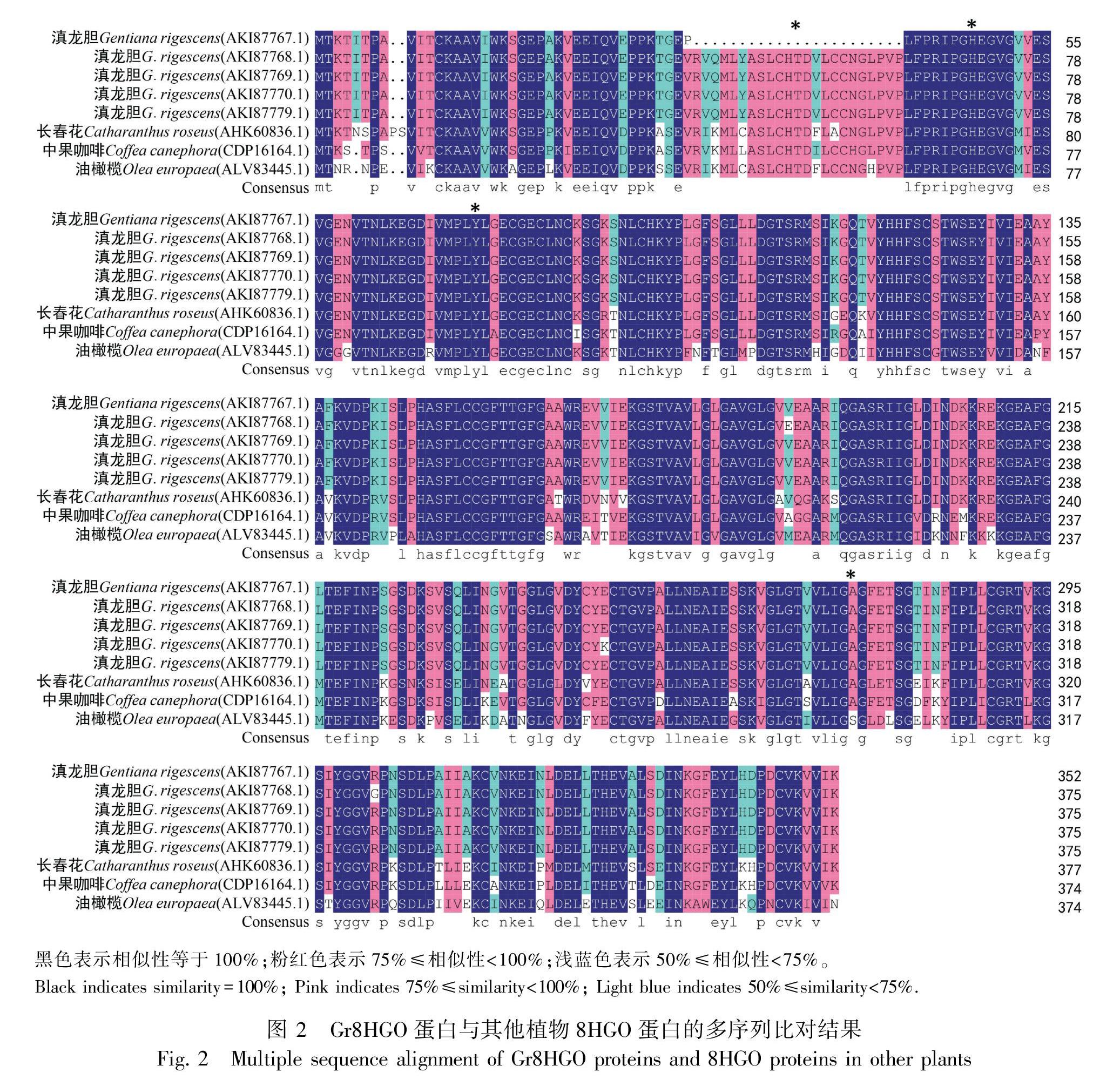
利用GenBank数据库中的BLASTp程序和DNAMAN 7对Gr8HGO蛋白的氨基酸序列进行相似性分析,结果表明滇龙胆Gr8HGO-1、Gr8HGO-2、Gr8HGO-3、Gr8HGO-4、Gr8HGO-5蛋白与长春花Cr8HGO蛋白序列相似性均最高,分别为84.31%、84.31%、84.84%、84.57%、84.84%,其次是中果咖啡81.25%、81.07%、81.33%、81.07%、81.33%,再次是油橄榄73.86%、73.87%、74.13%、73.87%、74.13%。多序列比对分析结果表明5个Gr8HGO蛋白与已知8HGO蛋白序列相似性很高(图2),总体相似度高达91.27%。利用MEGA X将Gr8HGO氨基酸序列与BLASTp比对中相似性较高的蛋白氨基酸序列进行系统发育分析,结果显示5个滇龙胆Gr8HGO蛋白与长春花Cr8HGO蛋白处于同一进化枝(图3),表明它们的亲缘关系较近。
使用Expasy ProtParam工具对5个Gr8HGO蛋白和Cr8HGO蛋白的理化性质进行分析,结果表明在N端部分Gr8HGO-1蛋白比其他4个Gr8HGO蛋白少23个氨基酸,后4个Gr8HGO蛋白与Cr8HGO蛋白大小相似(表1)。与Cr8HGO相比,5个Gr8HGO蛋白带正负电荷的氨基酸残基数目相差较大,导致其理论pI更偏酸性(表1)。5个Gr8HGO蛋白与Cr8HGO都为疏水稳定蛋白,但是前者的疏水性更强(表1)。使用ProtScale软件对5个Gr8HGO蛋白与Cr8HGO蛋白进行疏水性分析,结果与表1一致。5个Gr8HGO蛋白与Cr8HGO蛋白在大肠杆菌、酵母和哺乳动物细胞体内的半衰期都分别大于10、 20和30 h。对5个Gr8HGO基因进行稀有密码子分析,结果显示这些基因中稀有密码子含量均低于0.85%,且无稀有密码子连续出现的情况,因此可使用大肠杆菌BL21或Rosetta(DE3)进行诱导表达。
利用SPOMA服务器对5个Gr8HGO蛋白与Cr8HGO蛋白的二级结构进行分析,结果表明Gr8HGO-1的α-螺旋(H)含量最高,延伸链(E)含量最低,5个Gr8HGO蛋白的β-转角(T)含量高于Cr8HGO,Gr8HGO-2中无规则卷曲含量最低(表2)。
利用SignalP 4.1服务器对5个Gr8HGO蛋白与Cr8HGO蛋白的信号肽序列进行分析,结果均没有发现信号肽,表明这些蛋白都是非分泌型蛋白(表2)。使用TMHMM2.0软件预测5个Gr8HGO蛋白与Cr8HGO蛋白的跨膜螺旋区,结果表明这些蛋白都不包含跨膜螺旋区域,为非膜蛋白(表2)。使用ChloroP v1.1 Server对5个Gr8HGO蛋白与Cr8HGO蛋白的叶绿体转运肽进行预测,结果表明这些蛋白不包含叶绿体转运肽(表2)。
使用Plant-mPLoc软件和ProtComp 9.0软件进行亚细胞定位分析,结果是5个Gr8HGO蛋白和Cr8HGO蛋白均定位于细胞质 (表3)。而使用WOLF PSORT Prediction软件进行亚细胞定位分析的结果是这些蛋白最可能为分泌蛋白(表3)。
利用SWISS-MODEL Workspace的自动模式预测5个Gr8HGO蛋白和Cr8HGO蛋白的三级结构,结果如表4,表明滇龙胆5个Gr8HGO蛋白属于Ⅱ类乙醇脱氢酶,而长春花Cr8HGO属于Ⅲ类乙醇脱氢酶(图4)。与其他蛋白相比,Gr8HGO-1蛋白在N末端缺失23个氨基酸,导致其在三维结构模型上表现为蛋白左上侧的β片层结构减少(图4)。
使用InterPro71.0在线软件对5个Gr8HGO蛋白和Cr8HGO蛋白进行保守结构域分析,结果表明Gr8HGO-1蛋白仅包含乙醇脱氢酶N端结构域(IPR013154)和C端结构域(IPR013149),而后4个Gr8HGO蛋白和Cr8HGO蛋白除具有以上两个保守结构域外,还具有聚酮合酶、烯酰还原酶结构域(IPR020843)(表5)。在催化Zn结合位点方面,Gr8HGO-1仅具有2个结合位点,而后4个Gr8HGO蛋白和Cr8HGO蛋白具有4个结合位点;在结构Zn结合位点方面,所有蛋白都具有4个结合位点;在NAD结合位点方面,Gr8HGO-1仅具有20个结合位点,而后4个Gr8HGO蛋白和Cr8HGO蛋白则具有22个结合位点;在底物结合位点方面,Gr8HGO-1仅具有3个结合位点,比后4个Gr8HGO蛋白和Cr8HGO蛋白少一个结合位点;在二聚体界面方面,所有蛋白都具有29个界面接触位点(表5)。GO注释结果表明所有蛋白均参与氧化还原过程(GO:0055114),分子功能为Zn2+结合(GO:0008270)和氧化还原酶活性(GO:0016491),未预测到其在细胞组分中的作用。
2.3 Gr8HGO-2基因原核表达载体构建
使用限制性内切酶BamHI和XhoI对质粒pET32a-Gr8HGO-2进行双酶切检测,结果能够切出目的片段和载体(图5), 表明Gr8HGO-2基因已成功插入原核表达载体pET32a中。
2.4 Gr8HGO基因的组织表达分析
根据5个Gr8HGO基因序列,设计一对检测5个基因表达情况的引物, 通过qRT-PCR技术对Gr8HGO基因在两年生滇龙胆的根、茎和叶等组织器官中的表達情况进行分析,结果显示Gr8HGO基因在叶中表达量最高,分别是根和茎中的31.46倍和26.70倍,根和茎中仅有少量表达(图6)。
3讨论
龙胆苦苷是滇龙胆、龙胆、三花龙胆和条叶龙胆、秦艽、川西獐牙菜等中药材的主要药效成分(Hua et al., 2014; 国家药典委员会, 2015; Liu et al., 2017),因此克隆滇龙胆龙胆苦苷生物合成途径中的基因并对其进行组织特异性表达分析,对于揭示这一类药材主要药效成分的生物合成都具有重要意义。在滇龙胆生产中,主要存在龙胆苦苷含量低(Pan et al., 2015)和连作障碍(来源于临沧耀阳生物药业科技公司)两个问题,可通过合成生物学手段工厂化生产龙胆苦苷和培育高龙胆苦苷含量的新品种来解决,但前提是需要首先阐明龙胆苦苷的生物合成途径。8-羟香叶醇氧化还原酶是龙胆苦苷和其他单萜类生物合成途径中的重要的催化酶(Cao et al., 2016),因此8HGO基因的表达情况能够直接影响这些药材龙胆苦苷的生物合成。本研究基于滇龙胆转录组数据库,在滇龙胆中克隆到5个8HGO基因,表明在滇龙胆中8HGO基因可能存在功能冗余现象。
高效的途径工程需要不同途径组分的细胞和亚细胞组织的精确知识(Miettinen et al., 2014)。本研究使用Plant-mPLoc和ProtComp 9.0软件对5个Gr8HGO蛋白和Cr8HGO蛋白进行亚细胞定位预测,结果为所有蛋白均定位于细胞质,这与通过Cr8HGO与GFP融合表达试验获得的长春花Cr8HGO蛋白定位结果一致(Miettinen et al., 2014)。而WOLF PSORT软件预测的结果却是Gr8HGO蛋白最可能为分泌蛋白,这是由于不同软件的预测方法不同所致。ProtComp 9.0软件综合了蛋白质定位预测的许多方法,如基于神经网络的预测方法,与已知定位同源蛋白的直接比较的方法,预测某些功能肽序列如线粒体和叶绿体信号肽、转运肽和跨膜区段的方法等。上海交通大学沈红斌教授开发的Plant-mPLoc软件,是基于已知定位的1 055个蛋白质序列数据库的预测方法,该软件解决了单个蛋白存在多种亚细胞定位的问题(Chou & Shen, 2010)。而WOLF软件是由日本人较早开发的基于分类信号模序和相关序列特征如氨基酸组成等进行预测的软件。因此,进行蛋白亚细胞定位预测时,需要使用多种软件进行综合分析。
在本研究中,三维模型预测结果表明,5个Gr8HGO蛋白与Cr8HGO蛋白的活性形式为二聚体,这与5个Gr8HGO蛋白与Cr8HGO蛋白都具有29个二聚体界面接触位点相一致,与在印度萝芙木中,Rs10HGO蛋白活性形式是单体的结果不同(Ikeda et al., 1991)。因此,需要通过实验来进一步验证。
组织器官特异性表达分析结果显示,本研究中的Gr8HGO基因主要在叶中表达,而在根和茎中几乎不表达。这与滇龙胆的主要药效成分龙胆苦苷主要在叶中合成、根中累积的结果相一致(杨美权等, 2011; 朱宏涛等, 2011),这表明所克隆的5个Gr8HGO基因在叶中而不是根中促进龙胆苦苷的生物合成。由于5个Gr8HGO基因的高度相似性,很难设计特异性引物将它们的组织特异性表达区分开,因此目前无法判断究竟是哪一个或哪几个Gr8HGO基因在叶中高表达,今后可采用高通量测序技术加以区分。我们的结果与在喜树中Ca8HGO主要在茎和叶中表达,在喜树碱累积的根中不表达的结果相一致(Valletta et al., 2010)。而与在两年生花期的麻花艽Gs10HGO基因在花中表达量最高,其次是根,表达量最低的是叶的结果刚好相反(Zhou et al., 2016),与在温室栽培的印度獐牙菜植株中Sc8HGO基因在叶和根中均表达(Padhan et al., 2015)、在川西獐牙菜中Sm8HGO基因在根、茎、叶和花中的表达量差异不大(Liu et al., 2017)的结果也不同。以上结果表明滇龙胆和喜树具有相似的活性成分合成与累积模式,而与麻花艽和印度獐牙菜不同。下一步将对Gr8HGO蛋白进行诱导表达、蛋白纯化和酶活性分析,为该基因功能的阐明奠定基础。
参考文献:
CAO XY, GUO XR, YANG XB, et al., 2016. Transcriptional responses and gentiopicroside biosynthesis in methyl jasmonate-treated Gentiana macrophylla seedlings [J]. PLoS ONE, 11(11): e0166493.
CHOU KC, SHEN HB, 2010. Plant-mPLoc: A top-down strategy to augment the power for predicting plant protein subcellular localization [J]. PLoS ONE, 5(6): e11335.
DE LUCA V, SALIM V, THAMM A, et al., 2014. Making iridoids/secoiridoids and monoterpenoid indole alkaloids: progress on pathway elucidation [J]. Curr Opin Plant Biol, 19: 35-42.
DUG DE BERNONVILLE T, FOUREAU E, PARAGE C, et al., 2015. Characterization of a second secologanin synthase isoform producing both secologanin and secoxyloganin allows enhanced de novo assembly of a Catharanthus roseus transcriptome [J]. BMC Genomics, 16(1): 619.
Editorial Board of Flora of China, 1988. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 62: 100. [中国植物志编委会, 1988. 中国植物志 [M]. 北京: 科学出版社, 62: 100. ]
HUA WP, ZHENG P, HE YH, et al., 2014. An insight into the genes involved in secoiridoid biosynthesis in Gentiana macrophylla by RNA-seq [J]. Mol Biol Rep, 41(7): 4817-4825.
HUANG LQ, LIU CX, 2015. Molecular pharmacognosy [M]. 3rd ed. Beijing: Science Press: 239-243. [黄璐琦, 刘昌孝, 2015. 分子生药学 [M]. 3版. 北京: 科学出版社: 239-243. ]
IKEDA H, ESAKI N, NAKAI S, et al., 1991. Acyclic monoterpene primary alcohol: NADP+ oxidoreductase of Rauwolfia serpentina cells: the key enzyme in biosynthesis of monoterpene alcohols [J]. J Biochem, 109(2): 341-347.
JIN H, ZHANG J, ZHANG JY, et al., 2013. Gentiana rigescens [M]. Kunming: Yunnan Science and Technology Press: 1-5. [金航, 張霁, 张金渝, 等, 2013. 滇龙胆 [M]. 昆明: 云南科技出版社: 1-5. ]
LIU Y, SONG LL, YU WW, et al., 2015. Light quality modifies camptothecin production and gene expression of biosynthesis in Camptotheca acuminata Decne seedlings [J]. Ind Crop Prod, 66: 137-143.
LIU Y, WANG Y, GUO FX, et al., 2017. Deep sequencing and transcriptome analyses to identify genes involved in secoiridoid biosynthesis in the Tibetan medicinal plant Swertia mussotii [J]. Sci Rep, 7: 43108.
MIETTINEN K, DONG L, NAVROT N, et al., 2014. The seco-iridoid pathway from Catharanthus roseus [J]. Nat Comm, 5: 3606-3616.
MUNKERT J, POLLIER J, MIETTINEN K, et al., 2015. Iridoid synthase sctivity is common among the plant progesterone 5β-reductase family [J]. Mol Plant, 8(1): 136-152.
National Pharmacopoeia Committee, 2015. Chinese Pharmacopoeia [M]. Part I. Beijing: China Pharmacopoeia Science and Technology Press: 96. [国家药典委员会, 2015. 中国药典 [M]. 一部. 北京: 中国医药科技出版社: 96. ]
PADHAN JK, KUMAR V, SOOD H, et al., 2015. Contents of therapeutic metabolites in Swertia chirayita correlate with the expression profiles of multiple genes in corresponding biosynthesis pathways [J]. Phytochemistry, 116(1): 38-47.
PAN Y, ZHANG J, ZHAO YL, et al., 2015. Investigation of metabolites accumulation in medical plant Gentiana rigescens during different growing stage using LC-MS/MS and FT-IR [J]. Bot Stud, 56(1): 14.
RAI A, KAMOCHI H, SUZUKI H, et al., 2017. De novo transcriptome assembly and characterization of nine tissues of Lonicera japonica to identify potential candidate genes involved in chlorogenic acid, luteolosides, and secoiridoid biosynthesis pathways [J]. J Nat Med, 71(1): 1-15.
SALIM V, YU F, ALTAREJOS J, et al., 2013. Virus-induced gene silencing identifies Catharanthus roseus 7-deoxyloganic acid-7-hydroxylase, a step in iridoid and monoterpene indole alkaloid biosynthesis [J]. Plant J, 76(5): 754-765.
VALLETTA A, TRAINOTTI L, SANTAMARIA AR, et al., 2010. Cell-specific expression of tryptophan decarboxylase and 10-hydroxygeraniol oxidoreductase, key genes involved in camptothecin biosynthesis in Camptotheca acuminata Decne (Nyssaceae) [J]. BMC Plant Biol, 10(1): 69.
YANG MQ, ZHANG JY, SHEN T, et al., 2011. Effects of different cultivation modes on gentiopicroside content in Gentiana rigescens [J]. J Jiangsu Agric Sci, (1): 287-289. [楊美权, 张金渝, 沈涛, 等, 2011. 不同栽培模式对滇龙胆中龙胆苦苷含量的影响 [J]. 江苏农业科学, (1): 287-289. ]
ZHANG XD, ALLAN AC, LI CX, et al., 2015. De novo assembly and characterization of the transcriptome of the Chinese medicinal herb, Gentiana rigescens [J]. Int J Mol Sci, 16(5): 11550-11573.
ZHANG XD, LI CX, WANG YZ, 2016. Cloning and expression analysis of GrCMS gene in Gentiana rigescens [J]. Bull Bot Res, 36 (2): 258-265. [张晓东, 李彩霞, 王元忠, 2016. 滇龙胆GrCMS基因的克隆与表达分析 [J]. 植物研究, 36(2): 258-265. ]
ZHOU DW, GAO S, WANG H, et al., 2016. De novo sequencing transcriptome of endemic Gentiana straminea (Gen-tianaceae) to identify genes involved in the biosynthesis of active ingredients [J]. Gene, 575(1): 160-170.
ZHU HT, ZHENG CW, ZHAO P, et al., 2011. Content analysis of gentiopicroside in wild and tissue culture seedlings of Gentiana rigescens [J]. Nat Prod Res Dev, 23 (3): 482-485. [朱宏涛, 郑传伟, 赵平, 等, 2011. 野生坚龙胆及其组培苗中龙胆苦苷的含量分析 [J]. 天然产物研究与开发, 23(3): 482-485. ]
ZHU W, YANG BX, KOMATSU S, et al., 2015. Binary stress induces an increase in indole alkaloid biosynthesis in Catharanthus roseus [J]. Front Plant Sci, 6: 582.
(责任编辑 周翠鸣)

