两种提取小鼠血清来源外泌体方法的比较
孙有良 王宇童
[摘要] 目的 比較超速离心法与纯化试剂盒提取法提取血清外泌体的有效性与实用性,为后续外泌体相关研究提供借鉴。 方法 将12只6~8周C57BL/6雄性小鼠按照随机数字表法分为两组,每组6只,即超速离心法提取组及纯化试剂盒提取组。分别用两种方法分离小鼠血清中的外泌体。使用纳米粒度及zeta电位仪(Nano ZS90)检测两组外泌体的粒径大小及分布;使用透射电子显微镜观察两种方法提取外泌体的形态结构;采用蛋白质印迹法(Western blot)检测外泌体标志蛋白的表达水平;对两种方法所提取外泌体中的核糖核酸(RNA)分离鉴定,比较两种方法提取外泌体中RNA的异同。 结果 两组所得的外泌体直径为30~150 nm,形态均为脂质双分子层囊泡样,Western blot法检测结果显示两组外泌体均表达标志蛋白cluster of differentiation 63和tumor susceptibility gene,差异无统计学意义(P > 0.05);与纯化试剂盒提取组比较,超速离心法提取组的外泌体浓度更高,差异有统计学意义(P < 0.05),且超速离心法提取组中外泌体所含RNA以microRNA为主,而纯化试剂盒提取组的外泌体中所含RNA主要为piRNA。 结论 超速离心法与纯化试剂盒提取法均能有效提取外泌体,但所得到的外泌体包含不同RNA成分,为外泌体的研究提供更有效的选择方法。
[关键词] 小鼠血清;外泌体;超速离心法;纯化试剂盒提取法
[中图分类号] Q26 [文献标识码] A [文章编号] 1673-7210(2020)03(a)-0004-04
[Abstract] Objective To compare the effectiveness and practicability of extraction of serum exosomes by ultracentrifugation and purification kit, and to provide references for subsequent exosome studies. Methods Twelve C57BL/6 male mice aged 6-8 weeks were divided into two groups by random table method, with 6 mice in each group, that was the ultracentrifugation extraction group and the purification kit extraction group. Exosomes in mouse serum were isolated by two methods. The particle size and distribution of exosomes in the two groups were detected by Nano particle size and zeta potentiometer(Nano ZS90). The morphological structures of exosomes were extracted by transmission electron microscopy. Western blot was used to detect the expression level of exosome marker proteins. Ribonucleic acid (RNA) was isolated and identified from exosomes extracted by the two methods. Results The outside diameter of the proceeds of two groups was 30-150 nm, and morphology was lipid bilayer vesicle. Western blot results showed that the exosomes in both groups expressed the marker protein cluster of differentiation 63 and tumor susceptibility gene, and the difference was not statistically significant (P > 0.05). Compared with the purification kit extraction group, the ultracentrifugation extraction group had a higher exosomes concentration, the difference was statistically significant (P < 0.05). Moreover, the RNA in the exosomes in the ultracentrifugation extraction group was mainly microRNA, while the RNA in the exosomes in the purification kit extraction group was mainly piRNA. Conclusion The ultracentrifugation and purification kit extraction method can both effectively extract exosomes, but the exosomes obtain different RNA components, which provides a more effective selection method for the study of exosomes.
[Key words] Mouse sera; Exosomes; Ultracentrifugation; Purification kit extraction method
外泌体是一种由多种细胞分泌的脂质双分子层囊泡结构,直径介于30~150 nm之间,可存在于血清、唾液、尿液等多种体液中[1-3]。外泌体是细胞间的一种新型通讯方式,可以影响机体的多种生理病理过程,如机体免疫应答、细胞分化、肿瘤侵袭等方面,因而近年外泌体的相关研究呈现“井喷式”增加[4-7]。研究发现,外泌体内容物极其丰富,包含核糖核酸(ribonucleic acid,RNA)、蛋白和脂类[8-9]。其中,一些表达于外泌体的特异性蛋白标志物如cluster of differentiation 63(CD63)、tumor susceptibility gene(TSG101)和hot shock protein 70(HSP70)等可以用于外泌體的鉴定[10-11]。对外泌体的基础研究和临床应用的开发都需要快速有效的分离方法,目前主要包括超速离心法、外泌体纯化试剂盒提取法以及聚乙二醇(polyethyleneglycol,PEG)沉淀法[12-14],但均未形成标准化体系,更鲜有研究比较这些方法的效率和实用性。本文旨在比较通过超速离心法及纯化试剂盒提取法从小鼠血清样品中提取外泌体的实验方法的实用性及有效性,并充分考虑了其在临床实验室和医疗点设置中的优缺点,为后续外泌体的研究和应用提供借鉴。
1 材料与方法
1.1 动物
6~8周C57BL/6雄性小鼠由北京华阜康生物科技股份有限公司提供[生产许可证号:SCXK(京)2019-0008,使用合格证号:SYXK(京)2018-0003]。饲养于首都医科大学实验动物中心,室温18~23℃,相对湿度45%~55%。按照随机数字表法将其分为两组,每组6只,即超速离心法提取组及纯化试剂盒提取组。
1.2 仪器与材料
CD63抗体(批号:25682-1-AP)、TSG101抗体(货号:ab125011)购于美国Abcam公司;MagCaptureTM Exosome Isolation Kit PS外泌体纯化试剂盒(批号:293-77601)购于北京经科宏达生物技术有限公司;QIAGEN抽提试剂盒(批号:217184)、PKH67绿色荧光细胞标记试剂盒(批号:PKH67GL-1KT)购于泰科兰博(北京)生物有限公司;纳米粒度及zeta电位仪(Nano ZS90)购于英国马尔文公司;LE-80 Ultracentrifuge 低温超速离心机(ITEM:24830)购于美国Beckman公司,转子半径11.1 cm;透射电镜(Tecnai G2 spititi)购于美国FEI公司。
1.3 方法
1.3.1 超速离心法提取外泌体 以尾静脉取血法分别从两组小鼠体内收集2 mL血清样品,加入13 mL磷酸盐缓冲液(PBS),300 g,4℃,离心10 min(离心机半径11.1 cm)。取上清,12 000 g,4℃,离心40 min。取上清,通过0.22 μm滤膜过滤。超速离心120 000 g,4℃,离心1.5 h,弃上清。沉淀用15 mL PBS溶液吹打洗涤,100 000 g,4℃,离心1 h,沉淀为外泌体。
1.3.2 纯化试剂盒提取外泌体 首先用固定缓冲液清洗60 μL 磁珠,掌式离心机离心1 min,去除上清,分别添加500 μL固定缓冲液及10 μL Biotin-labeled Exosome Capture。在2~10℃条件孵育10 min,离心去除缓冲液后用固定缓冲液清洗两次。向样品中添加binding enhancer及磁珠,在2~10℃条件下孵育3 h,去除溶液。预先准备洗涤缓冲液,添加binding enhancer,清洗磁珠,重复3次。添加50 μL elution buffer到清洗过的外泌体结合磁珠的反应管中,涡旋,室温静置10 min。离心后收集得到含外泌体的溶液。
1.3.3 外泌体粒径分析 吸取10 μL上述提取的外泌体样本,用PBS稀释为1 mL,用纳米粒度及ZETA电位仪进行测试。
1.3.4 透射电镜成像 将外泌体样本离心,吸取15 μL外泌体样本于铜网上静置1 min。使用滤纸将铜网上的外泌体样本吸干,然后吸取15 μL 2%醋酸双氧铀染色液室温染色1 min。使用滤纸将铜网上的外泌体样本吸干,将染色完成的样本放于灯下烤10 min,观察拍照。
1.3.5 蛋白印迹实验 向上述提取的外泌体悬液中添加上样缓冲液,95℃加热10 min变性。每个上样孔添加20 μg蛋白样品在10%丙烯酰胺凝胶中电泳2 h,电泳后使用电转仪2 h把蛋白质转移至PVDF膜上,5%脱脂奶粉封闭,在摇床孵育1 h,在4 ℃条件下孵育CD63、TSG101 以及HSP70一抗16 h,再隔日加入相应二抗室温孵育1 h,在蛋白成像系统中曝光成像。
1.3.6 外泌体所包含RNA的浓度检测 将小鼠血清样本溶于QIAzol Lysis Reagent中,加入氯仿,冰上静置10 min,12 000 g,4℃,离心15 min。提取上层水相,加入乙醇。样品再加入RNeasy MinElute离心柱,总RNA被结合到膜上。然后使用miRNeasy Serum/Plasma Spike-In Control进行标准化。
1.3.7 免疫荧光实验 将PKH67和稀释液按1∶50的比例配20 μL,PBS稀释成200 μL,PKH67和外泌体混匀室温孵育10 min。加细胞培养基终止标记反应。12 000 g,4℃,离心30 min,弃上清,加PBS重悬。12 000 g,4℃,离心30 min,弃上清加细胞培养基重悬。共聚焦小皿弃掉细胞培养基加入含有外泌体的细胞培养基。24 h后加入4%多聚甲醛固定30 min,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)标记细胞核,30 min后进行检测。
1.3.8 外泌體包含RNA的分析 将超速离心法提取组与外泌体纯化试剂盒提取组的外泌体行转录组二代测序,对两组中外泌体包含的RNA进行初步分析。
1.4 统计学方法
采用SPSS 19.0软件进行数据处理,实验均重复3次,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果
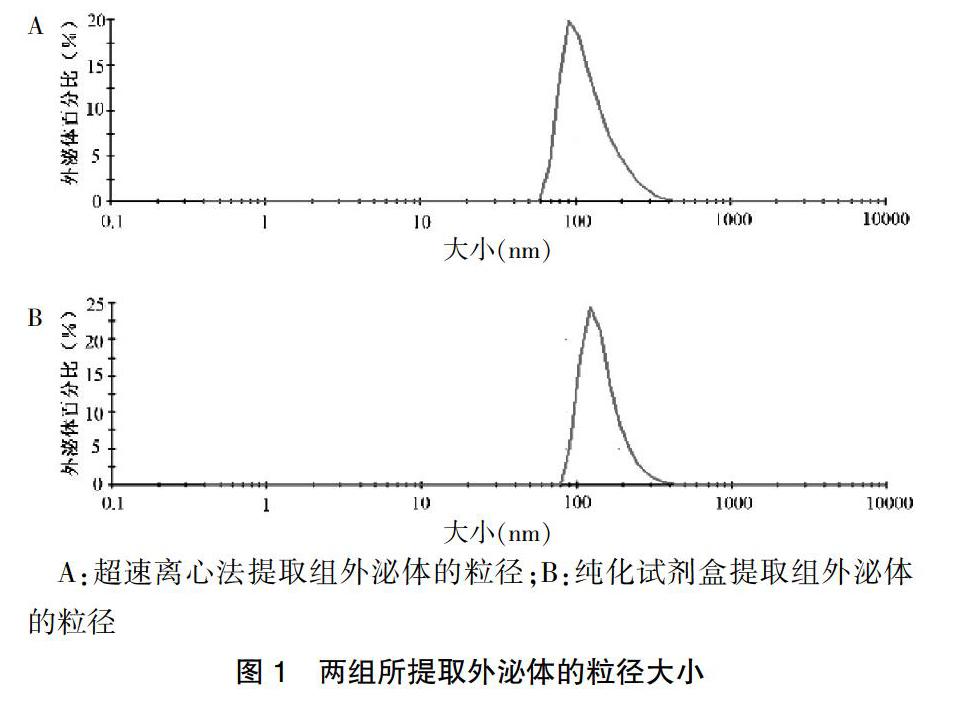
2.1 外泌体粒径分析
粒径检测结果显示,两组方法所提取的外泌体粒径大小较集中,超速离心法提取组外泌体粒径[(69.24±1.12)nm]与纯化试剂盒提取组外泌体粒径[(74.34±0.98)nm]比较,差异无统计学意义(P > 0.05)。见图1。
2.2 透射电镜结果
透射电镜结果显示,两组所提取的外泌体在镜下均呈一侧凹陷的半球形双层膜囊泡,囊泡直径在30~150 nm之间。见图2。
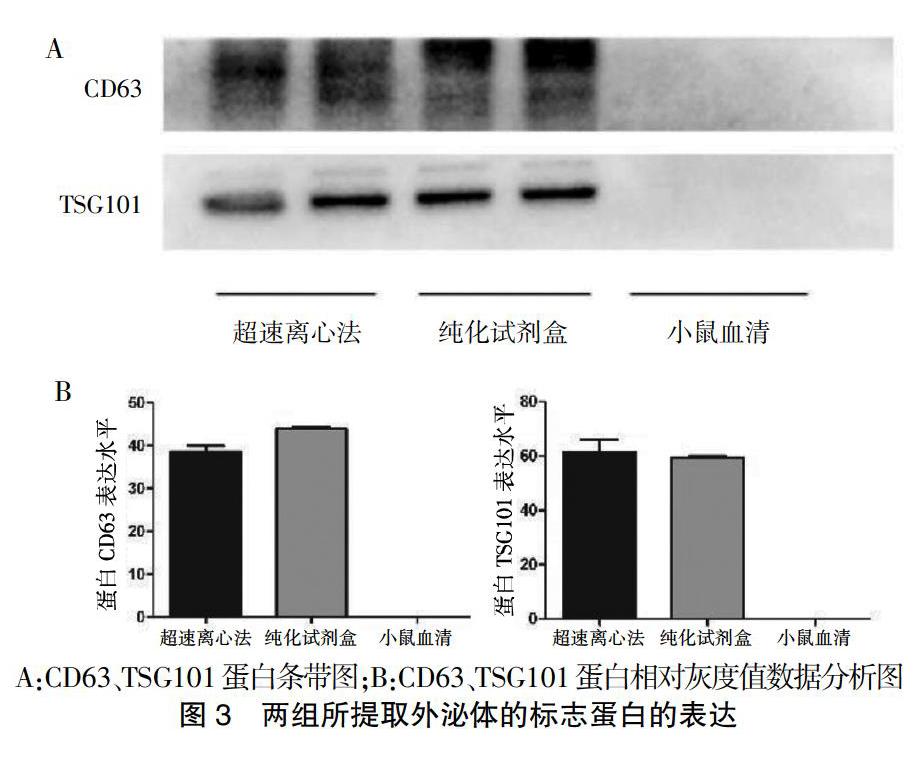
2.3 外泌体标志蛋白的检测
Western blot结果显示,两种方法所提取组的外泌体均能检测到CD63和TSG101等外泌体标志蛋白,差异无统计学意义(P > 0.05)。见图3。
2.4 外泌体所含RNA浓度检测分析
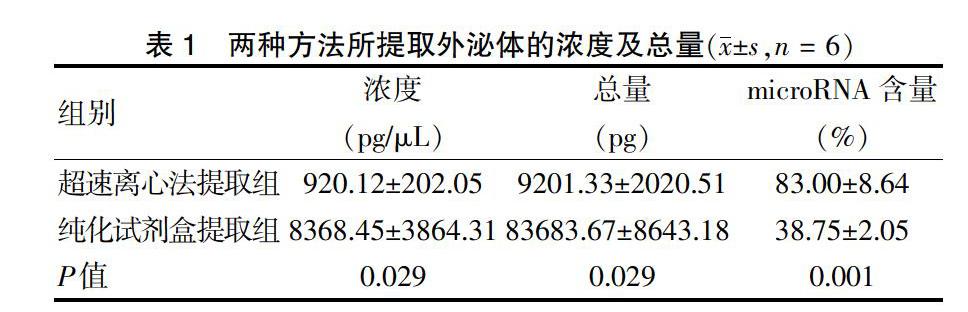
RNA浓度检测结果显示,超速离心法提取组的RNA浓度低于纯化试剂盒提取组提取的RNA浓度,差异有统计学意义(P < 0.05)。见图4A~B(封三)。标记绿色荧光的PKH67是外泌体表面的标志蛋白,免疫荧光结果显示,超速离心法提取组外泌体数量低于纯化试剂盒提取组提取的外泌体数量,见图4C~D(封三)。与纯化试剂盒提取组比较,超速离心法提取组外泌体RNA浓度较低(P < 0.05),总量较低(P < 0.05),microRNA含量较高(P < 0.05)。见表1。
2.5 外泌体所含RNA分析
测序结果显示,超速离心法提取组的外泌体所含RNA大小主要集中在20~23 nt,通过与数据库比较,进一步分析RNA种类主要为microRNA。而纯化试剂盒提取组的外泌体中所含RNA的大小集中在28~33 nt,RNA的种类主要为piRNA。见图5(封三)。
3 讨论
20世纪80年代外泌体发现初期,研究者认为其仅仅用于携带细胞代谢被排出体外[15]。随着研究的深入,人们对外泌体的功能有了进一步的认识,研究发现其在介导细胞通讯以及疾病诊断的过程中发挥着独到的作用[16-18]。与传统的诊断手段比较,外泌体作为疾病诊断的生物标志物对患者的创伤更小,诊断样本更容易获取。外泌体也可以作为靶向药物的载体发挥作用,通过囊泡运输的方式将药物运输到靶定的位置[19-20]。
目前国内外对外泌体的提取方法各异并且每种方法都存在优缺点,如何从各种方法中挑选能够满足自身实验要求的方法是各位研究者共同关心的问题。本研究发现,超速离心法、外泌体纯化试剂盒提取法均能够在小鼠血清中成功提取外泌体。本研究发现超速离心法提取的外泌体包含的小RNA种类主要为microRNA,而纯化试剂盒提取的外泌体包含的小RNA种类主要为piRNA,而造成这一差异的原因仍有待于进一步研究。这一结果对今后需要检测外泌体中RNA成分的研究者具有一定的借鉴意义。综上所述,两种方法都能够从小鼠血清中成功提取外泌体,但外泌体包含的成分明显不同,故后续更关注外泌体中microRNA的功能则应选择超速离心法分离,而后续研究更关注piRNA则应主要采用纯化试剂盒提取外泌体。当然,在进行外泌体研究时也需考虑实验室的具体条件,超速离心法对设备要求高,耗费时间长,但所得外泌体纯度较高,适用于对外泌体纯度要求更加精确的相关机制研究。纯化试剂盒提取法的操作步骤简单,实验耗时短,可同时处理较多的样品,适用于对外泌体纯度要求不高但容量较大的样品。
[参考文献]
[1] Yu LL,Zhu J,Jiang F,et al. A comparison of traditional and novel methods for the separation of exosomes from human samples [J]. Biomed Res Int,2018,2018:3634563.
[2] Niel GV,D′Angelo G,Raposo G. Shedding light on the cell biology of extracellular vesicles [J]. Nat Rev Mol Cell Biol,2018,19(4):213-228.
[3] Li P,Kaslan M,Lee SH,et al. Progress in exosome isolation techniques [J]. Theranostics,2017,7(3):789-804.
[4] Samanta S,Rajasingh S,Drosos N,et al. Exosomes:new molecular targets of diseases [J]. Acta Pharmacol Sin,2018,39(4):501-513.
[5] Milane L,Singh A,Mattheolabakis G,et al. Exosome mediated communication within the tumor microenvironment [J].J Control Release,2015,219:278-294.
[6] Kahlert C,Kalluri R. Exosomes in tumor microenvironment influence cancer progression and metastasis [J]. JMol Med(Berl),2013,91(4):431-437.
[7] Wang Y,Balaji V,Kaniyappan S,et al. The release and trans-synaptic transmission of Tau via exosomes [J]. Mol Neurodegener,2017,12(1):5.
[8] Schageman J,Zeringer E,Li M,et al. The complete exosome workflow solution:from iolation to characterization of RNA cargo [J]. Biomed Res Int,2013,2013:253957.
[9] Perez-Hernandez D,Gutiérrez-Vázquez C,Jorge I,et al. The intracellular interactome of tetraspanin-enriched microd-omains reveals their function as sorting machineries toward exosomes [J]. J Biol Chem,2013,288(17):11649-11661.
[10] Yokoi A,Yoshioka Y,Yamamoto Y,et al. Malignant extracellular vesicles carrying MMP1 mRNA facilitate peritoneal dissemination in ovarian cancer [J]. Nat Commun,2017,8:14470.
[11] Shao H,Im H,Castro CM. New technologies for analysis of extracellular vesicles [J]. Chem Rev,2018,118(4):1917-1950.
[12] Li X,Liu R,Huang Z,et al. Cholangiocyte-derived exosomal long noncoding RNA H19 promotes cholestatic liver injury in mouse and humans [J]. Hepatology,2018,68(2):599-615.
[13] Javeed N,Mukhopadhyay D. Exosomes and their role in the micro-/macro-environment:a comprehensive review [J]. J Biomed Res,2017,31(5):386-394.
[14] Hirsova P,Ibrahim SH,Krishnan A,et al. Lipid-induced signaling causes release of inflammatory extracellular vesicles from hepatocytes [J]. Gastroenterology,2016,150(4):956-967.
[15] Masyuk AI,Masyuk TV,Larusso NF. Exosomes in the pathogenesis,diagnostics and therapeutics of liver diseases [J]. J Hepatol,2013,59(3):621-625.
[16] Yokoi A,Yoshioka Y,Yamamoto Y,et al. Malignant extracellular vesicles carrying MMP1 mRNA facilitate peritoneal dissemination in ovarian cancer [J]. Nat Commun,2017,8:14470.
[17] Hirsova P,Ibrahim SH,Verma VK,et al. Extracellular vesicles in liver pathobiology:Small particles with big impact [J]. Hepatology,2016,64(6):2219-2233.
[18] Pan L,Liang W,Fu M,et al. Exosomes-mediated transfer of long noncoding RNA ZFAS1 promotes gastric cancer progression [J]. J Cancer Res Clin Oncol,2017,143(6):991-1004.
[19] Valadi H,Ekstr?觟m K,Bossios A,et al. Exosomes-mediated transfer of mRNAs and microRNA is a novel mechanism of genetic exchange between cells [J]. Nat Cell Biol,2007,9(6):654-659.
[20] Ahadi A,Brennan S,Kennedy PJ,et al. Long non-coding RNAs harboring miRNA seed regions are enriched in prostate cancer exosomes [J]. Sci Rep,2016,6:24922.
(收稿日期:2019-11-28 本文編辑:刘永巧)
——外泌体与老年慢性疾病相关性的研究进展

