组蛋白去乙酰化酶抑制剂CUDC-101对去势抵抗性前列腺癌AR-V7表达的影响
张烨 张璐 刘修恒


[摘要] 目的 探討组蛋白去乙酰化酶抑制剂CUDC-101对去势抵抗性前列腺癌(CRPC)雄激素受体剪切变异体7(AR-V7)表达的影响,为临床提供相应的理论参考。 方法 2018年1月~2019年6月通过免疫印迹法对CRPC的PC-3、VCaP、22Rvl、LNCap等17株细胞株中的AR-V7蛋白表达情况进行检测,筛选AR-V7表达最高细胞株进一步研究。并按照不同抑制剂分为MG149组和CUDC-101组,比较两种抑制剂对CRPC细胞中AR-V7表达降低情况。再按照不同制剂方法分为单独使用MDV3100组、30 nmol剂量CUDC-101联合应用组、300 nmol剂量CUDC-101联合应用组,分析对CRPC细胞中AR-V7表达的影响。 结果 CRPC细胞株22Rvl存在AR-V7阳性表达,PC-3、VCaP和LNCap等CRPC细胞株,均未发现AR-V7阳性表达。CUDC-101组AR-V7表达阳性率低于MG149组,差异有统计学意义(P < 0.05)。30、300 nmol 剂量CUDC-101联合应用组AR-V7阳性表达率均低于单独使用MDV3100组,差异有统计学意义(P < 0.05)。 结论 组蛋白去乙酰化酶抑制剂CUDC-101应用在CRPC患者中,可以降低AR-V7表达水平,提高内分泌治疗敏感性,具有治疗CRPC的潜力。
[关键词] 组蛋白去乙酰化酶抑制剂;CUDC-101;前列腺癌;雄激素受体剪切变异体7
[中图分类号] R733.7 [文献标识码] A [文章编号] 1673-7210(2020)03(a)-0011-04
[Abstract] Objective To investigate the effect of histone deacetylase inhibitor CUDC-101 on the expression of androgen receptor shear variant 7 (AR-V7) in castration-resistant prostate cancer (CRPC), and to provide relevant theoretical reference for clinical practice. Methods From January 2018 to June 2019, the expression of AR-V7 protein in CRPC PC-3, VCaP, 22Rvl, LNCap and other 17 cell lines were detected by immunoblotting, while the highest AR-V7 expression was screened further the study. According to different inhibitors, the cell lines were divided into MG149 group and CUDC-101 group. The two inhibitors were compared to reduce the expression of AR-V7 in CRPC cells. Then according to different preparation methods, the cell lines were divided into using MDV3100 alone group, 30 nmol dose CUDC-101 combined application group, and 300 nmol dose CUDC-101 combined application group. The effects on the expression of AR-V7 in CRPC cells were analyzed. Results CRPC cell line 22Rvl had AR-V7 positive expression, and PC-3, VCaP and LNCap CRPC cell lines did not find AR-V7 positive expression. The positive rate of AR-V7 expression in the CUDC-101 group was lower than that in the MG149 group, and the difference was statistically significant (P < 0.05). The AR-V7 positive expression rate 30, 300 nmol dose CUDC-101 combined application group were lower than that in the MDV3100 group alone, and the differences were statistically significant (P < 0.05). Conclusion Histone deacetylase inhibitor CUDC-101 can reduce the expression level of AR-V7, while improve the sensitivity of endocrine therapy. It has the potential to treat CRPC.
[Key words] Histone deacetylase inhibitors; CUDC-101; Prostate cancer; Androgen receptor splice variants 7
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,好发于中老年群体,尤其是70岁以上老年群体发病率保持在较高水平,是男性泌尿系统发病率较高的恶性肿瘤[1]。流行病学调查显示[2],全世界每年因前列腺癌死亡的男性患者数量超过25万,并仍然呈上升趨势。前列腺癌发病原因比较复杂,目前普遍认为前列腺癌发生与发展依赖于雄激素(AR)信号传导以及雄激素本身,即AR信号持续传导在支持肿瘤细胞存活方面发挥着积极作用[3]。针对目前临床对前列腺癌的治疗,对于AR信号通路的过度激活普遍采用雄激素剥夺治疗。尽管最初有一定效果,但是绝大部分患者在一段时间的治疗后会产生不同程度的抵抗,逐步进展为去势抵抗性前列腺癌(CRPC)[4]。CRPC的发生意味着前列腺癌发展到严重程度,病情十分危急,是临床上棘手的难题[5]。雄激素受体剪切变异体7(AR-V7)是AR的重要变异体,由于特殊的结构受到越来越多的关注。同时,研究显示其与CRPC的发生发展以及耐药性的形成存在密切的关系,与患者的预后存在密切联系[6]。近年来,随着CRPC的研究不断深入,有研究发现组蛋白去乙酰化酶抑制剂对于CRPC患者AR表达具有一定的抑制作用,但目前并无太多报道。本研究通过分析组蛋白去乙酰化酶抑制剂CUDC-101的应用对于CRPC患者AR-V7表达的影响,探究其对于CRPC治疗并取得了理想效果。现报道如下:
1 材料与方法
1.1 试验材料
组蛋白去乙酰化酶抑制剂中CUDC-101和MG149抑制剂(上海赛导通生物科技公司,871026-44-7);MDV3100(北京乐博生物科技公司,915087-33-1)。中科院研究所提供PC-3、VCaP、22Rvl、LNCap等前列腺癌细胞株。抗人AR-V7特异性小鼠抗体(GR2195 17-16)及辣根过氧化物酶(HRP)标记的羊抗小鼠抗体(1387300604)分别购自Abcam公司及上海碧云天生物科技公司,细胞活性检测试剂盒(080719190830)购自北京智杰方远科技有限公司。
1.2 方法
前列腺细胞的培育和给药检测,严格按照文献[7]进行操作。采用免疫印迹法对AR-V7表达情况进行检测:在完成前列腺癌细胞的培养之后,对细胞总蛋白进行提取,并对其浓度予以测定,进行蛋白电泳、转膜处理。转膜完成后,使用浓度为5%脱脂奶粉溶液将其封闭,1 h后加入抗人AR-V7特异性小鼠抗体。第2天清晨洗涤3次后加入HRP标记的羊抗小鼠抗体,1 h后洗涤4次加人ECL试剂,使用化学发光法获取目标条带,使用bandscan(version 5.0)凝胶图像分析软件测定灰度值,进而比较AR-V7表达的差异。
采用免疫印迹法对不同前列腺癌细胞株PC-3、VCaP、22Rvl、LNCapAR-V7阳性的表达进行监测:分别向不同的前列腺癌细胞株中加入浓度20 μmol的MDV3100,而后收集细胞进行检测。进一步检测蛋白去乙酰化酶抑制剂中CUDC-101和MG149抑制剂对前列腺癌细胞株阳性表达的影响:AR-V7阳性的细胞株中,分别加入CUDC-101和MG149抑制剂,2 d后收集不同的细胞株,使用免疫印迹法检测AR-V7的表达。进一步比较CUDC-101联合MDV3100对前列腺癌细胞株AR-V7阳性表达的影响:AR-V7阳性的细胞株中,分别加入30 nmol、300 nmol的CUDC-101以及30 μmol的MDV3100,2 d后收集不同的细胞株,使用免疫印迹法检测AR-V7的表达。
1.3 统计学方法
采用SPSS 25.0统计软件对所得数据进行统计分析,计数资料以例数或百分比表示,比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 免疫印迹试验结果分析
CRPC患者细胞株PC-3、VCaP和LNCap,均不存在AR-V7阳性表达情况(AR-V7阳性表达率为0.00%)。CRPC患者细胞株22Rvl,存在AR-V7阳性表达,AR-V7阳性表达率为75.60%。细胞株22Rvl处理后AR-V7阳性表达率高于其他细胞株,差异有统计学意义(P < 0.05)。见图1。
2.2 CUDC-101和MG149处理细胞株22Rvl后AR-V7阳性表达率比较
蛋白去乙酰化酶抑制剂中CUDC-101和MG149分别处理CRPC细胞株22Rvl后,CUDC-101组AR-V7阳性表达率低于MG149组,差异有统计学意义(P < 0.05)。见表1。
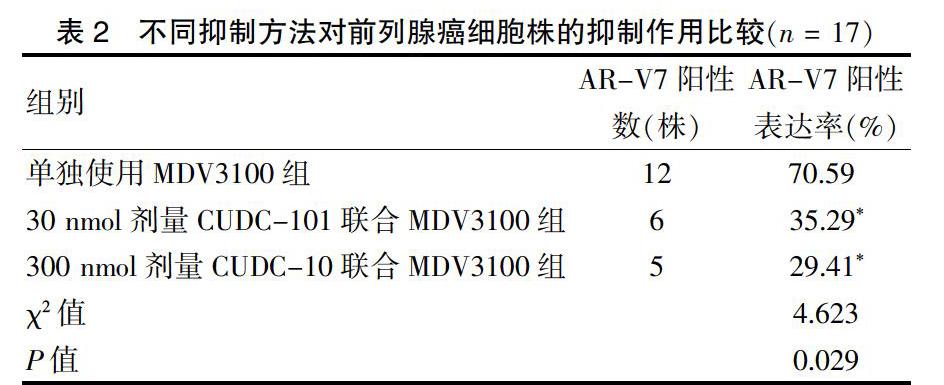
2.3 不同抑制方法对前列腺癌细胞株的抑制作用比较
30 nmol剂量CUDC-101联合MDV3100组及300 nmol剂量CUDC-101联合MDV3100组对AR-V7阳性表达的抑制率均高于单独使用MDV3100组,差异有统计学意义(χ2 = 4.250、5.765,P < 0.05)。30 nmol剂量CUDC-10联合MDV3100组与300 nmol剂量CUDC-101联合MDV3100组抑制率比较,差异无统计学意义(P > 0.05)。见表2。
3 讨论
我国前列腺癌患者很大一部分在初诊时已处于中晚期,手术效果不理想或已失去手术根治的机会,内分泌治疗是主要治疗方法,因此CRPC患者比例在增加[8]。在前列腺癌患者中,普遍存在前列腺特异性抗原升高的现象,并且以CRPC患者表现得尤为明显,而又受到AR通路调节,升高幅度因此受影响[9]。临床实践调查显示,采用内分泌治疗后,几乎所有患者在取得最初良好收益后,病情会逐步发展为CRPC[10]。而AR通路过度激活,被领域内研究学者认为是进展的主要原因[3,11]。MDV3100和阿比特龙,可以通过结合AR,阻断受体与雄激素结合,从而降低AR的阳性表达,对抗肿瘤的生长[12]。该方法能够在一定程度上延长患者的生存期,一般在5个月作用,但是在远期产生耐药性的可能性非常大,疾病的恶化同样会出现[13]。
AR信号通路的作用,从前列腺癌的发病、发展到恶化,直至患者死亡,始终存在并出现。作用机制表现为:雄激素结合AR后,构象发生变化而被激活,可进一步激活一系列下游信号的转导,促进肿瘤细胞的增殖和生长,进而影响疾病的变化发展[14]。AR通路传导在支持前列腺细胞存活方面发挥积极作用,通过以下3种方式上调:增加雄激素生物合成、AR扩增及过表达、AR突变。AR-V7是AR突变的重要表现形式,也是AR信号通路的重要介质之一,AR-V7的持续激活被认为是AR通路过渡激活的主要因素之一[15]。相关研究显示[16],MDV3100和阿比特龙无法阻断AR-V7的激活,而这也导致了AR-V7能够在雄激素水平较低的情况下对任意前列腺癌细胞遗传物质的控制,诱发细胞的生长增殖和扩散转移,从而导致耐药性的出现。本研究结果显示,AR-V7阳性的细胞株22Rvl对MDV3100具有很强的耐药性,进一步提示AR-V7在前列腺癌细胞对MDV3100耐药性的产生过程中发挥积极作用。
现已证明在雄激素存在的条件下,AR-V7具有AR的活性;而在没有雄激素配体的情况下,AR-V7在大量共调节因子的帮助下完成最终的激活并调控其下游基因的转录,增强AR的转录活性,与CRPC密切相关[17]。因此,有学者认为[18-19],可以将AR-V7的表达水平的高低作为预测CRPC患者预后的重要指标,AR-V7过度表达则往往意味着CRPC复发率和死亡率的上升。若降低CRPC患者的AR-V7表达水平能够改善患者抗雄治疗效果,间接提示AR-V7可以其促进耐药性的产生[20-21]。相关研究显示[22],前列腺癌中的AR-V7表达与表观修饰可能存在一定的联系。表观遗传抑制剂包括许多类型,本实验CUDC-101便是其中一种。表观遗传抑制剂与内分泌治疗药物联合应用在前列腺癌领域显现出巨大的潜力[23-24]。本研究结果显示,使用CUDC-101处理CRPC细胞株22Rvl后,AR-V7阳性表达率低于蛋白去乙酰化酶抑制剂中MG149(P < 0.05),提示CUDC-101对CRPC细胞株22Rvl中AR-V7阳性表达的抑制效果更好。在不同抑制方法方面,30、300 nmol的CUDC-101联合MDV3100使用AR-V7阳性表达率低于MDV3100单独使用(P < 0.05),这主要是因为联合使用降低了CRPC耐药性,对AR-V7阳性表达的抑制作用更明显,同样为CRPC新药的研究探索新方向。但是本研究也存在一定的不足,不同药物浓度对AR-V7阳性表达的抑制效果并无进一步分析,需要在今后研究中加以改进。
综上所述,在CRPC患者中采用组蛋白去乙酰化酶抑制剂CUDC-101可以降低AR-V7表达水平,可作为治疗CRPC潜在治疗药物。
[参考文献]
[1] Zhou CK,Check DP,Lortet-Tieulent J,et al. Prostate cancer incidence in 43 populations worldwide: An analysis of time trends overall and by age group [J]. Int J Cancer,2016,138(6):1388-1400.
[2] 许洪修,白进良.AR-V7在去势抵抗性前列腺癌中的作用[J].现代泌尿外科杂志,2016,21(8):649-652.
[3] Martinez-Breijo S,Chantada-Abal V,Aller-Rodriguez M,et al. Castration resistance mechanisms in prostate cancer [J]. Arch Esp Urol,2018,71(8):628-638.
[4] Al-Salama ZT. Apalutamide:A Review in Non-Metastatic Castration-Resistant Prostate Cancer [J]. Drugs,2019,79(14):1591-1598.
[5] Herrmann K,Bluemel C,Weineisen M,et al. Biodistribution and radiation dosimetry for a probe targeting prostate-specific membrane antigen for imaging and therapy [J]. J Nucl Med,2015,56(6):855-861.
[6] Takayama KI. Splicing Factors Have an Essential Role in Prostate Cancer Progression and Androgen Receptor Signaling [J]. Biomolecules,2019,9(4):13101-13113.
[7] 徐春梅,張子亦,陈羲,等.组蛋白去乙酰化酶抑制剂抗肿瘤作用研究进展[J].中国现代应用药学,2016,33(4):509-513.
[8] Sir Alpajaro,Harris J,Evans CP. Non-metastatic castration resistant prostate cancer:a review of current and emerging medical therapies [J]. Prostate Cancer Prostatic Dis,2019,22(1):16-23.
[9] 曾浩,种铁,贺大林,等.去势抵抗性前列腺癌最新指南解读——暨中国西部专家共识[J].现代泌尿外科杂志,2017,22(2):85-94.
[10] Chandrasekar T,Yang JC,Gao AC,et al. Mechanisms of resistance in castration-resistant prostate cancer (CRPC)[J]. Transl Androl Urol,2015,4(3):365-380.
[11] Pu F,Salarian M,Xue S,et al. Prostate-specific membrane antigen targeted protein contrast agents for molecular imaging of prostate cancer by MRI [J]. Nanoscale,2016,8(25):12668-12682.
[12] Belderbos B,Sieuwerts AM,Hoop EO,et al. Associations between AR-V7 status in circulating tumour cells,circulating tumour cell count and survival in men with metastatic castration-resistant prostate cancer [J]. Eur J Cancer,2019,121(9):48-54.
[13] 林国伟,谢锦来,李励献,等.AR-V7对前列腺癌激素抵抗敏感时间的预测作用[J].现代医学,2015,43(7):858-862.
[14] Karantanos T,Evans CP,Tombal B,et al. Understanding the mechanisms of androgen deprivation resistance in prostate cancer at the molecular level [J]. Eur Urol,2015,67(3):470-479.
[15] 熊诗诗,吴介恒,韩东晖,等.针对前列腺特异性膜抗原的抗体靶向治疗研究进展[J].细胞与分子免疫学杂志,2017,33(2):278-282.
[16] Markowski MC,Frick KD,Eshleman JR,et al. Cost-Savings Analysis of AR-V7 Testing in Patients With Metastatic Castration-Resistant Prostate Cancer Eligible for Treatment With Abiraterone or Enzalutamide [J]. Prostate,2016,76(16):1484-1490.
[17] 韓雪迪,李囡,林新峰,等.前列腺特异性膜抗原靶向分子探针在前列腺癌诊断及治疗中的应用[J].中国医学影像学杂志,2016,24(10):790-792.
[18] Bastos DA,Antonarakis ES. CTC-derived AR-V7 detection as a prognostic and predictive biomarker in advanced prostate cancer [J]. Expert Rev Mol Diagn,2018, 18(2):155-163.
[19] 孔祥辉,黄晓军,吕伯东.AR-v7作为去势抵抗性前列腺癌治疗体液标志物的研究进展[J].中国男科学杂志,2018,32(4):69-72.
[20] Bryce AH,Antonarakis ES. Androgen receptor splice variant 7 in castration-resistant prostate cancer:Clinical considerations [J]. Int J Urol,2016,23(8):646-653.
[21] 陈泽昱,董强,柳良仁,等.转移性去势抵抗性前列腺癌临床治疗标志物——雄激素受体剪接变异体7[J].中华男科学杂志,2019,25(2):172-176.
[22] Mahajan K,Malla P,Lawrence HR,et al. ACK1/TNK2 Regulates Histone H4 Tyr88-phosphorylation and AR Gene Expression in Castration-Resistant Prostate Cancer [J]. Cancer Cell,2017,31(6):790-803.
[23] 林晨,刘湘鄂,吴天玉,等.康艾注射液辅助化疗联合内分泌治疗中晚期前列腺癌效果分析[J].中外医学研究,2019,17(28):7-9.
[24] 张碧严,李玉凤,赖芸,等.中药复方PC-SPESⅡ抑制人前列腺癌细胞LNCaP增殖及其对AR,PSA表达的影响[J].中国中药杂志,2015,40(5):950-956.
(收稿日期:2019-09-10 本文编辑:王晓晔)

