一株绿鹭源H9N2亚型禽流感病毒全基因组序列分析
杨 勇 段博芳 曾邦权 肖望成 曾维欢 黄翠琴 代飞燕*
(1.福建省家畜传染病防治与生物技术重点实验室,龙岩学院生命科学学院,龙岩,360012;2.云南省高校兽医公共卫生重点实验室,云南农业大学动物医学院,昆明,650201;3.云南省动物疫病预防控制中心,昆明,650201)
绿鹭(Butoridesstriata)为鹭科(Ardeidae)绿鹭属,体形较小的涉禽,主要以鱼为食。绿鹭部分种群迁徙,部分为留鸟;在中国长江以北繁殖的种群多为迁徙。通常在4月迁来北方繁殖地,9月离开繁殖地迁往南方越冬地[1]。野生水禽,被认为是低致病性禽流感病毒(LPAIVs)的主要宿主,它们携带的病毒可能会进化,成为高致病性的家禽或人畜共患病病原[2]可通过粪-口途径或污染的水,在野生水禽之间或野生水禽与家禽之间传播[3-4],通常,野鸟感染低致病性 AIVs 呈隐性感染,无明显临床症状[2]并随其每年的迁徙而在不同国家地区间传播。云南因其得天独厚的自然环境与气候条件成为许多野生候鸟的越冬地,大大增加了野生动物间疾病传播的风险。
禽流感病毒属正粘病毒科(Orthomyxoviridae)甲型流感病毒属(InfluenzavirusA),流感病毒的基因组由8个单独的负链片段组成,依次为PB2、PB1、PA、HA、NP、NA、M和NS,共编码10种蛋白[5]。根据表面糖蛋白血凝素(HA)基因和神经氨酸酶(NA)基因,AIV 可以分为 16种 HA 亚型和 9种 NA 亚型几乎所有的亚型组合都可以感染鸟类[6]。
H9N2亚型AIV 通常表现为低致病性,很少导致家禽的直接死亡[7],H9N2禽流感病毒的宿主范围已经非常广泛,家禽、野鸟中都有报道,且宿主范围还在不断扩大,有研究从猪等低等哺乳动物体内成功分离到了该亚型病毒[8]。H9N2 亚型 AIV 广泛存在变异重组现象,可能为形成新型跨种传播感染人的流感病毒株提供条件。许多研究表明H9N2 AIV 可能是其他亚型AIV内部基因的供体[9-10],1997年,香港人感染H5N1经研究发现,分离到的H5N1病毒与H9N2 的内部基因相似性在98%—99%,2013年爆发的感染人H7N9亚型及2014年报道的感染人H10N8 亚型AIV其内部基因与H9N2亚型内部基因高度同源[11-12],对H9N2 亚型 AIV 进行流行病学监测,了解其生物学特性具有重要的公共卫生意义。
本研究对从送检死亡的绿鹭分离的1株H9N2 病毒(A/striated heron/Yunnan/2018)进行生物信息学分析,以期了解该亚型病毒在野生水禽绿鹭中的进化和生物学特性,为今后科学防控禽流感提供依据。
1 材料与方法
1.1 样品来源
云南省某地区林业部门送检死亡的绿鹭,经实验室检测H9N2感染。

图1 送检死亡的绿鹭Fig.1 Submitted the dead striated heron

图2 绿鹭喉气管剖检Fig.2 Laryngeal trachea of striated heron
1.2 主要试剂
核酸提取试剂盒(磁珠法)购自西安天隆科技有限公司,One Step RT-PCR、胶回收试剂盒、质粒提取纯化试剂盒、pMD18-T 载体连接试剂盒和DH5α感受态细胞均购自宝生物工程(大连)有限公司,H9N2检测引物及SPF鸡胚由云南省动物疫病预防控制中心提供,其他试剂均为国产分析纯。
1.3 病毒分离扩增
无菌采取死亡绿鹭喉气管加入含2%双抗的PBS匀浆,12 000 r/min 离心 10 min,取上清200 μL接种 9—10日龄 SPF鸡胚,37 ℃孵化,72 h后收集鸡胚尿囊液。
1.4 病毒RNA提取和RT-PCR鉴定
按照核酸提取试剂盒(磁珠法)说明书提取尿囊液病毒总RNA;采用一步法RT-PCR使用H9N2检测引物进行扩增。PCR产物经1.0%琼脂糖凝胶电泳检测分析。
1.5 全基因组序列扩增
根据文献[7]报道对8个病毒基因片段(PB2、PB1、PA、HA、NP、NA、M和NS)全长扩增,引物由生工生物工程(上海)股份有限公司合成;产物经1.0%琼脂糖凝胶电泳检测,阳性产物按胶回收试剂盒说明书回收,与pMD18-T 载体连接并转入DH5α感受态细胞,挑取阳性克隆质粒送生工生物工程(上海)股份有限公司测序。
1.6 生物信息学分析
应用 Lasergene Seqman、Lasergene MegAlign、Mega 7等软件对测序结果进行序列拼接、进行同源性及关键位点分析、构建进化树;登陆NCBI进行BLAST比对分析;通过NetNGlyc 1.0 Server在线分析毒株HA、NA蛋白上的潜在糖基化位点
2 结果
2.1 病毒PCR鉴定结果
提取灭活后尿囊液病毒核酸,使用H9N2检测引物进行RT-PCR扩增,产物经1.0%琼脂糖凝胶电泳后,出现特异性目的条带(图3),大小与预期目的片段相符。
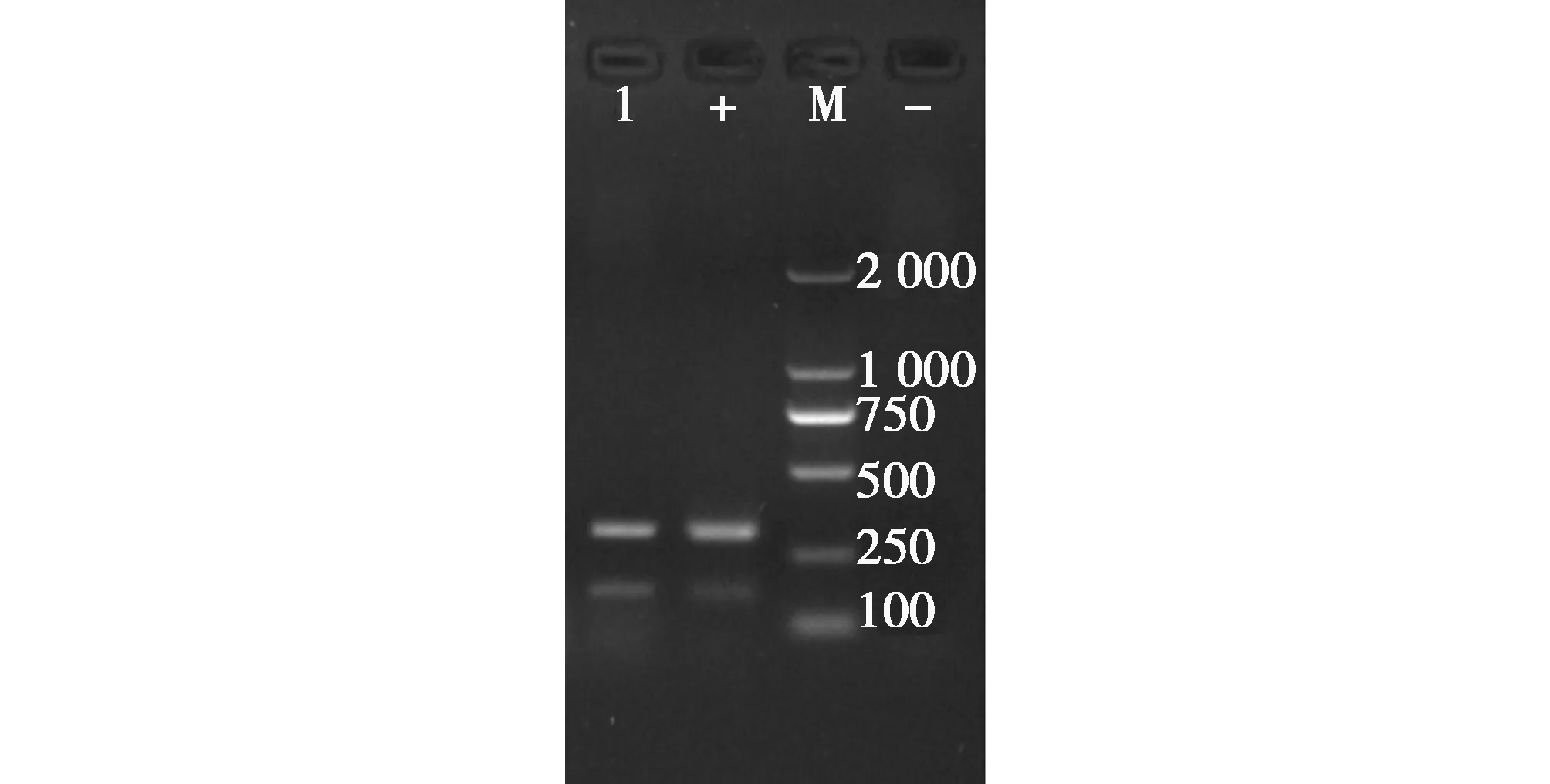
图3 H9N2特异性引物扩增结果(M:DL2000Maker,1:样品Sample,+:阳性对照Positive control)Fig.3 Results of amplification of H9N2-specific primers figure
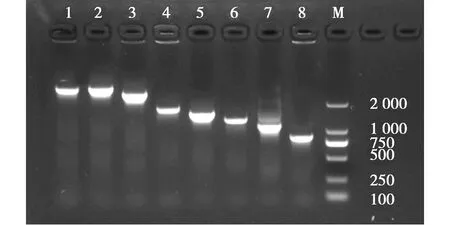
图4 毒株全基因组序列扩增结果(M:DL2000 Maker,1:PB2,2:PB1,3:PA,4:HA,5:NP,6:NA,7:M,8:NS)Fig.4 Virus genome whole genome sequence amplification results
2.2 病毒全基因组PCR扩增结果
PCR扩增分离株各个基因片段,琼脂糖凝胶电泳图显示,相应基因PCR产物与目的大小一致(图4)。
2.3 基因组遗传进化分析
将测序后的全基因序列经Lasergene Seqman软件拼接校正后上传GenBank(GenBank登录号MN396247—MN396254),通过 Blast 比对显示(表1),各基因片段分别与多株来自鸡源、鸭源、鸽子源、野鸟源的 H9、H7、H10等多种亚型AIV高度同源,其中PB1与多株H10N8亚型有较高同源性、PA与1株人源H7N9亚型和多株鸡源H7N9亚型有较高同源性;遗传进化分析结果(图5—12)显示,PB2、M基因位于G1-like分支[13],NA、HA基因位于Y280-like分支,PA、PB1、NP、NS基因位于F98-like分支。提示该分离株基因来源复杂,可能为不同亚型间病毒基因发生重组所造成。
表1 分离株各基因片段 Blast分析结果

Tab.1 Blast analysis of gene fragments of virus isolates
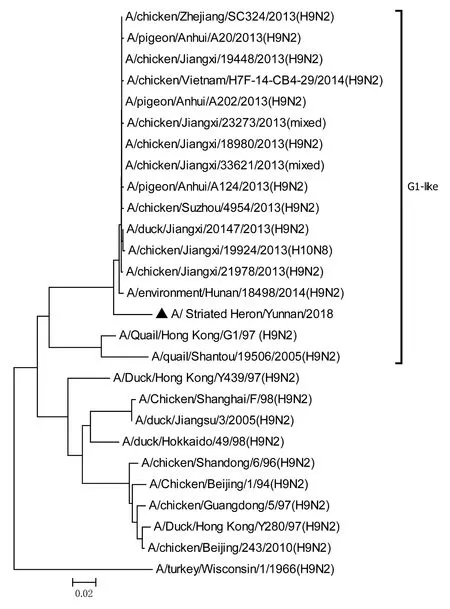
图5 PB2基因进化树Fig.5 Phylogenetic tree of PB2 genes
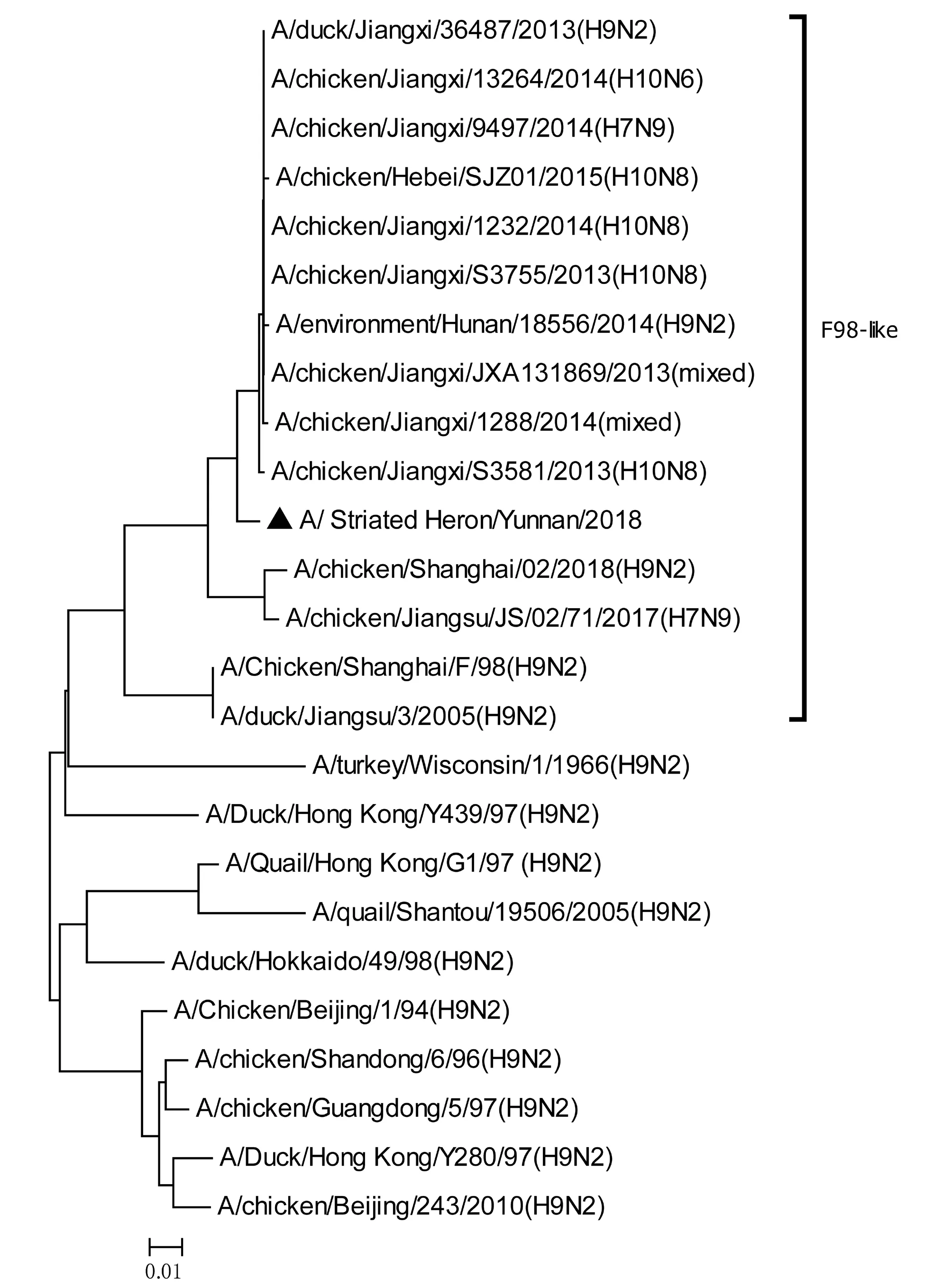
图6 PB1基因进化树Fig.6 Phylogenetic tree of PB1 genes
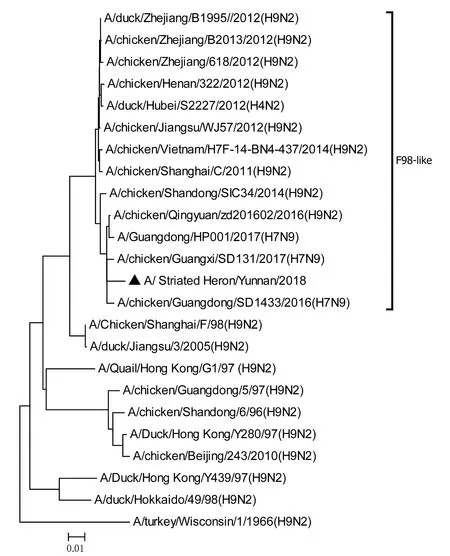
图7 PA基因进化树Fig.7 Phylogenetic tree of PA genes
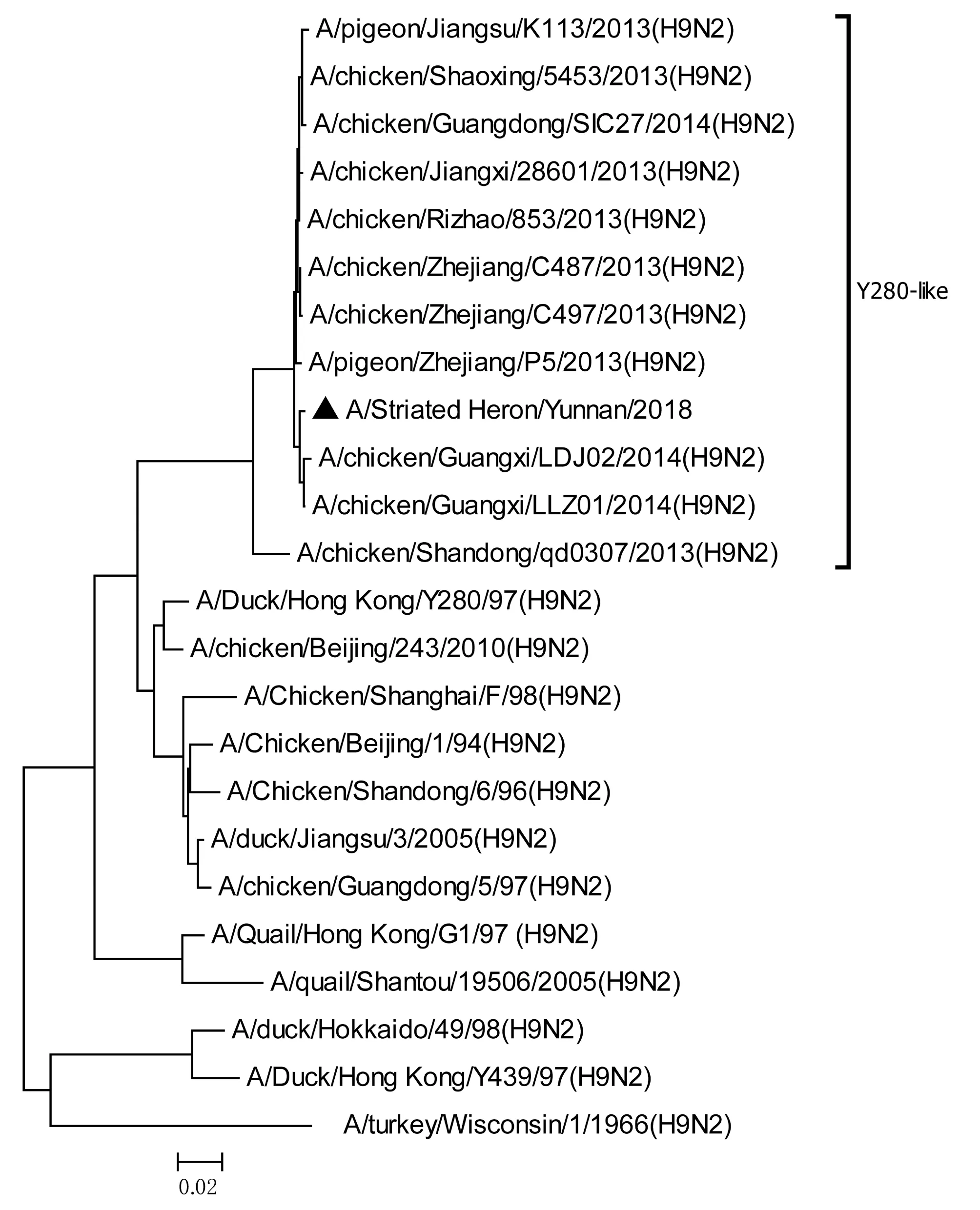
图8 HA基因进化树Fig.8 Phylogenetic tree of HA genes

图9 NP基因进化树Fig.9 Phylogenetic tree of NP genes
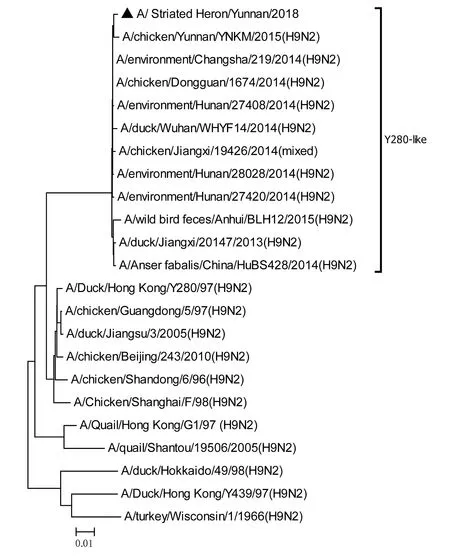
图10 NA基因进化树Fig.10 Phylogenetic tree of NA genes
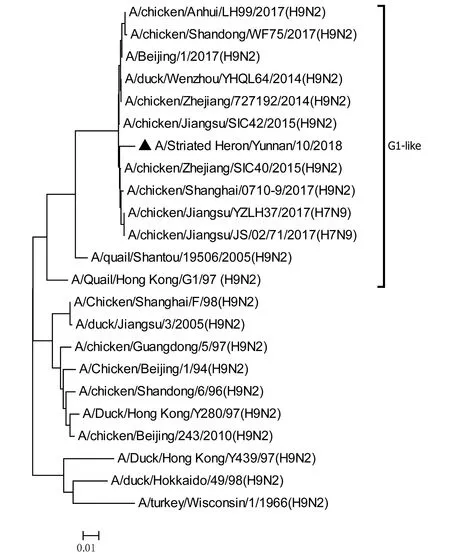
图11 M基因进化树Fig.11 Phylogenetic tree of M genes

图12 NS基因进化树Fig.12 Phylogenetic tree of NS genes
2.4 基因组序列关键位点分析
分离株的HA核苷酸序列推导氨基酸序列分析显示,HA裂解位点第334位氨基酸发生A334S突变,其序列为333PSRSSR↓GL340,为非连续碱性氨基酸,符合 LPAIV 氨基酸序列特征。分离株受体结合位点109、161、163、191、198、202、203氨基酸序列为YWTNTLY,第198位氨基酸为T与 A/Duck/Hongkong/Y280/1997毒株一致。第 234位氨基酸(相当于H3 第226位氨基酸)发生Q234L突变。存在8个潜在糖基化位点(表 2)依次为29NST31、141NVS143、145NGT148、298NTT300、305NVS307、313NCS315、492NGT494、551NGS553;可见 29、141、298、305、492、551位点相对保守,与参考毒株比较,缺失218位点氨基酸,增加了145、313 位点氨基酸,第145位氨基酸发生S145N突变增加了一个糖基化位点(表3)。
表2 HA 裂解位点和受体结合位点的比较分析
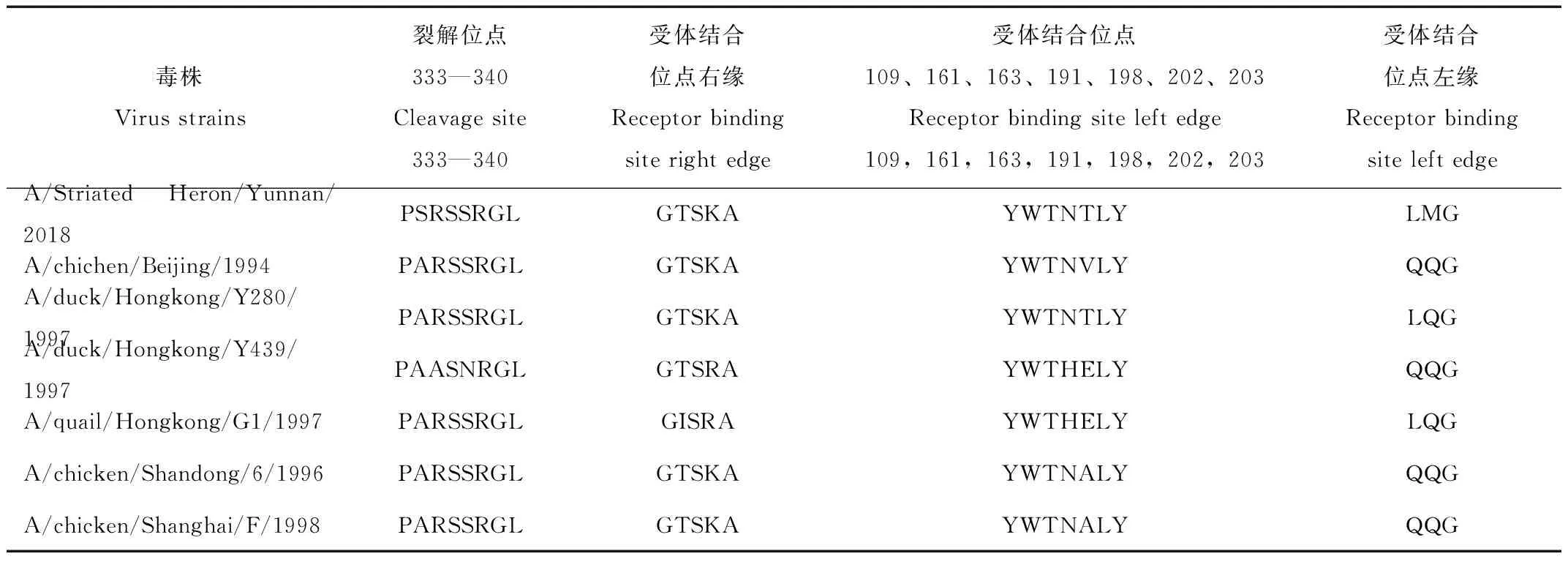
Tab.2 Comparative analysis of HA cleavage site and receptor binding site
表3 HA 潜在糖基化位点的比较分析
表4 NA潜在糖基化位点和红细胞结合位点分析

Tab.4 Analysis of NA glycosylation sites and HB site
分离株NA推导氨基酸序列分析显示,颈部处缺失了63TEI65 3个氨基酸,与经典株及疫苗株比较在368位增加一个位点,在402位减少一个位点,共存在6个潜在的糖基化位点69NTS71、86NWS88、146NGT148、200NAT202、234NGT236、368NGS370(表4)。NA蛋白红细胞结合位点分析发现,367—372位氨基酸序列为 KNGSRS,399—404氨基酸序列为SDDW,431—433位点则相对保守均为PQE氨基酸基序列(表4)。
内部基因序列及推导氨基酸序列分析析显示:该分离株 PB2未出现与哺乳动物适应相关的E627K和D701N突变;PB1-F2全长54 aa,未出现N66S突变;PA未出现T97I、K615N S224P和N383D突变,NP未出现K184A、N319K突变;M基因中M1蛋白出现N30D、T215A 突变;M2蛋白出现S31N突变;NS 80—84处颈部氨基酸未见缺失。
3 讨论
绿鹭作为候鸟是AIV的自然储存库,病毒可随其迁徙长距离传播,可通过粪-口途径或污染的水,在野生水禽之间或野生水禽与家禽之间传播。H9N2亚型AIV 通常表现为低致病性,很少导致家禽的直接死亡[7],该死亡绿鹭经实验室诊断为细菌及寄生虫感染导致的死亡,但不排除重组后造成毒力增强造成其免疫力下降,从而导致的后续感染,有待进一步探究。
Sun等[14]的研究显示1994—2008年中国主要流行CK/BJ-like分支的病毒,1998—2004年CK/BJ-like和F98-like分支的病毒共同流行但F98-like分支占主导,2004—2008年F98-like分支成为优势毒株。2006年后Y280-like分支逐渐成为主要流行毒株[15]。但近年来 H9N2 亚型 AIV 不断发生重组,国内流行的H9N2 株出现越来越多的重组基因型,本研究对野生水禽绿鹭中分离到的1株 H9N2 亚型 AIV分离株HA、NA基因位于Y280-like分支,PB2、M基因位于G1-like分支,PA、PB1、NP、NS基因位于F98-like分支。遗传演化分析表明分离株可能来自家禽鸡、鸭或其他野鸟,该分离株可能在不同宿主间交互传播。内部基因与H7、H9、H10等多种亚型的 AIV 同源性较高,其中PB1基因与多株H10N8亚型有较高同源性、PA基因与一株人源H7N9亚型和多株鸡源H7N9亚型有较高同源性,表明了内部基因来源复杂,可能为不同亚型间病毒基因发生重组所造成。
HA受体结合位点发生Q234L突变,提示该分离株具有和人流感受体唾液酸-α2,6-半乳糖受体结合的特性[16],存在人兽共患风险,裂解位点为333PSRSSR↓GL 340,符合低致病性禽流感毒株特征,S145N突变增加了一个糖基化位点,提示该位点的出现可能会使毒株致病性提高,免疫原性发生改变[17],此外增加的313NCS315糖基化位点靠近HA裂解位点,新增糖基化位点有可能影响蛋白酶对裂解位点的识别作用,从而对病毒毒力造成影响[18]。
NA蛋白颈部处缺失了63TEI65 3个氨基酸,该缺失可能导致 NA 酶活性的增加,在结合位点发生突变可能与毒力变化有关;增加了一个潜在糖基化位点368NGS370。
内部基因PB2氨基酸序列相对保守,毒力相关位点未见改变;PB1-F2全长54 aa未出现N66S突变,研究表明,PB1-F2全长大于 78 aa 能够增强病毒的致病力,同时N66S单个氨基酸残基替换使病毒致病力增加[19];PA蛋白上的T97I突变可以提高流感病毒对哺乳动物的致病性[20],K615N突变可以提高流感病毒对小鼠的致病性,S224P突变和N383D突变能提高流感病毒对鸭的致病性[21];NP蛋白的K184A突变与病毒毒力和增殖能力相关[22],N319K会增加病毒聚合酶的活性来增强病毒对小鼠的致病性[23];本次分离株PA、NP均未出现突变,仍是低致病性病毒的分子特征。M1蛋白出现N30D、T215A 突变可能使毒株对小鼠致病性产生影响[15]。M2 蛋白S31N突变,可导致流感病毒对金刚烷胺类药物产生耐药性[24]。NS蛋白 80—84处颈部氨基酸未见缺失,有研究表明80—84位氨基酸残基的缺失,能增强病毒毒力或提高对细胞因子的抗性,是对哺乳动物高致病性的一个明显特征[25]。
该分离株与毒力、宿主特异性、耐药性相关的位点存在不同程度的突变,内部基因与H7、H10亚型流感病毒间存在基因重组风险对公共卫生安全产生潜在的威胁。野生水禽作为重要的自然宿主在疾病传播过程起着关键作用,本研究中从野生水禽绿鹭中分离到的H9N2亚型基因重组复杂,具有感染人类的潜在风险。加强对野生禽类禽流感病毒生物学监测具有重要意义。

