初级纤毛与恶性肿瘤关系的研究进展
杨 扬,杨京润,黄 敏,卫萱瑾,李承新
纤毛(cilium)作为一种真核细胞的特殊细胞器,存在于人体各个器官和组织细胞中,具有运动、物质运输、感知外界刺激以及调控细胞生长等诸多功能,在生理和病理学方面均起到重要作用。纤毛在结构和功能上又分为两种,即可动纤毛(motile cilium)和不动纤毛(non-motile cilium)。前者具有运动和感知功能,可通过自身反复摆动进而实现定向运动,其长度亦可感知表面流体的物理变化等。不动纤毛又称初级纤毛(primary cilium),它位于人体几乎所有的细胞表面,具有独特结构及鞭毛内转运系统(intra flagellar transport, IFT),主要在维持和调节细胞内环境稳态,参与机体诸多病理过程,对于某些恶性肿瘤的发生发展具有重要调控作用。现就初级纤毛的基本结构和主要功能及与恶性肿瘤关系的研究进展进行如下综述。
1 初级纤毛的基本结构和主要功能
1.1 初级纤毛的基本结构
初级纤毛本质上是真核细胞质膜向外的单个突起,其形态类似“天线”,其基本结构包括基部、纤毛过渡区和轴丝,主要由中心体(centrosome)和轴丝(axoneme)构成,又称为中心体-纤毛复合体(centrosome-cilium complex),并通过基部与细胞质膜相连。其中,位于细胞内的中心体作为细胞的微管形成中心,其核心是由1对9组微管三联体结构的中心粒(centrioles)构成,中心粒被中心粒周围物质(PCM)包绕。中心粒通过对PCM的募集和组构而发挥中心体的功能,进而促进细胞有丝分裂间期微管阵列和纺锤体的组织与构建。1对中心粒包括2部分,即母中心粒(mother centriole)和子中心粒(daughter centriole),两者在空间上以垂直结构排列和连接;轴丝作为初级纤毛突出于细胞表面的部分,主要由母中心粒的微管发展而来的9组微管双联体结构(doublet microtubules)构成,其外由细胞质膜发展而来的纤毛膜包绕。中心体和轴丝之间由位于母中心粒顶端的中心粒附属物(centriolar appendages)连接,后者具有锚定微管和栓束母中心粒以及促进纤毛形成的作用[1-3]。因此,与可动纤毛的“9+2”结构(即9组外周微管包绕一对中央微管)不同,初级纤毛表现为特殊的“9+0”结构(即9组外周微管,无中央微管)。初级纤毛内另一主要结构是IFT,该结构除了可实现纤毛内外物质的双向运输,还具有促进纤毛形成和维护纤毛正常结构的重要功能。IFT主要由驱动蛋白2(kinesin-2)、动力蛋白2(dynein-2)以及两种蛋白复合体IFT-A和IFT-B构成。其中,kinesin-2和dynein-2作为分子发动机沿微管各自负责相关物质的顺向和逆向运输,在纤毛内物质运输、交换等方面发挥重要作用。其中,kinesin-2主要由KIF3A、KAP3和KIF3B或KIF3C构成,与IFT-B结合共同实现物质由纤毛基部向顶端的顺向运输。KIF3属于驱动蛋白超家族(KIFs)成员之一,是与初级纤毛形成相关的重要蛋白,而IFT-B则主要参与纤毛内顺向转运和轴丝生长。相反,dynein-2在初级纤毛顶端被活化,与IFT-A结合后共同实现物质由纤毛顶部向基部的逆向运输。因此kinesin-2、dynein-2与IFT-A、IFT-B共同参与了初级纤毛内部物质转运的整个过程[3-5](图1)。
1.2 初级纤毛的主要功能
初级纤毛通常在受到外界刺激后将相关信号转导至胞内进而影响和调控细胞的形态与极性、增殖、分化及迁移等。目前认为,初级纤毛主要具有如下生理功能:①感知细胞外各种理化刺激。初级纤毛作为一种独特的感受器,参与感知和接受细胞外微环境变化和相关信息。Louvi和Grove[5]早期发现,肾小管上皮细胞的初级纤毛可感知胞外的机械刺激和药物的自由扩散。Xiang等[6]发现,在软骨细胞发育过程中,外界物理应力可通过活化细胞外调节蛋白激酶(extracelluar regulatory protein,ERK)信号通路及抑制雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导,促进初级纤毛结构的完整性和细胞的自噬功能,进一步影响软骨细胞的生长。②调节和维持细胞稳态。其中,初级纤毛可通过相关信号转导通路调控细胞极性及正常增殖与分化等。Croyle等[7]早期发现,初级纤毛缺失可导致小鼠皮肤中Hedgehog信号通路(Hh signaling)发生障碍,进而导致毛囊滤泡发育停滞。Grisanti等[8]发现,小鼠眼角膜上皮基底细胞的初级纤毛缺失可下调Notch信号通路致使上皮基底细胞异常增殖,进而导致角膜上皮明显增厚。③影响和调控细胞周期。初级纤毛表面存在某些相关调控蛋白,负责调控相关信号转导和细胞周期变化。Pruski等[9]发现,定位于初级纤毛的GTP酶Arl13B可调节细胞迁移和细胞周期,其功能障碍可致细胞外电梯度受损以及生长因子信号减弱进而使Hennin永生化的小鼠胚胎成纤维细胞(HNN)生长停滞。Phua等[10]认为,由F-肌动蛋白推动的初级纤毛切除不仅可触发纤毛本身结构的重吸收,还可诱导丝裂信号,并可调节与纤毛生命周期和细胞分裂周期相关的增殖信号的转导。
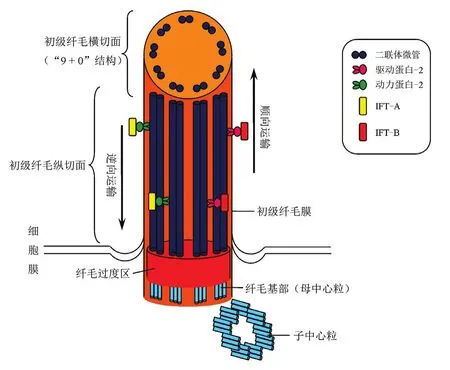
图1 初级纤毛和纤毛内转运系统结构示意图
2 初级纤毛与恶性肿瘤的关系
目前已知初级纤毛与各系统不同恶性肿瘤的发生、发展关系密切,其中涉及到纤毛内外某些相关蛋白的结构和功能及某些相关信号转导通路的异常,其涉及的分子及相互作用机制相当复杂。
2.1 皮肤恶性肿瘤
2.1.1 基底细胞癌 基底细胞癌(basal cell carcino-ma,BCC)是皮肤科临床常见的低度恶性肿瘤,其生长缓慢,主要起源于功能异常的角质形成细胞,其临床表现具有一定特殊性。Yang等[11]发现,BCC更易起源于皮肤和毛囊中具有纤毛的角质形成细胞,相对于无纤毛的角质形成细胞而言,前者更易恶变。进一步研究发现,BCC主要由PTCH1基因的功能缺失性突变或SMO基因的功能获得性突变导致。这两种基因主要编码Hh信号通路的上游跨膜元件,而PTCH1或SMO基因的致癌突变可最终导致Gli转录因子的失控性活化,进而使Hh信号通路异常;而Hh信号通路的活化需要初级纤毛参与,后者对于Hh信号通路元件的易位和Hh靶基因如Gli1和PTCH1的进一步激活具有关键作用。作者还发现,组织特异性平面细胞极性(PCP)效应基因INTU可调节初级纤毛形成和Hh信号通路,与该肿瘤的发生关系密切。皮肤中该基因的缺失可使初级纤毛形成和功能受损,导致毛囊形成异常等。INTU基因在BCC样本中异常上调;而切除小鼠内源性INTU基因可阻止BCC形成。作者认为,该基因的异常上调可能是Hh依赖的肿瘤发生过程中初级纤毛形成的必要条件[11,12]。推测其上调原因可能是:①具有纤毛的肿瘤细胞比例增加,后者高表达内源性INTU基因;②致癌突变Hh基因如PTCH1、SMO或Gli2的表达促进INTU基因的从头上调;③其他纤毛相关基因在角质形成细胞中通过解控和回缩程序促进纤毛形成;④紫外线(UV)在该肿瘤发生早期可能发挥次要作用,诱导纤毛形成[13]。因此,针对纤毛形成下游的Hh信号通路元件很能会成为预防BCC和其他Hh信号通路相关恶性肿瘤的潜在性靶点。
2.1.2 恶性黑素瘤 恶性黑素瘤(malignant melanoma,MM)是一种起源于皮肤黑素细胞的高度恶性肿瘤,其侵袭性高,早期即可发生转移。目前国内外学者对该肿瘤与初级纤毛相互关系的分子机制研究很少,主要涉及临床早期诊断和鉴别诊断。Le Coz等[14]发现,在正常黑素细胞中存在初级纤毛,而在MM细胞中初级纤毛缺失。Snedecor等[15]通过对87例色素痣和MM患者活检标本进行回顾性研究发现,相对前者而言,各类黑素瘤(包括原位黑素瘤、早期黑素瘤和转移性黑素瘤)中具有初级纤毛的细胞数量明显下降,而Ki-67阴性的非增殖MM细胞中初级纤毛明显缺失。作者认为,虽然MM细胞中初级纤毛缺失可能与细胞增殖、细胞周期进程无关,但其缺失可作为一种生物学标志有助于在该病的恶性转变、侵袭及相关治疗方面发挥积极作用。Kim等[16]在前期研究黑素细胞痣和各类MM与初级纤毛相互关系时发现,有22例黑素细胞痣细胞中均存在初级纤毛,而MM细胞中初级纤毛几乎完全消失。这与后期Snedecor等[15]学者的研究结果相似。该作者也认为,初级纤毛在一定程度上可作为区分黑素细胞痣与MM的相关指标,有助于指导进一步临床诊断。
2.2 其他系统相关恶性肿瘤
2.2.1 结肠腺癌 结肠腺癌(adenocarcinoma of colon)为消化道常见恶性肿瘤之一,主要发生于结肠,可分为腺癌、黏液腺癌和未分化癌等。Yasar等[17]通过免疫荧光和组织芯片技术发现,与正常对照组相比,在滤泡性淋巴瘤、肺腺癌、结肠腺癌和胰腺癌细胞中初级纤毛频度的百分比明显上升。作者认为,初级纤毛数量增多可能与其结构异常导致Hh信号异常上调有关,如初级纤毛结构异常包括轴丝的分支和延伸,其数量和长度增加可放大Hh信号转导作用。Sénicourt等[18]研究发现,Hh信号转导的关键效应子Gli1在3种初级纤毛阳性的结肠腺癌细胞系SW480、HT29和HCT116中均有表达。另外,SMO受体募集到初级纤毛膜表面可激发Hh信号转导,提示在结肠癌细胞中初级纤毛与Hh信号通路活化有密切联系。作者认为,初级纤毛在该肿瘤发生中直接参与了Hh信号通路活化,故可作为一种与Hh信号活化相关的生物学标志物。另外,Dvorak等[19]研究初级纤毛与相关肠道腺癌在影响其预后及生存率时发现,在小肠腺癌患者的癌细胞中初级纤毛的中位数频度(0.49%)明显高于结直肠腺癌(0.22%),而初级纤毛中位数频度较低(<0.187)的结直肠腺癌患者的总生存率明显高于初级纤毛中位数频度较高(≥0.187)的小肠腺癌患者(P<0.001)。作者认为,初级纤毛的频度变化明显影响小肠及结直肠腺癌患者的预后,同时初级纤毛可作为这些肠道恶性肿瘤的潜在生物标志物应用于临床诊断。
2.2.2 胰腺导管腺癌 胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)被认为是目前美国致死率排名第4位的消化道恶性肿瘤,确诊时即为癌症晚期。Schimmack等[20]研究发现,在胰腺上皮内瘤样变(intraepithelial neoplasia of pancreas,PanIN)到发展为胰腺导管腺癌的进程中,初级纤毛似乎存在缺失,而实际上是其从上皮到间质的再分布;在胰腺导管腺癌细胞中Hh信号通路下游的活化表明初级纤毛介导了间质反应,其机制仍需进一步阐明。Kobayashi等[21]研究发现,组蛋白脱乙酰基酶2(histone deacetylase,HDAC2)在胰腺导管腺癌细胞中过表达。HDAC2表达沉默或抑制可修复初级纤毛形成,其失活可导致丝氨酸/苏氨酸激酶(aurora A,AURKA)的表达降低,而后者可使初级纤毛分解;同时,HDAC2可不依赖原癌基因K-ras而控制初级纤毛形成,而后者可促进AURKA的表达;AURKA与胰腺导管腺癌密切相关,而HDAC2可正调控其转录进而促进肿瘤发生。作者认为,HDAC2抑制剂作为一种新型药物在胰腺导管腺癌的治疗领域具有相当潜力。
2.2.3 乳腺癌 乳腺癌(breast cancer)属于内分泌相关恶性肿瘤之一,是目前全球女性中因恶性肿瘤死亡的主要病因。有研究发现,在乳腺癌细胞中,与初级纤毛形成和定位的相关基因(如IFT46、PKD2)表达下调,而癌基因NEK2过度表达,后者可活化微管解聚激酶KIF24,继而使初级纤毛分解;敲除KIF24可使纤毛修复,进而抑制肿瘤增生。另一方面,定位于初级纤毛上的PTCH,SMO和Gli转录因子参与促瘤的Hh信号通路的调控,后者的异常活化可促进乳腺癌的发生,而乳腺癌细胞通过Hh经典通路并不活化Hh靶基因表达,即Hh靶基因表达不依赖于SMO活性。进一步研究发现,在小鼠乳腺癌中,初级纤毛形成被抑制可促使肿瘤本身更加具有侵袭性;而在人乳腺癌中,抑制初级纤毛形成可促进Hh靶基因表达增强[22,23]。Légaré等[24]发现,SMRT/HDAC1相关阻遏蛋白(SPEN)作为一种肿瘤抑制蛋白,与初级纤毛形成关系密切。在富含初级纤毛的MCF10A和Hs578T细胞中,SPEN沉默可使纤毛形成减少,故SPEN可调控初级纤毛形成。作者还发现,SPEN可能通过调控初级纤毛的丰度进而影响乳腺癌细胞的早期转移,这可能与SPEN表达水平和肿瘤组织本身的复杂性相关,其具体作用机制仍有待进一步探讨。
2.2.4 透明细胞肾癌 透明细胞肾癌(clear cell renal cell carcinoma)是来源于肾透明细胞的恶性肿瘤,恶性程度较低,约占肾癌的70%~80%。Dere等[25]研究发现,VHL基因突变与透明细胞肾癌发生相关,即在肿瘤细胞中,VHL基因缺失以及AURKA活化可致初级纤毛分解进而导致其缺失。作者进一步发现,在无VHL基因的细胞中,AURKA表达受β-连环蛋白转录的驱使,而驱动蛋白家族的HIFiA并不使AURKA表达增加。在透明细胞肾癌细胞中,HIF1A可通过抑制β-连环蛋白的转录进而抑制AURKA表达。作者还发现,在VHL缺失细胞中,VHL基因敲除可活化β-连环蛋白并使AURKA表达增加,减少初级纤毛形成并使其长度明显缩短。相反,β-连环蛋白敏感性转录抑制因子iCRT14可降低AURKA表达水平并修复初级纤毛,增加纤毛形成。作者认为,β-连环蛋白抑制因子可作为修复初级纤毛形成的重要方法并成为一种新的治疗途径应用于透明细胞肾癌的临床治疗。
2.2.5 胶质母细胞瘤 胶质母细胞瘤(glioblastoma,GBM)属于星形胶质细胞肿瘤,主要发生于中枢神经系统,常呈浸润性生长。Maria和Ander[26]分析指出,人星形胶质瘤细胞系(U-251 MG)中,细胞周期蛋白依赖激酶(CDK/CCRK)20过表达可介导初级纤毛丢失,后者可促进肿瘤细胞增殖;而抑制CDK20/CCRK的表达可使纤毛形成功能恢复。GBM的形成、侵袭和耐药等均依赖于初级纤毛,如具有初级纤毛的GBM瘤细胞亚群可表达锌指E-盒结合同源异形盒1(ZEB1),后者作为一种转录因子在GBM的上皮间质转化中具有重要诱导作用,可促使该肿瘤发生和侵袭等。作者还指出,初级纤毛与某些重要信号通路密切相关,进而影响GBM的发生和发展,如CDK/CCRK介导的初级纤毛缺失与磷脂酰肌醇-3-激酶(PI3K)信号通路密切相关,即PI3K通路的异常活化可通过促进CDK20/CCRK的表达而影响纤毛结构的维持,间接导致肿瘤的发生;而外源性激活与初级纤毛相关的Hh信号通路可导致肿瘤的失控性生长[27]。由此可见,GBM的发病机制十分复杂,初级纤毛和某些信号通路作为该肿瘤发生和发展的重要调控因子值得深入研究和探讨。
2.2.6 骨肉瘤和软骨肉瘤 骨肉瘤(osteosarcoma)又称成骨肉瘤,是一种起源于间质细胞的恶性成骨性肿瘤,儿童或青少年多发。Kowal和Falk[28]培养人骨肉瘤MG63细胞和免疫荧光标记初级纤毛相关蛋白Arl13b时发现,在MG63细胞中所测得初级纤毛数量比为46.5%±11.5%,进一步发现骨肉瘤细胞主要在G1、S和G2期强烈表达初级纤毛,提示初级纤毛与该肿瘤高度增生密切相关。软骨肉瘤(chondrosarcoma)是另一种来源于软骨的恶性骨肿瘤,好发于成人。Yuan和Yang[29]指出,具有纤毛的恶性软骨细胞中其初级纤毛频度仅为12.4%,较正常软骨细胞(67.7%)明显降低,提示在软骨细胞中初级纤毛的缺失可导致细胞增殖阻滞,并促进细胞周期调节基因的缺失,而后者有助于肿瘤生长。因此作者认为,初级纤毛可作为一种重要的生物学标志应用于临床。
2.2.7 非小细胞肺癌 非小细胞肺癌(non-small-cell lung carcinoma)是一种严重威胁人类健康和生命的呼吸系统恶性肿瘤,包括肺鳞状细胞癌、腺癌及大细胞癌。非小细胞肺癌与小细胞癌相比,其癌细胞生长分裂及扩散转移相对较慢,约占所有肺癌发病率的80%。但初级纤毛并不直接影响该肿瘤的发生发展。Kim等[30]发现,Wnt/β-连环蛋白信号通路异常可导致非小细胞肺癌发生和相关药物抵抗。在该肿瘤细胞中,驱动蛋白-2家族成员KIF3A可抑制Wnt/β-连环蛋白信号通路的异常表达,而敲除该基因既可增加β-连环蛋白水平也可促进恶变相关的转录活性。作者进一步发现,KIF3A结合β-抑制蛋白并通过非初级纤毛依赖分子机制调控Wnt/β-连环蛋白信号通路的应答。由此可见,某些恶性肿瘤如非小细胞肺癌发生并不依赖于初级纤毛的调控,而是与其内部的相关标志分子发生相互作用有关系。
3 小结
初级纤毛作为一种古老而重要的细胞器,存在于人体各个器官和组织细胞中,其数量众多、功能复杂。初级纤毛发挥其重要功能与维持人体正常生理稳态密切相关。在病理状态下,初级纤毛结构和功能异常可导致临床很多疾病包括某些恶性肿瘤的发生发展。其中,初级纤毛既具有重要的抑瘤效应,也具有一定的促瘤作用,这与其内外相关蛋白分子表达异常有关,还与部分重要的信号转导通路,如Hh及Wnt等通路的信号转导异常密切相关,但其涉及的相关分子及作用机制却十分复杂。因此,进一步探讨和研究初级纤毛与恶性肿瘤的关系对将来临床上发现新的预防机制和治疗靶点,并进一步有效防治恶性肿瘤的发生发展具有重要的作用和意义。

