载紫杉醇的大黄酸偶联物胶束对MCF-7细胞的毒性与细胞摄取研究
王晓颖,王夏英,邱梁桢,欧阳惠枝,徐 伟
(福建中医药大学药学院,福州350122)
聚合物胶束是由两亲性高分子聚合物在水中自组装而成的,具有壳-核结构的纳米递药载体。其疏水内核能增溶难溶性药物;其亲水性外壳能提高其在水溶液中的稳定性,保护药物,减少其在体内被网状内皮系统识别从而降低被快速清除的机率;其纳米级粒径,利于其携带药物利用肿瘤血管的高通透性通过增强渗透滞留效应(EPR)被动靶向肿瘤部位[1-2]。
载药聚合物胶束的抗肿瘤活性研究对预测其临床药效具有重要意义,一直受到研究者关注。而体外细胞研究为其抗肿瘤活性及其机制研究奠定了研究基础[3]。本课题组前期用水溶性、生物相容性良好、可降解的羧甲基壳聚糖(carboxymethyl chitosan,CMCS)与具有抗炎、抗肿瘤、抗肿瘤血管生成的中药有效成分大黄酸(rhein,R)合成了两亲性的羧甲基壳聚糖-大黄酸偶联物(CR偶联物)[4],作为难溶性药物递送载体材料,并制备了载抗肿瘤药物紫杉醇(paclitaxel,PTX)的CR偶联物胶束(PTX/CR偶联物胶束),本研究对其MCF-7细胞毒性及其细胞摄取进行研究,为其进一步抗肿瘤研究提供依据。
1 材 料
1.1 药品与试剂
紫杉醇(上海中西三维药业有限公司);CR偶联物(自制,大黄酸物质的量取代度为7.2%),P4荧光探针由上海复旦大学自制提供。透析袋(MWCO14000,上海绿鸟科技发展有限公司);磷酸盐缓冲液(1×)、0.25%胰蛋白酶(1×)、青霉素链霉素溶液(美国HyCloneTM公司);胎牛血清、人重组胰岛素(美国Sigma公司);四甲基偶氮唑蓝(德国BioFroxx公司);MEM、Glutamax、非必需氨基酸(100×)(美国 Invitrogen公司);Hoechst 33342(中国美仑生物公司),其他试剂均为市售分析纯。
1.2 仪 器
Zetasizer Nano ZS90型激光粒度仪(英国Malvern公司);ESCALAB 250型X射线光电子能谱仪(美国VG公司);Infinite M200 PRO多功能酶标仪(瑞士Tecan公司);LSM710型激光共聚焦显微镜(德国蔡司公司);MS105DU十万分之一电子天平(梅特勒-托利多仪器上海有限公司);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);ALPHA1-2 LD冷冻干燥机(德国Christ公司)。
1.3 细胞株
乳腺癌MCF-7细胞株(中国科学院细胞库)。
2 方 法
2.1 PTX/CR偶联物胶束的制备与表征
2.1.1 PTX/CR偶联物胶束的制备[5]本课题组前期完成了透析法对PTX/CR偶联物胶束载药方法的考察,具体为:7 mg/mL CR偶联物水溶液2.6 mL,加入含30 mg/mL PTX的乙醇溶液430μL,搅拌20 min,冰水浴探头超声30 min,蒸馏水透析12 h,冰水浴探头超声20 min,0.8μm滤膜过滤,冷冻干燥,得PTX/CR偶联物胶束。并以HPLC法测得PTX/CR偶联物胶束的载药量为32%。动态激光散射法(DLS)测得PTX/CR偶联物胶束的平均粒径为(187.8±1.0)nm,PDI为(0.13±0.03)(n=3),其 Zeta电位为(-31.5±4.2)mV(n=3)。
2.1.2 X射线衍射(XRD) 将PTX、CR偶联物、CR偶联物+PTX的物理混合物、PTX/CR偶联物胶束分别置于样品槽内,以5°/min的速度扫描,扫描的角度范围为3°~45°。测试电压及电流分别为20 kV、20 mA,发射源为Cu-Kα。
2.2 细胞毒实验
取对数生长期的MCF-7细胞,消化后调整细胞悬浮液至每毫升含5×104个细胞,向96孔板中每个孔各加入该细胞悬浮液100μL,培养箱中孵育24 h使其贴壁,吸去培养液。设置不同分组:Cremophor EL-无水乙醇混合溶剂(1∶1)组、CR偶联物组、Taxol®组、PTX/CR偶联物胶束组、空白组和正常对照组。向96孔板中加入上述各组受试液各150μL,Taxol®组和PTX/CR偶联物胶束组分别含 PTX浓度为 1、5、10、50、100、500、1 000 nmol/L 6种不同浓度,Cremophor EL-无水乙醇混合溶剂(1∶1)组和CR偶联物组按上述Taxol®组和PTX/CR偶联物胶束组所含的溶剂或载体量计算,以上每个浓度平行6个孔,以不含细胞的培养基和MTT溶液作为空白组,含细胞不给药物的细胞作为正常对照组,37℃,5%CO2培养箱中孵育。
分别于加药后24和48 h,将培养板取出,每孔各加入0.5 mg/mL MTT溶液100μL,37℃培养箱中继续孵育4 h后取出,小心吸取上清液。每孔各加入DMSO 150μL溶解蓝紫色结晶物。用酶标仪在570 nm处测定吸收度(A)。并根据各孔的吸收度,按公式(1)计算细胞的存活率:
2.3 细胞摄取实验
2.3.1 共载P4和PTX的CR偶联物胶束的制备
称取CR偶联物18 mg,加蒸馏水2.6 mL室温下冰水浴探头超声10 min使其充分溶解。称取PTX 12.86 mg,精密称定,溶于P4的甲醇溶液(200μg/mL)200μL中,超声使其溶解并混匀,然后逐滴加至CR偶联物胶束溶液中,剧烈搅拌20 min,冰水浴探头超声30 min,透析12 h后,结束透析定容至6 mL,冰水浴探头超声 20 min,3 500 r/min离心5 min,取上清液,得共载P4和PTX的CR偶联物胶束,即(P4+PTX)/CR偶联物胶束。
2.3.2 细胞摄取实验 将MCF-7细胞以每毫升含1×105个细胞的密度接种于激光共聚焦培养皿上,每孔加入该细胞悬浮液1 mL,培养至4 d。从培养箱中取出激光共聚焦皿,弃去培养液,加入37℃预热的PBS溶液轻轻冲洗细胞3次。加入各含药制剂0.5 mL,孵育2 h后,弃去药液,加入4℃的冰冷PBS终止摄取,清洗细胞3次。弃去PBS溶液,用4%多聚甲醛固定20 min,冷PBS清洗5次,加入10μg/mL细胞核染色液 Hoechst 33342 1 mL继续孵育15 min,用冷PBS清洗3次后加入 PBS 200μL,于激光共聚焦显微镜(CLSM)下观察并拍照。
2.3.3 流式细胞半定量实验 将MCF-7细胞以每毫升含2×105个细胞的密度接种于6孔板上,每孔加入该细胞悬浮液2 mL,培养至4 d。用PBS溶液轻轻冲洗细胞2次,加入各含药制剂1 mL,于37℃孵育2 h后,移除药液,加入4℃的冰冷PBS终止摄取,清洗细胞3次,0.25%胰蛋白酶消化细胞,加入含血清的培养液吹散细胞。收集细胞,离心,然后加入PBS洗涤、离心如此重复3次后加入PBS 0.5 mL将细胞制成细胞悬液。
3 结 果
3.1 XRD测定结果
PTX、CR偶联物、CR偶联物+PTX物理混合物以及PTX/CR偶联物胶束的XRD图谱见图1。PTX在5.1°和12.8°处有2个强吸收峰,在15°~30°之间又有若干个弱峰。CR偶联物仅在20°有一较弱吸收峰。CR偶联物+PTX物理混合物图谱具有明显的PTX和CR偶联物的特征吸收峰,而PTX/CR偶联物胶束图谱中仅5.1°处有较明显的吸收峰,可能是冻干前PTX/CR偶联物胶束释放在水溶液中的少量游离PTX造成的,但与相同量CR偶联物与PTX物理混合物的XRD图相比,PTX其他各吸收峰极弱,推测大部分PTX可能以无定型状态包载于胶束内部。
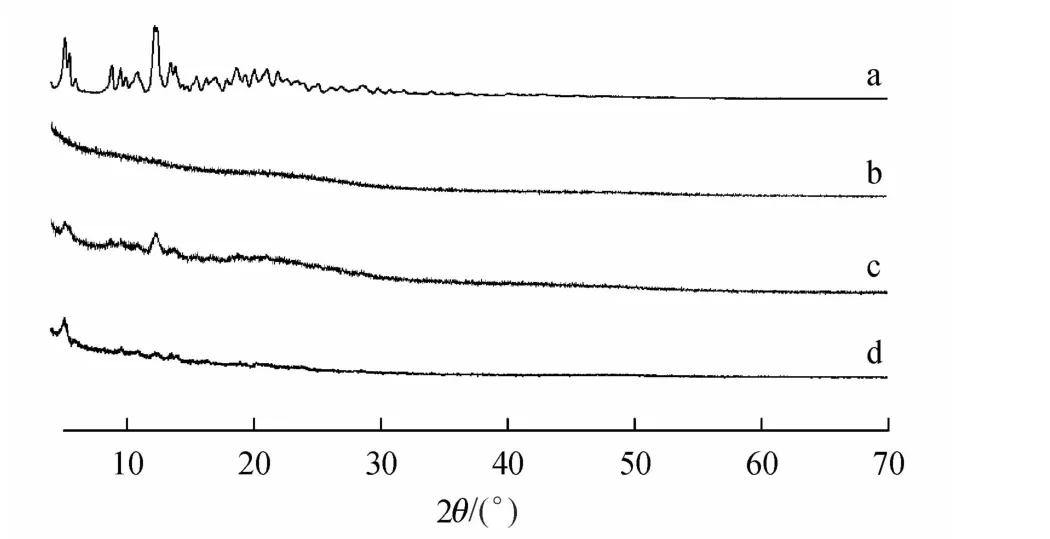
Figure 1 X-Ray diffraction spectraa:Paclitaxel(PTX);b:Carboxymethyl chitosan-rhein conjugate(CR conjugate);c:CR conjugate and PTX mixture;d:Paclitaxel-loaded carboxymethyl chitosan-rhein polymeric micelles(PTX/CR PMs)
3.2 细胞毒实验结果
MTT法检测Taxol®的溶剂Cremophor EL-无水乙醇混合溶剂(1∶1)、CR偶联物、Taxol®及 PTX/CR偶联物胶束的细胞毒性的结果见图2。结果显示,在实验浓度范围内,CR偶联物具有良好的安全性。Taxol®及PTX/CR偶联物胶束均对MCF-7细胞有一定的抑制率。24和48 h时,Taxol®及PTX/CR偶联物胶束对MCF-7细胞的抑制作用均随着PTX浓度的增加而增强,表明Taxol®及PTX/CR偶联物胶束对MCF-7细胞的杀伤作用均有时间和浓度依赖性。24 h时,在10~1 000 nmol/L范围内,PTX/CR偶联物胶束表现出比Taxol®更好的细胞杀伤力。PTX/CR偶联物胶束24 h的IC50为293.9 nmol/L。48 h时,PTX/CR偶联物胶束与Taxol®对MCF-7细胞的杀伤力相近。
3.3 细胞摄取实验结果
为了进一步考察CR偶联物胶束以载药胶束完整的形式被细胞摄取还是释放药后药物以游离的形式被细胞摄取,环境响应型荧光探针P4被应用于细胞摄取实验。利用CLSM定性观察(图3)和流式细胞仪定量测定(图4)的方法对P4与PTX共载的(P4+PTX)/CR偶联物胶束在MCF-7细胞中的摄取情况进行了研究。CLSM拍摄的MCF-7细胞摄取照片(图3)中,红色荧光信号为P4荧光探针发出,蓝色荧光信号为Hoechst 33342染色的细胞核。图中显示,游离的P4溶液处于水环境中,荧光淬灭,因此只能观察到蓝色的细胞核,而(P4+PTX)/CR偶联物胶束组的红色荧光主要分布在细胞核(蓝色荧光)周围,说明(P4+PTX)/CR偶联物胶束主要分布于细胞质。与此同时,给予MCF-7细胞相同浓度的制剂并通过流式细胞仪分析,其结果如图4所示,游离P4溶液的荧光强度极弱,可认为是细胞自身所发出的荧光,而(P4+PTX)/CR偶联物胶束的荧光强度是游离P4的500倍以上,表明(P4+PTX)/CR偶联物胶束是以完整的胶束形式被MCF-7细胞内吞摄入,这些结果与通过CLSM观察的结果相吻合,这为之后体内的进一步研究提供了理论依据。
CLSM观察结果和流式细胞术检测的(P4+PTX)/CR偶联物胶束加维拉帕米组的细胞摄取结果显示,其与(P4+PTX)/CR偶联物胶束在MCF-7细胞中的摄取量无明显差异,说明CR偶联物胶束可以保护其所载的荧光探针和/或药物不被P-糖蛋白(P-gp)外排到细胞外。
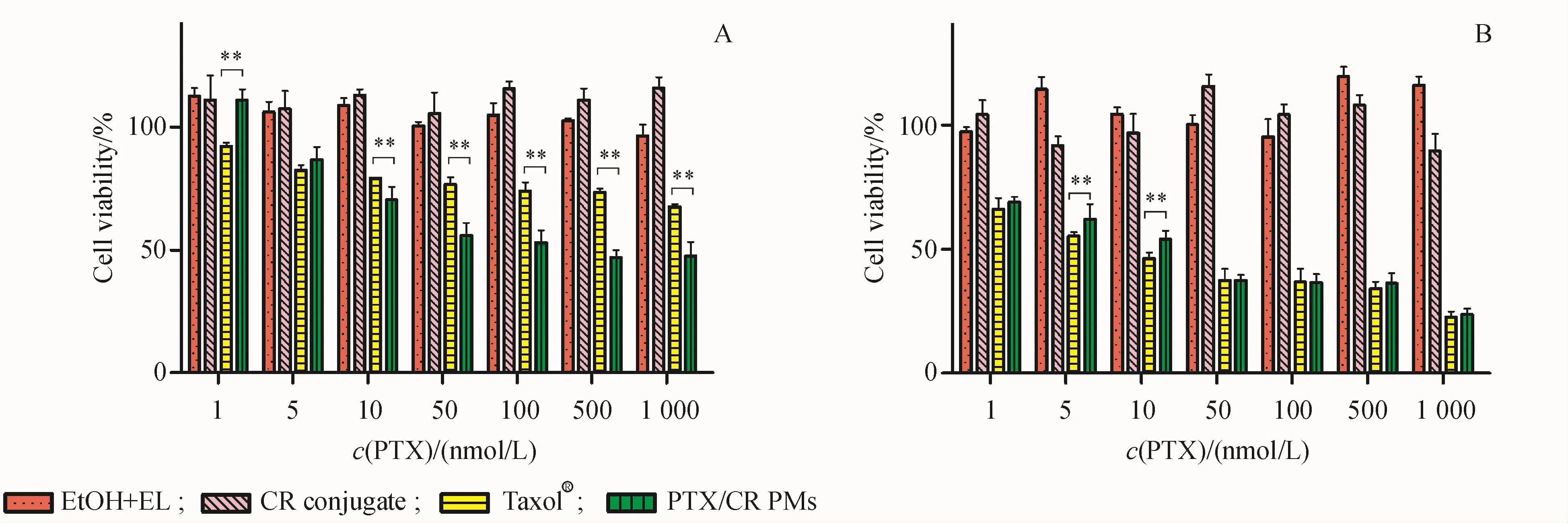
Figure 2 In vitro cytotoxicity of CR conjugate and PTX/CR PMs in MCF-7 cells after incubation for 24 hours(A)and 48 hours(B)(x¯±s,n=6)EtOH+EL:Dehydrated ethanol-Cremophor EL(1∶1)**P<0.01
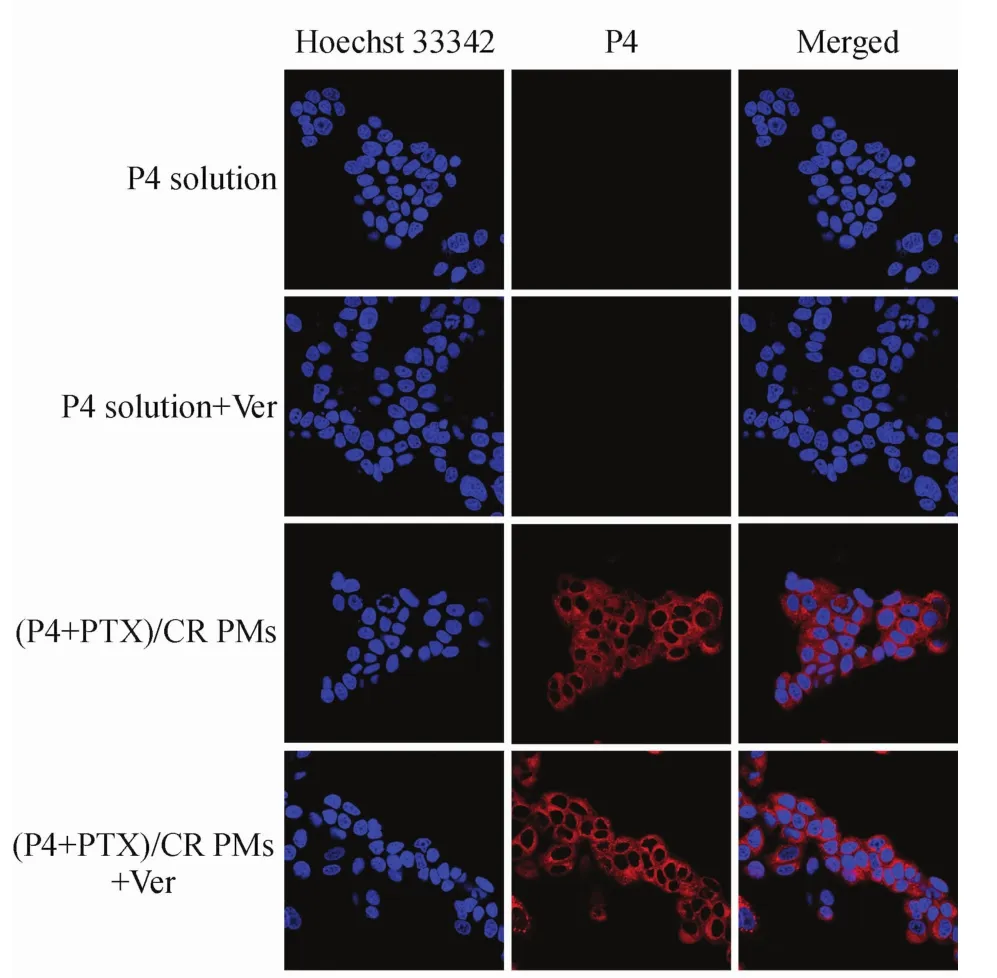
Figure 3 Cellular uptake of P4 and PTX co-loaded carboxymethyl chitosan-rhein polymeric micelles[(P4+PTX)/CR PMs]in MCF-7 cells by confocal laser sanning microscopeVer:Verapamil
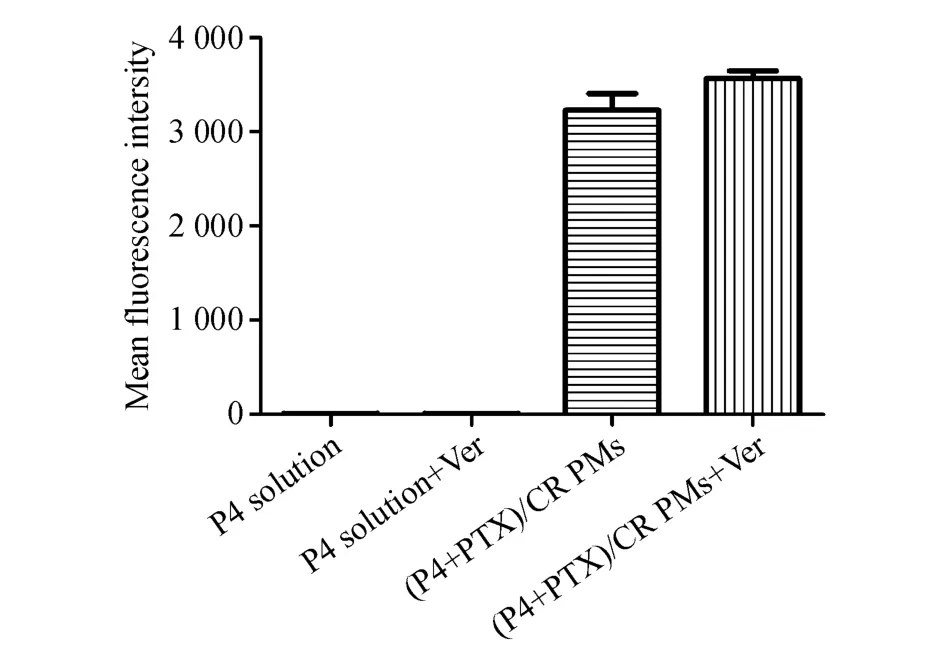
Figure 4 Cellular uptake of(P4+PTX)/CR PMs in MCF-7 cells by flow cytometry(x¯±s,n=3)
4 讨 论
PTX主要是通过抑制微管解聚,阻止肿瘤细胞的有丝分裂,因而对肿瘤细胞产生较强的细胞毒作用[6-7]。因此,聚合物胶束是否能够递送PTX到达细胞内其作用靶点上,对能否对肿瘤细胞产生杀伤作用具有重要意义。本实验结果表明,PTX/CR偶联物胶束主要分布于细胞质中,与紫杉醇作用部位相一致,有利于紫杉醇抗肿瘤作用的发挥。
PTX/CR偶联物胶束在24 h时表现出优于Taxol®对MCF-7细胞的杀伤效果,本课题组前期实验已证明CR偶联物与PTX具有一定的协同抗肿瘤作用[4],因此推测,其对MCF-7细胞良好的细胞杀伤作用可能与载体材料CR偶联物与PTX的协同作用相关。
本实验中所使用的荧光探针P4为上海复旦大学药学院吴伟教授课题组开发的具有4,4′-二氟-4-硼-3α,4α-二氮杂-s-并二苯(BODIPY)结构的荧光探针。这种荧光探针在水环境中荧光分子因疏水作用会发生分子间π-π堆积,使荧光发生 淬 灭 (aggregation-caused quenching,ACQ效应)[8-10]。该ACQ探针具有高度亲脂性,可以紧密嵌入脂质或包裹在聚合物胶束内部中从而发出荧光信号。一旦聚合物胶束解聚或探针从胶束中泄漏,荧光探针即因被释放进入水环境中而快速聚集发生荧光淬灭,从而与保留在聚合物胶束中的荧光探针发射出的强烈荧光信号形成鲜明对比,由此可以判断纳米胶束在细胞内外的完整性。以P4为荧光探针的实验结果表明,CR偶联物胶束是以完整形态进入MCF-7肿瘤细胞内,并且可以保护其所载荧光探针和/或药物避免被P-gp外排到细胞外,此研究将为CR偶联物的进一步研究奠定基础。
致谢:感谢复旦大学吴伟教授和赵伟利教授提供P4探针。感谢闽台中药分子生物技术国家地方联合工程研究中心,福建省中药学重点实验室,福建省中药资源研究与开发利用重点实验室对本研究的支持。

