发酵型黄精米酒动力学及抗氧化性研究
汪 涛,裴海生,王民敬,胡雪芳,唐维媛,张志民
(1.农业农村部规划设计研究院 农产品加工工程研究所,北京 100121;2.农业农村部农产品产后处理重点实验室,北京 100121;3.贵州大学 酿酒与食品工程学院,贵阳 550025;4.贵州理工学院,贵阳 550003)
黄精(Polygonatum sibiricum)又名鸡头黄精,我国首批进入食药同源的品种,黄精富含活性多糖、黄酮类化合物、多酚类化合物、甾体皂苷、蒽醌类化合物、生物碱和多种人体有用氨基酸类化合物[1]。经研究,黄精在治疗疲劳、降血糖、提高免疫和缓解性功能障碍等方面均有很好的疗效[2-4]。李锦松等[5]研究发现,黄精有助于酿酒酵母的生长,并能提高黄酒的产酒率和体外抗氧化能力。
发酵动力学主要是研究微生物生长、产物生成及底物消耗随发酵时间的变化规律构建适合的数学模型,并通过模型对发酵生产进行工艺控制、定量分析和各项指标的准确预测;还可以通过模型预判发酵初期出现的异常情况,对过渡到工业发酵具有实际的指导意义[6-8]。李秀萍等[9]采用Logistic和Leudeking-Piret模型,构建甘蔗果酒发酵过程中酵母菌生长、酒精生成及底物消耗动力学模型,拟合度R2分别为0.983 2、0.972 4和0.972 1,能准确模拟甘蔗果酒的发酵过程,有利于其工业化生产。蒋艾廷等[10]采用Matlab软件对一株优选酿酒酵母构建发酵动力模型,对发酵过程中微生物数量的变化和葡萄糖的消耗分别进行非线性拟合,拟合度R2分别为0.997 2和0.978 4,拟合效果较好,说明拟合模型能很好的描述该菌的发酵过程。
目前,发酵型黄精米酒的研究主要集中在发酵工艺方面,陶涛[11]运用响应面法研究发酵型黄精米酒加工工艺;梁安怡[12]通过正交试验优选出发酵型黄精米酒的最佳酿制条件。但关于发酵型黄精米酒在发酵过程中酵母菌生长、酒精生成及残糖消耗动力学特征方面的研究鲜有报道。本试验采用经典的“S”曲线模型对发酵型黄精米酒发酵过程中酵母菌含量变化、酒精生成及残糖消耗进行非线性拟合,构建发酵动力学模型。测定发酵过程中总酚和总黄酮含量的变化,同时结合总抗氧化能力试剂盒法、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和邻苯三酚自氧化物法探讨不同发酵时间发酵型黄精米酒的抗氧化性。通过对发酵型黄精米酒动力学及抗氧化性的研究分析,为后期工业生产和产品的定位提供理论指导。
1 材料与方法
1.1 材料与试剂
黄精(Polygonatum sibiricum):辽宁澳地森生物工程有限公司;圆江糯米:盘锦大米集团;酿酒酵母:中国食品发酵工业研究院;酒曲:雅大科技实业有限公司。
麦芽汁培养基:青岛高科技工业园海博览生物技术有限公司;亚铁氰化钾、没食子酸标准品、芦丁标准品、邻苯三酚、DPPH自由基(均为分析纯):国药集团化学试剂有限公司;亚硝酸钠、硝酸铝(均为分析纯):西陇化工股份有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
CH-270LFJG-00米酒发酵罐:上海承欢轻工机械有限公司;酒精计:广州市铭睿电子科技有限公司;LDZX-50KBS立体式高压灭菌器:上海申安医疗器械厂;RE-2000A旋转蒸发器:西安乔普生物科技有限公司;HZQ-C空气浴振荡器:东联电子技术开发技术有限公司;PB-10 酸度计:杭州微米派科技有限公司;UV-1780紫外可见分光光度计:岛津仪器(苏州)有限公司。
1.3 方法
1.3.1 发酵型黄精米酒工艺流程
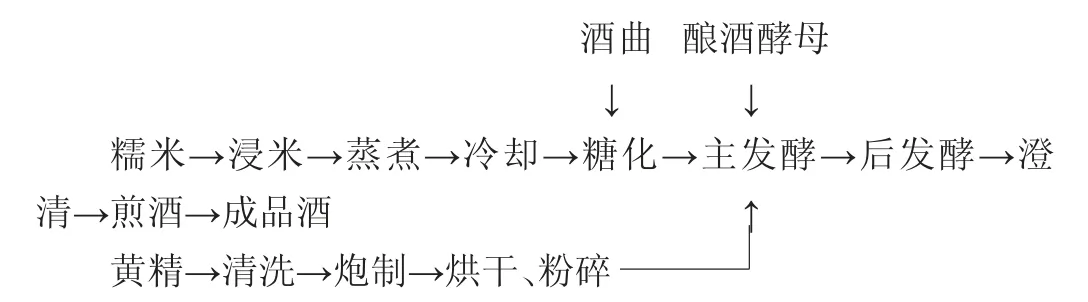
糯米汽蒸后冷却至常温,添加0.6%酒曲糖化24 h后,接种2%酿酒酵母并加入7%的黄精粉发酵,28 ℃进行主发酵6 d,结束后将温度降至15 ℃进入后发酵14 d。主发酵每隔1 d取样,后发酵每隔2 d取样。
1.3.2 发酵动力学指标测定方法
菌含量:细胞干质量法[7];酒精度、残糖含量按GB/T 13662—2008《黄酒》测定[13]。
1.3.3 总酚、总黄酮含量的测定
总酚含量:采用Folin-Ciocalteu法[14]测定;没食子酸标准曲线回归方程:y=0.845 8x+0.034 2,R2=0.999 5。
总黄酮含量:采用分光光度法[14]测定;芦丁标准曲线回归方程:y=0.299 6x+0.021 7,R2=0.999 3。
1.3.4 总抗氧化能力的测定
按照总抗氧化能力测定试剂盒法[15]操作步骤测定总抗氧化能力。按下式计算总抗氧化能力:

1.3.5 O2-·清除率的测定
取1.0 mL样品与5.0 mL Tris-HCl溶液(pH8.2)混匀,25 ℃水浴20 min后加入0.05 mol/L邻苯三酚溶液1.0 mL,摇匀,25℃水浴5 min,加入浓盐酸1.0 mL终止反应,蒸馏水调零,在波长325nm处测定样品吸光度值[16]。按下式计算O2-·清除率。

式中:A0为蒸馏水代替样品的吸光度值;Ax0为蒸馏水代替邻苯三酚的吸光度值;Ax为样品的吸光度值。
1.3.6 DPPH自由基清除率的测定
取2.0 mL样品与2.0 mL 0.2 mmol/L DPPH溶液混匀,暗反应30 min,蒸馏水调零,在波长517 nm处测定吸光度值(Ax);同样测定2.0 mL 0.2 mmol/L DPPH溶液与2.0 mL体积分数70%的乙醇溶液的吸光度值(A0);以及2.0 mL样品与体积分数70%的乙醇溶液的吸光度值(Ax0)[17]。按下式计算DPPH自由基清除率。
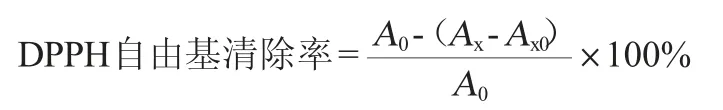
1.3.7 数据处理与分析
采用Origin 2017软件对实验数据作图分析,选取典型“S”曲线模型对酵母菌含量、酒精度及残糖含量进行非线性拟合,选拟合度R2大的数学模型描述其发酵动力学特征,并应用SPSS 19.0软件对最佳模型预测值与实验值进行T显著性检验。应用Origin 2017软件对发酵过程中总酚含量、总黄酮含量及抗氧化性变化进行作图分析。
2 结果与分析
2.1 发酵过程中酵母菌含量、酒精度及残糖含量的变化情况
由图1可知,酵母菌在发酵1~4 d经历迟满滞期和对数期,菌体含量大幅度增加。发酵4~6 d酵母菌增殖进入稳定期,菌体含量最大为21.9 g/L。发酵6 d后酵母菌进入衰亡期,菌体含量开始减少,主要原因是随着发酵时间的延长,还原糖快速消耗,酒精度快速上升,菌体出现自溶和沉淀;另外,发酵性糖的转化,使发酵醪液的渗透压升高,严重抑制酵母菌的代谢[18]。酒精度在发酵1~6 d增长速度较快,发酵6 d后,酒精度增加极其缓慢基本趋于稳定,酒精度最高为11.4%vol。由于酵母菌将残糖转化为酒精及合成自身所需要的能量物质,残糖含量逐渐降低,发酵1~6 d降低速度较快;到6 d后因为酵母菌的衰老和数量的减少,残糖含量基本稳定在较低的水平。

图1 发酵过程中酵母菌含量、酒精度及残糖含量的变化趋势Fig.1 Change trends of yeast number,alcohol content and residual sugar content during fermentation process
2.2 发酵型黄精米酒动力学模型
2.2.1 酵母菌生长动力学模型
对发酵1~6 d酵母菌生长情况进行非线性拟合,通过SGompertz模型、DoseResp模型和Logistic模型进行拟合,结果见表1。由表1可知,拟合度R2分别为0.936 7、0.997 5和0.992 5,故选DoseResp模型对酵母菌生长进行拟合,拟合曲线如图2所示。

表1 酵母菌含量拟合方程及R2值Table 1 Fitting equation of yeast number and R2 value
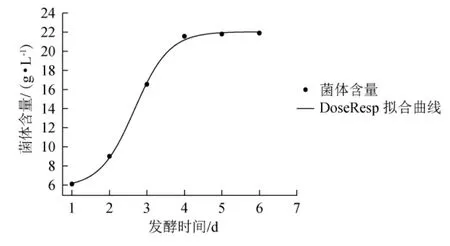
图2 DoseResp模型下酵母菌生长拟合曲线Fig.2 Fitting curve of yeast growth with DoseResp model
由表2可知,在置信区间95%,显著水平α=0.05时,t1(0.05)=0.496 7,检验值T1=-0.008 2<t1(0.05),说明预测值与实验值不存在显著性差异(P>0.05),DoseResp模型能很好的模拟发酵过程中酵母菌生长情况。

表2 酵母菌生长模型预测值与实验值T检验结果Table 2 Comparison of model and experimental values for yeast growth by T test results
2.2.2 酒精生成动力学模型
通过Boltzmann模型、DoseResp模型和Logistic模型对发酵过程中酒精生成进行非线性拟合,如表3所示。由表3可知,拟合度R2分别为0.995 3、0.995 3和0.990 6,故选Boltzmann模型和DoseResp模型对酒精生成进行拟合,拟合曲线如图3和图4所示。

表3 酒精生成拟合方程及R2值Table 3 Fitting equation of alcohol formation and R2 value
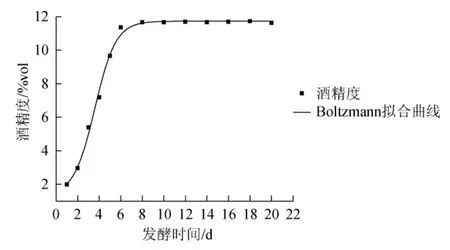
图3 Boltzmann模型下酒精生成拟合曲线Fig.3 Fitting curve of alcohol formation with Boltzmann model
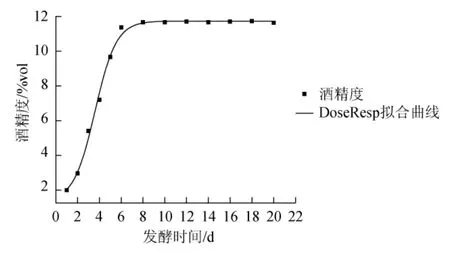
图4 DoseResp模型下酒精生成拟合曲线Fig.4 Fitting curve of alcohol formation with DoseResp model

表4 酒精生成模型预测值与实验值T检验结果Table 4 Comparison of model and experimental values for alcohol formation by T test results
由表4可知,在置信区间95%,显著水平α=0.05时,t2(0.05)=0.477 3,检验值T2=-0.058 1<t2(0.05),检验值T3=1.113 6E-5<t2(0.05),说明两模型预测值与实验值不存在显著性差异(P>0.05),Boltzmann模型与DoseResp模型均能很好的模拟发酵过程中酒精生成情况。
2.2.3 残糖消耗动力学模型
通过Boltzmann模型,DoseResp模型和Logistic模型对发酵过程中残糖消耗进行非线性拟合,如表5所示。由表5可知,拟合度R2分别为0.993 2、0.993 2和0.982 7,故选Boltzmann模型和DoseResp模型对残糖消耗进行拟合,拟合曲线如图5和图6所示。

表5 残糖消耗拟合方程及R2值Table 5 Fitting equation of residual sugar consumption and R2 value

图5 Boltzmann模型下残糖消耗拟合曲线Fig.5 Fitting curve of residual sugar consumption with Boltzmann model
由表6可知,在置信区间95%,显著水平α=0.05时,t3(0.05)=0.5,检验值T4=-1.70146E-5<t3(0.05),检验值T5=-0.023 3<t3(0.05),说明两模型预测值与实验值不存在显著性差异(P>0.05),Boltzmann模型与DoseResp模型均能很好的模拟发酵过程中残糖消耗情况。
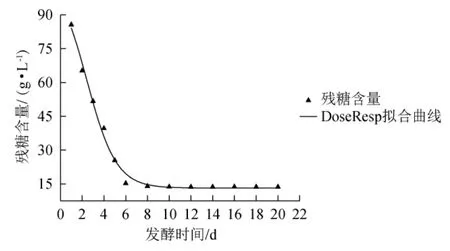
图6 DoseResp模型下残糖消耗拟合曲线Fig.6 Fitting curve of residual sugar consumption with DoseResp model

表6 残糖消耗模型预测值与实验值T检验结果Table 6 T test results of model and experimental values for residual sugar consumption
2.3 发酵过程中总酚、总黄酮含量的变化情况
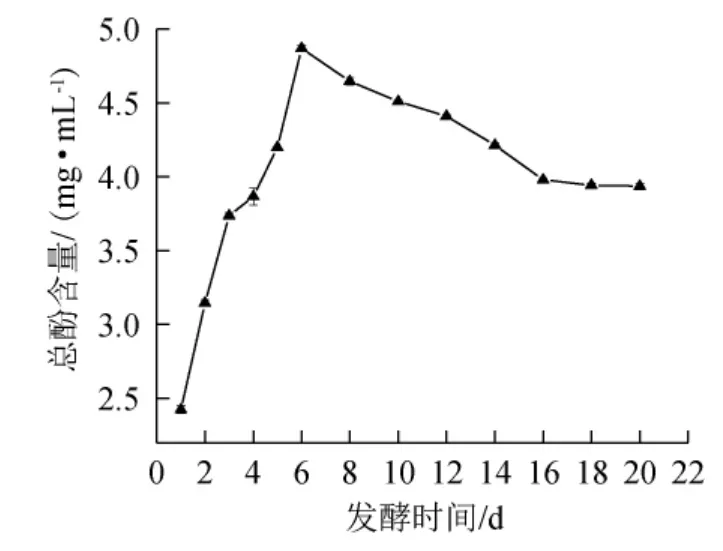
图7 发酵过程中总酚含量的变化趋势Fig.7 Change trends of total phenols contents during fermentation process
由图7可知,总酚含量呈先增加后降低并缓慢趋于稳定的趋势,一方面是因为随着发酵的进行酒精度不断的上升,且酚类物质易溶于有机溶剂;另一方面可能是酚类化合物在发酵液中发生了氧化和降解反应[19]。发酵1~6 d期间总酚含量呈上升趋势,最高含量达4.87 mg/mL;发酵6 d后总酚含量开始降低并趋于稳定,发酵结束时总酚含量显著高于发酵初始水平(P<0.05)。
由图8可知,总黄酮含量总体较低,变化趋势与总酚含量类似。主发酵期间总黄酮含量快速增长,发酵8 d时总黄酮含量最大为0.34 mg/mL,发酵8 d后呈下降趋势直至稳定。主发酵阶段总黄酮含量增加较快,与酒精含量的增加趋势基本吻合,原因是酒精有助于黄酮类化合物的溶出;后发酵阶段总黄酮含量的降低主要是因为酵母菌代谢的次级代谢产物与黄酮类物质发生反应生成大分子的衍生物,此外发酵过程中一些不稳定的类黄酮化合物会降解成分子量较小的酚单元[19-20]。

图8 发酵过程中总黄酮含量的变化趋势Fig.8 Change trends of total flavonoids contents during fermentation process
2.4 发酵过程中抗氧化性的变化情况
2.4.1 发酵过程中总抗氧化能力的变化趋势
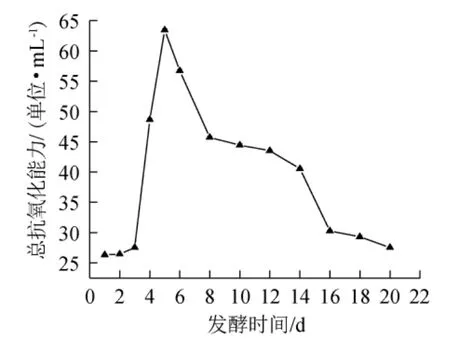
图9 发酵过程中总抗氧化能力的变化趋势Fig.9 Change trends of total antioxidant capacity during fermentation process
由图9可知,总抗氧化能力呈先增加后降低的变化趋势,总抗氧化能力与总酚、总黄酮含量的变化趋势相对应,发酵到第6天时总抗氧化能力最大为63.43单位/mL,发酵6 d后由于总酚、总黄酮等抗氧化活性成分含量的降低,总抗氧化能力也随之下降[21]。
2.4.2 发酵过程中O2-·和DPPH·清除率的变化趋势
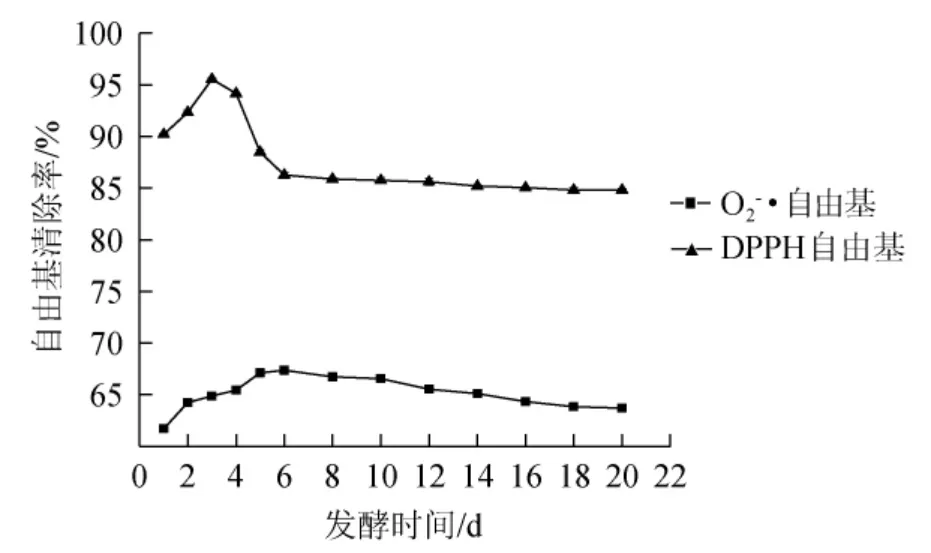
图10 发酵过程中O2-·和DPPH·清除率的变化趋势Fig.10 Change trends of O2-·and DPPH·svavenging rates during fermentation process
由图10可知,O2-·和DPPH·清除率均为先增加后降低的变化趋势,总体变化不显著(P>0.05)。随着发酵的进行抗氧化物质浸出增多,O2-·和DPPH·清除率也相应的增加,发酵第3天时DPPH·清除率最高为95.53%,第6天时O2-·清除率最高为67.36%;继续发酵后,自由基清除率开始下降。
3 结论
采用Boltzmann模型和DoseResp模型对发酵型黄精米酒在发酵过程中酵母菌生长、酒精生成和残糖消耗进行非线性拟合,同时对模型预测值和实验值进行T显著性检验,T检验结果均不显著(P>0.05),说明所选拟合方程能够很好的模拟发酵过程及描述其动力学特征;发酵过程中总酚含量、总黄酮含量、总抗氧化能力、O2-·和DPPH·清除率均呈现先增加后降低并趋于稳定的趋势,在主发酵阶段呈上升趋势,后发酵阶段呈下降趋于稳定的趋势。通过对发酵型黄精米酒动力学及抗氧化性研究,可以为后期工业生产和产品定位提供理论指导。

