酿酒酵母工程菌产青蒿酸的发酵动力学研究
陈 伟,于文文,2,陈亚军,徐 彬,滕 云
(1.浙江海正药业股份有限公司 浙江省抗真菌药物重点实验室,浙江 台州 318000;2.浙江工业大学 药学院,浙江 杭州 310000)
青蒿素是现今针对疟疾相关疾病最为有效的药物[1-2],青蒿素及其相关的系列衍生物在抗炎、预防及提高人类自身免疫等方面也具有一定的积极效果[3],因此在生物医药领域的应用前景较为广阔[4]。青蒿素可以通过三种不同的方法进行制备与获得,分别是从种植的黄花蒿中提取[5-6]、全化学合成[7-8]以及利用基因工程手段构建可产青蒿酸的微生物,通过发酵获得青蒿酸,然后再经过化学合成获得[9]。
PADDON C J等[10-14]首创了青蒿酸的微生物发酵技术,通过基因改造技术得到直接产青蒿酸的酿酒酵母(Saccharomyces cerevisiae)工程菌,并通过系列优化,不断提高青蒿酸发酵产量。王冬等[15]研究发现,青蒿酸的发酵制备存在成本偏高的问题。目前,国内的研究主要集中在通过对菌种的基因工程改造,实现青蒿酸前体-紫橞槐二烯的微生物合成,但尚未实现青蒿酸的体内合成[16-17]。于文文等[18]在摇瓶发酵的基础上,通过响应面优化确定了S.cerevisiae工程菌1211产青蒿酸较为适宜的发酵工艺并提高了青蒿酸的产量。本研究首先在50 L发酵罐中对S.cerevisiae工程菌1211发酵产青蒿酸的溶氧参数进行优化。在确定最佳溶氧水平的基础上,对S.cerevisiae工程菌1211分批发酵过程中菌体生长、青蒿酸合成以及基质消耗随发酵时间的变化规律进行分析,明确发酵过程中基质浓度变化对酿酒酵母工程菌1211代谢以及青蒿酸发酵产量的影响。在此基础上,利用Logistic方程和Luedeking-Piret方程,研究S.cerevisiae工程菌1211发酵过程变化规律,建立S.cerevisiae工程菌1211产青蒿酸分批发酵动力学模型,为发酵过程的预测和控制提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母(S.cerevisiae)工程菌1211:保存于本实验室。
1.1.2 试剂
葡萄糖(分析纯):山东西王糖业有限公司;蔗糖、琥珀酸、KH2PO4、MgSO4·7H2O、(NH4)2SO4、CuSO4·5H2O、生物素、泛酸钙、烟酸、肌醇、维生素B1、吡哆醛、对氨基苯甲酸、ZnSO4·7H2O、MnCl2·4H2O、CoCl2·6H2O、NaMoO4·2H2O、CaCl2·2H2O、FeSO4·7H2O、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
种子培养基[18]:葡萄糖19.5 g/L,KH2PO48 g/L,(NH4)2SO415 g/L,MgSO4·7H2O 6.2 g/L,维生素溶液12 mL/L,金属离子溶液10 mL/L,CuSO4·5H2O 40 μg/L,琥珀酸缓冲液(0.5 mol/L,pH 5.0)100 mL/L。
固体培养基:在种子培养基的基础上加20 g/L琼脂。
发酵培养基[18]:蔗糖91.8 g/L,KH2PO48.7 g/L,(NH4)2SO410.3 g/L,MgSO4·7H2O 6.2 g/L,维生素溶液12 mL/L,金属离子溶液10 mL/L,CuSO4·5H2O 24 mg/L。
以上培养基在121 ℃条件下灭菌25 min。
1.2 仪器与设备
15 L发酵罐和50 L发酵罐:上海国强生化工程装备有限公司;JH3102称量天平:上海精密科学仪器有限公司;ZWYR-C2112C型双层真彩触摸屏摇床:上海智城分析仪器制造有限公司;1290型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;FE20实验室pH计:梅特勒托利多仪器(上海)有限公司;M-100型生物传感器分析仪:深圳西尔曼科技有限公司;SL 40型台式离心机:美国Thermo公司。
1.3 实验方法
1.3.1 发酵罐培养方法
菌株的活化、摇瓶一级种子培养制备:参照文献[18]。
15 L种子罐中S.cerevisiae工程菌1211种子的扩大培养:装液量8 L/15 L,发酵温度30 ℃,菌种接种量10%(V/V),通气比1.0 vvm,起始搅拌转速200 r/min,发酵溶氧(dissolved oxygen,DO)≥35%,溶氧<35%时,系统自动提高搅拌转速,最高搅拌转速≤800r/min,以维持溶氧>35%,培养周期24h。
50 L发酵罐中S.cerevisiae工程菌1211的发酵培养:装液量20 L/50 L,培养温度30 ℃,菌种接种量10%(V/V),起始搅拌转速200 r/min,搅拌转速的设定范围为200~450 r/min,发酵过程中通过流加28%氨水使培养基的pH值维持在5.5,通气比1.6 vvm,发酵周期96 h。
1.3.2 溶氧对酿酒酵母工程菌1211发酵产青蒿酸的影响
S.cerevisiae工程菌1211发酵制备青蒿酸过程中,溶氧是最为关键的参数。菌体在生长代谢过程中,菌体的生长代谢和目标产物的积累很大程度上受限于菌体所在发酵罐内溶氧水平的高低。采用溶氧与转速联动,固定空气进气量,考察不同溶氧水平(10%~15%、15%~20%、20%~25%、25%~30%、30%~35%、35%~40%)对S.cerevisiae工程菌1211的生长和青蒿酸产量的影响。
1.3.3 生物量测定
OD600nm值:采用紫外分光光度计在波长600 nm处测定发酵液的吸光度值。
细胞干质量:取发酵液10mL于15mL离心管中,3000r/min离心15 min,弃去上清液,使用去离子水重复洗涤3次,最终获得的湿菌体放入80 ℃的烘箱内烘干至恒质量,称质量。
1.3.4 残糖量的测定
发酵液经3 000 r/min离心15 min,取上清液,采用高效液相色谱-蒸发光散射检测法(evaporative light scattering detection,ELSD)测定残糖(蔗糖)含量[19]。
1.3.5 青蒿酸产量的测定
样品前处理:取1 mL待测发酵液样品和9 mL甲酸甲醇溶液(甲醇溶液中加入0.5%(V/V)纯度为98%的甲酸)置于10 mL试管,充分混合均匀后,在超声温度45~50 ℃、功率200 W的条件下超声破碎30 min,取混合液1 mL,12 000 r/min高速离心5 min,取上清液经0.2 μm膜过滤获得待测样品。
青蒿酸含量:采用高效液相色谱法进行测定[18]。
1.3.6 动力学模型的建立
(1)S.cerevisiae工程菌1211生长动力学模型的建立
因S.cerevisiae工程菌1211的生长曲线为较标准的S型生长曲线,故选择Logistic方程(式(1))[20-21]拟合菌体的生长规律。

式中:dX/dt为S.cerevisiae工程菌1211生长繁殖的速度,g/(L·h);μm为S.cerevisiae工程菌1211菌体的最大比生长速率,h-1;X为S.cerevisiae工程菌1211的生物量,g/L;Xm为S.cerevisiae工程菌1211的最大生物量,g/L;t为相应的发酵时间,h。下同。
将Logistic方程通过积分处理,获得相应的代数方程,见式(2)。

式中:X0为S.cerevisiae工程菌1211的初始菌体生物量,g/L。
(2)青蒿酸合成动力学模型的建立
采用Luedeking-Piret方程[22]对菌体的生长繁殖与目标产物的积累之间的相关关系进行描述,其方程式见式(3)。

式中:dP/dt为青蒿酸发酵积累的速度,g/(L·h);P为青蒿酸发酵产量,g/L;α为生长偶联系数;β为非生偶联系数。
其中,α≠0、β=0表示为生长相关型;α≠0、β≠0表示为生长部分相关型;α=0、β≠0表示为非生长相关型。结合公式(2)和公式(3),对Luedeking-Piret方程进行积分处理,得到相应的代数方程,见式(4)。

式中:P0为青蒿酸初始产量,g/L。由于青蒿酸初始含量为0,因此P0可忽略不计。
(3)基质消耗动力学模型的建立[23-24]
碳源基质的消耗可以由类似Luedeking-Piret的式(5)来表示。
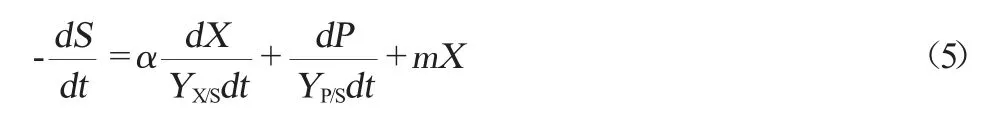
式中:dS/dt为基质(碳源)消耗的速度,g/(L·h);S为发酵培养基中碳源的质量浓度,g/L;YX/S为发酵碳源用于S.cerevisiae工程菌1211菌体生长的得率常数;YP/S为发酵碳源用于目标产物青蒿酸积累得率常数;m为S.cerevisiae工程菌1211菌体维持系数。
将式(1)、式(3)和式(5)进行积分换算得式(6)。
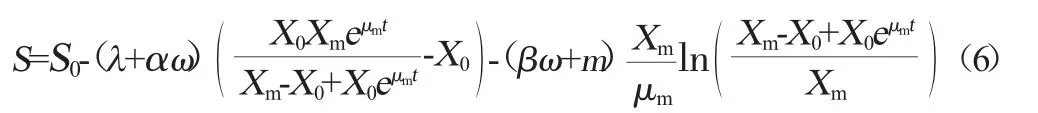
式中:S0为初始碳源质量浓度,g/L;λ=1/YX/S;ω=1/YP/S。
1.3.7 动力学模型的验证
为了检验所获得的发酵模型是否准确可靠,在发酵培养条件相同的前提下,进行3个批次的平行发酵实验,将发酵培养获得的实际实验值与通过建模得到的模型预测值进行对比。
2 结果与分析
2.1 溶氧对酿酒酵母工程菌1211发酵产青蒿酸的影响
不同溶氧水平对S.cerevisiae工程菌1211的生长和青蒿酸产量的影响见图1。
由图1a可知,在发酵前期,不同溶氧水平条件下,S.cerevisiae工程菌1211的OD600nm值差异不大;到发酵中期时,OD600nm值的差异逐渐变大;再到发酵后期,OD600nm值均趋于稳定或略有下降。溶氧越高,OD600nm值越高,S.cerevisiae工程菌1211的初级代谢越旺盛。由此可知,溶氧水平对S.cerevisiae工程菌1211的生长繁殖有着显著的影响,足够的溶氧可以明显提高S.cerevisiae工程菌1211的生物量,大量的氧气被用于菌株的繁殖生长代谢。
由图1b可知,当溶氧处于10%~15%时,S.cerevisiae工程菌1211的青蒿酸产量较低,为(3 351.2±60.4)mg/L,分析原因可能是由于S.cerevisiae工程菌1211产青蒿酸需要通过甲羟戊酸途径(mevalonate pathway,MVA),而该途径需要消耗大量的能量,此时,发酵体系中没有足够的氧气支持菌株进行呼吸作用,进而导致青蒿酸产量较低。当溶氧升高至25%~30%时,青蒿酸的发酵产量达到最高,为(6 269.6±100.3)mg/L。之后随着溶氧水平的进一步提高,青蒿酸发酵产量出现下降。分析原因可能是由于高溶氧条件下,菌株的初级代谢非常旺盛,与产青蒿酸途径在利用碳源等基质的情况下形成了竞争关系。当溶氧为35%~40%时,青蒿酸发酵产量下降至(4 154.4±124.6)mg/L。因此,选择溶氧水平25%~30%为50 L发酵罐的最适溶氧条件。

图1 不同溶氧对酿酒酵母工程菌1211生长(a)及青蒿酸产量(b)的影响Fig.1 Effect of dissolved oxygen on growth(a)and arteannuic acid yield(b)of engineered Saccharomyces cerevisiae 1211
2.2 酿酒酵母工程菌1211分批发酵产青蒿酸过程

图2 50 L发酵罐中酿酒酵母工程菌1211分批发酵过程Fig.2 Batch fermentation process of engineered Saccharomyces cerevisiae 1211 cultivated in a 50 L fermenter
由图2可知,S.cerevisiae工程菌1211生长的延滞期为0~12 h,菌体生长繁殖处于起始阶段,发酵液中碳源消耗较少;对数生长期为12~48 h,菌体生长繁殖速度较快,发酵液中碳源消耗速度大幅上升。为了实现较高的菌体生物量,以提高青蒿酸发酵产量,选择在对数中后期,即培养34 h时,加入乳糖水解液诱导S.cerevisiae工程菌1211产青蒿酸。平稳期为48~84 h,这一时期菌体的生物量以较缓慢的速率增加,青蒿酸则积累迅速。衰亡期84~96 h,在此阶段,菌体大量衰亡,此时菌体的死亡速率超过菌体的生长繁殖速率,导致菌体活细胞数呈相应的下降趋势,同时青蒿酸合成速率减慢。至发酵结束时,菌体生物量为44.12 g/L,残糖量接近于0,青蒿酸发酵产量为6.21 g/L。由此可知,在整个发酵过程中,青蒿酸的合成与S.cerevisiae工程菌1211生长变化趋势一致,说明S.cerevisiae工程菌1211的菌体生长繁殖规律与其目标产物青蒿酸积累之间呈现出生长相关型或生长部分相关型的关系。
2.3 酿酒酵母工程菌1211菌体发酵动力学模型
2.3.1 酿酒酵母工程菌1211菌体生长模型
将图2中的实验数据代入方程式(2),采用Origin 9.0进行菌体生长模型的非线性拟合,结果见图3。

图3 酿酒酵母工程菌1211干质量实验值与模型拟合结果的比较Fig.3 Comparison of experimental values and model fitting values of cell dry weight of engineered Saccharomyces cerevisiae 1211
由图3可知,菌体生长模型的相关系数R2=0.995 85,S.cerevisiae工程菌1211菌体生长动力学参数X0、Xm和μm值分别为0.85、45.81和0.12,获得菌体生长动力学方程如下:

S.cerevisiae工程菌1211的生长繁殖数据得到的动力学模型与实验值拟合较好。特别是在菌体的发酵前中期,发酵实验值与已建立的动力学模型拟合曲线较为一致,但是到了发酵末期,由于发酵罐中的青蒿酸含量逐渐升高,对菌体的生长有一定的抑制,从而使得菌体生物量相对于拟合值有所偏差。
2.3.2 酿酒酵母工程菌1211青蒿酸合成动力学模型
根据图2得到的实验数据,将S.cerevisiae工程菌1211菌体相关的生长动力学参数X0、Xm和μm值分别代入方程式(4)中,采用Origin 9.0进行非线性拟合,结果见图4。

图4 青蒿酸发酵产量实验值与模型拟合结果的比较Fig.4 Comparison of experimental values of artemisinic acid yield with calculated values by model
由图4可知,青蒿酸合成动力学模型的相关系数R2=0.979 04,得到青蒿酸合成动力学参数α=0.074、β=0.001 1,由此可知,S.cerevisiae工程菌1211菌体在50 L发酵罐中培养时,菌体生长过程中青蒿酸的积累与菌体生长繁殖为部分生长偶联型,从而获得青蒿酸积累的动力学方程如下:
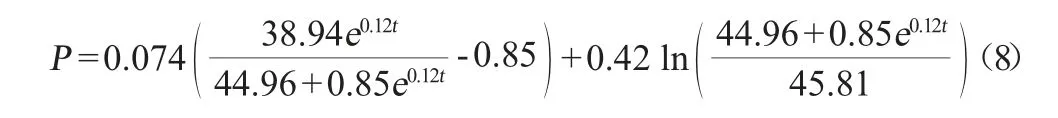
通过数据建模得到的青蒿酸合成动力学模型曲线与经过发酵培养获得的实验值之间的拟合情况较好。在发酵合成产物前期,青蒿酸合成拟合曲线与实验值几乎保持一致。但当发酵后期,菌体逐渐进入衰亡期,同时,菌体生长一定程度上也受到产物青蒿酸的抑制后,菌体产青蒿酸的能力也开始下降,发酵末期的青蒿酸发酵产量明显低于模型预测值。
2.3.3 酿酒酵母工程菌1211基质消耗动力学模型
根据图2的实验数据,将所得的参数X0、Xm、μm、α、β值分别代入方程式(6)中,采用Origin 9.0进行非线性拟合,结果见图5。
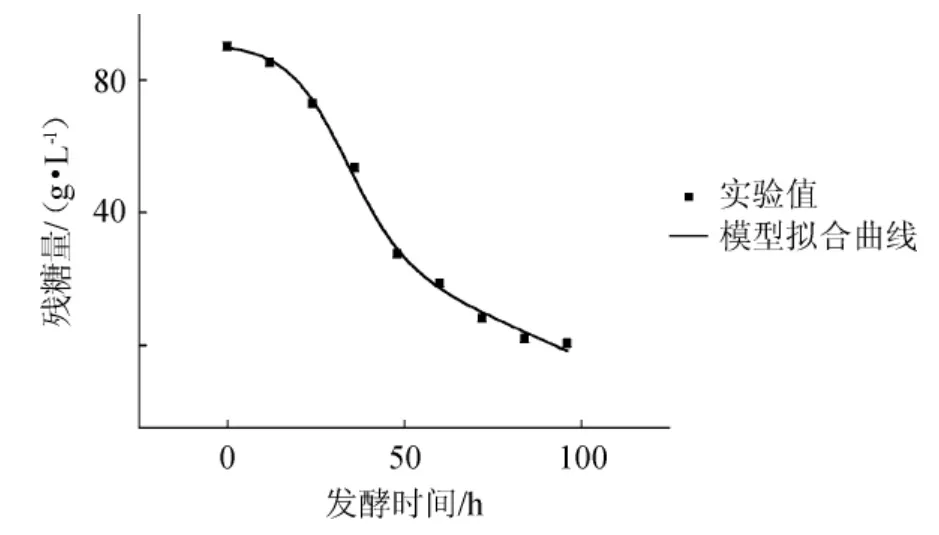
图5 蔗糖含量实验值与模型拟合结果的比较Fig.5 Comparison of experimental values and model fitting results of sucrose content
由图5可知,基质消耗动力学模型的相关系数R2=0.995 48,得到基质消耗动力学模型参数S0=90.85、m=0.007、λ=1.21、ω=2.51,由此可知,S.cerevisiae工程菌1211菌体在50 L发酵罐中培养时,基质消耗动力学方程如下:
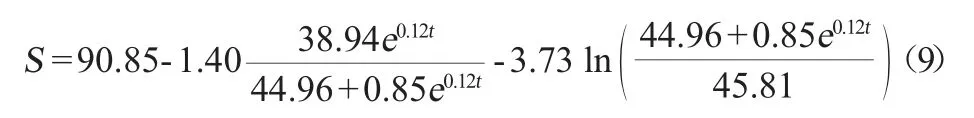
蔗糖在S.cerevisiae工程菌1211发酵过程中被消耗的动态变化可以很好的由基质消耗动力学模型曲线进行描述。基质的实际消耗与模型拟合稍有偏差仅发生在菌体的生长末期,蔗糖消耗速率未达到拟合曲线速率,可能与菌体生长代谢变慢、受到产物抑制以及产青蒿酸能力下降有关。
2.4 动力学模型的验证
由表1可知,除了发酵末期实验值与理论值差距较大,其他实验点的平均值与模型预测值两者之间的误差大部分都是在±10%以下。因此,S.cerevisiae工程菌1211发酵产青蒿酸的过程能够用以上发酵动力学模型来描述。
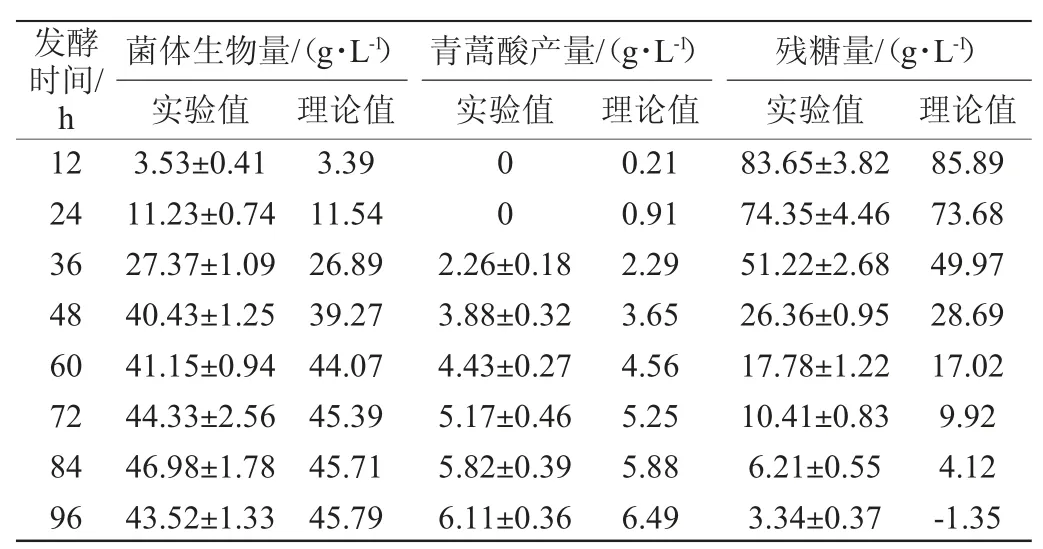
表1 模型理论值与试验值的比较Table 1 Comparison of theoretical value calculated by modelsand experimentalvalue
3 结论
S.cerevisiae工程菌1211在50 L发酵罐中的最佳发酵溶氧参数为25%~30%,在此条件下青蒿酸发酵产量达到(6 269.6±100.3)mg/L,与摇瓶产量相比提升了309.9%[18]。根据Logistic方程和Luedeking-Piret方程,借助Origin 9.0软件,发现S.cerevisiae工程菌1211青蒿酸的合成和菌体的生长呈现出部分生长偶联关系,建立了S.cerevisiae工程菌1211分批发酵高产青蒿酸的动力学模型,S.cerevisiae工程菌1211的菌体繁殖生长、青蒿酸合成以及基质消耗模型拟合度R2分别达到0.995 85、0.979 04和0.995 48,较好的反映了S.cerevisiae工程菌1211发酵过程中菌体生物量、青蒿酸合成和基质消耗随发酵时间的变化规律,该研究为S.cerevisiae工程菌1211产青蒿酸的发酵工艺后续改进、发酵过程的放大与控制提供了一定的理论基础。

