白藜芦醇通过c-fos通路对AMI大鼠心肌损伤标志物含量的影响
李成军,董梅,任法新
心肌细胞凋亡在急性心肌梗死(AMI)心肌损伤的病理演变过程中占有重要地位,有效抑制急性心肌缺血后的心肌细胞凋亡是治疗的主要策略[1]。抑制心肌细胞凋亡还可缓解心肌损伤、促进心脏功能恢复,利于患者的长期预后。伤害性信息与即刻早期基因(immediate early gene,c-fos)蛋白在受到外界刺激后会发生过表达,并通过与JUN/AP-1转录因子形成紧密但非共价连接的复合物调节转录,研究显示在AMI后c-fos水平显著升高,与心肌损伤有关[2]。白藜芦醇(RSV)从葡萄皮/种子、虎杖根等中药中提取出一种多酚类化合物,具有强大的抗氧化作用,RSV具有保护大鼠心血管功能的作用[3]。本文主要分析RSV通过c-fos通路对AMI大鼠心肌损伤的影响。
1 材料与方法
1.1 试验动物、试剂和材料SPF级的SD大鼠(雄性,220~250 g,南京金陵医院)。苏木精-伊红(HE)染色试剂盒、酶联免疫吸附(ELISA)试剂盒、TUNEL凋亡试剂盒(碧云天公司,中国)。酶标仪(Model 680,Bio-Rad,美国)。RIPA裂解缓冲液(Beyotime,北京)。BCA蛋白测定试剂盒(北京Applygen公司)。ECL试剂盒(Amersham,美国)。抗体(Abcam公司,美国)。PVDF膜(Bio-Rad公司,美国)。小动物超声成像仪(麟得科学仪器有限公司,中国)。BX-42光学显微镜(Olympus Corporation,日本)。
1.2 动物分组、建模和干预48只SD大鼠随机分为3组(n=16):Sham组、AMI组和AMI+RSV组。AMI组和AMI+RSV组大鼠根据参考文献方法[4]建立AMI模型,建模方法:大鼠腹腔注射1%戊巴比妥(剂量为3 ml/kg)麻醉后,连接心电图,常规剪开胸腔暴露心脏,使用6/0线在左心耳下约2 mm处的冠状动脉(冠脉)前降支结扎,结扎成功后大鼠心电图显示QRS波增宽,结扎30 min后取出丝线再灌注,缝合胸腔,术后护理包括注射80 000单位青霉素抗感染2/d,连续3 d。Sham组打开胸腔但不结扎,缝合胸腔后注射青霉素。建模后AMI+RSV组大鼠使用RSV灌胃干预,剂量为10 mg·kg/d,1/d,连续7 d,第8 d行后续检测。以灌胃等剂量生理盐水作为对照。
1.3 观察指标及方法
1.3.1 大鼠心功能指标检测通过腹腔注射1%戊巴比妥(剂量为3 ml/kg),连接超声成像仪行心脏超声,根据仪器说明书检测左室射血分数(LVEF)及左室内压力最大变化率(±dp/dtmax)。
1.3.2 心肌损伤标志物大鼠麻醉后处死,将血样2000 rpm下离心20 min取上清液,使用ELISA试剂盒检测肌酸激酶(CK-MB)和乳酸脱氢酶(LDH),加入抗体后通过酶标仪检测吸光度,根据标准曲线计算CK-MB和LDH浓度。
1.3.3 HE染色将心肌组织经过梯度酒精脱水、透明处理后包埋至蜡块中,冷冻后切成4 μm厚切片。将组织脱蜡并水化,用3%过氧化氢甲醇溶液封闭内源性过氧化物酶活性。使用蒸锅在95℃下于0.01 M柠檬酸盐缓冲液(PH=6.0)中对切片进行热诱导的抗原回收。通过HE染色试剂盒加入苏木紫和伊红染料染色观察心肌组织病变情况。
1.3.4 TUNEL染色通过TUNEL凋亡试剂盒检测心肌细胞凋亡率。将心脏固定后切片,加入试剂。显微镜下观察凋亡情况,凋亡率=(绿色荧光阳性细胞/视野中总细胞×100%)。
1.3.5 Western blot通过Western blot检测心肌组织中p-ERK、ERK和c-fos蛋白水平,将组织在液氮下研磨后通过RIPA试剂裂解,应用BCA法测量总蛋白含量。通过SDS-PAGE分离等量的总蛋白(120 V下电泳90 min),转移到PVDF膜上(50 V,120 min),在5%脱脂牛奶的封闭溶液中封闭。将PDVF膜与anti-p-ERK、anti-ERK和anti-c-fos(1:500稀释),4℃孵育过夜,加入1:5000稀释的HRP偶联二抗在室温下孵育1 h。使用ECL试剂盒可视化蛋白条带,GAPDH作为内参,使用ImagePD软件对蛋白条带的灰度进行定量。
1.4 统计学处理所有实验设立3个复孔。数据以平均值±标准偏差(SD)表示。统计分析使用SPSS 19.0软件,进行单因素方差分析,两两比较使用SNK-q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠LVEF和±dp/dtmax水平比较AMI组大鼠LVEF、±dp/dtmax水平显著低于Sham组(P<0.05),AMI+RSV组LVEF、±dp/dtmax水平显著高于AMI组(P<0.05)(表1)。
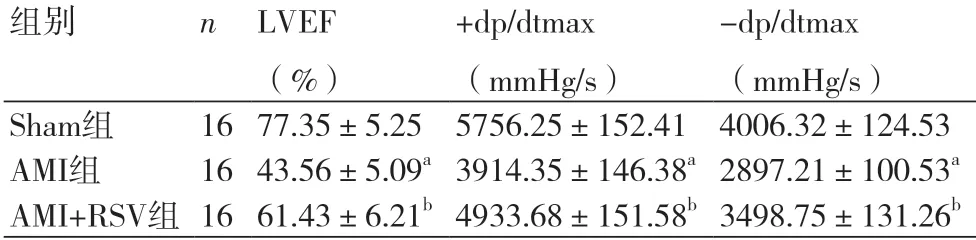
表1 各组大鼠LVEF和±dp/dtmax比较
2.2 各组大鼠心肌损伤标志物水平比较AMI组CKMB(107.54±13.62 kU/L)和LDH(131.28±18.64 kU/L)水平显著高于Sham组(33.68±5.41 U/L,67.46±9.04 kU/L)(P<0.05)。AMI+RSV组CKMB(74.22±10.38 kU/L)和LDH(98.76±15.93 kU/L)显著低于AMI组(P<0.05)(表2)。
2.3 心肌HE染色结果Sham组心肌细胞形态正常、排解紧密。AMI组心肌细胞形状发生改变,出现炎性浸润和细胞丢失。AMI+RSV组心肌细胞形态和排列恢复,细胞丢失显著减少(图1)。
2.4 各组心肌细胞凋亡情况比较如图2所示,蓝色为细胞核染色,棕色染色为凋亡细胞,AMI组的凋亡率(38.75%±4.36%)显著高于Sham组(4.54%±0.58%)(P<0.05),AMI+RSV组心肌细胞凋亡率(19.67%±4.18%)显著低于AMI组(P<0.05)。

表2 各组CK-MB和LDH水平比较(kU/L)
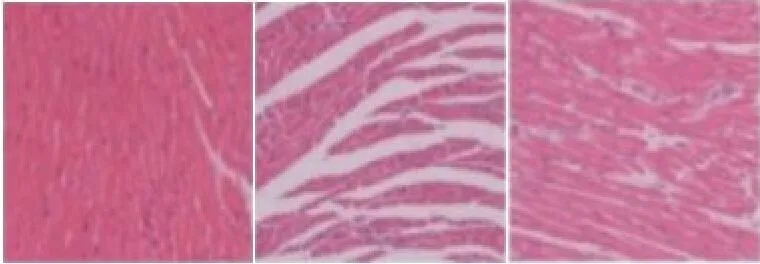
图1 HE染色检测心肌组织损伤情况(×200)
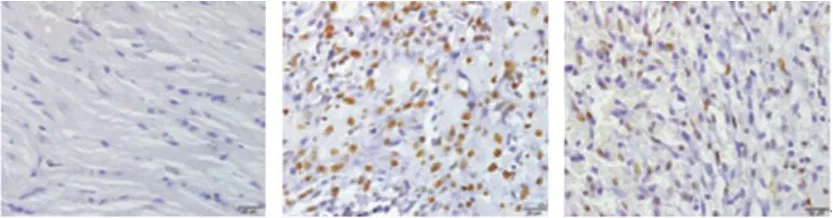
图2 TUNEL染色检测心肌细胞凋亡情况(×200)
2.5 各组c-fos通路水平比较与Sham组比较,AMI组p-ERK/ERK和c-fos蛋白水平显著升高(P<0.05),AMI+RSV组p-ERK/ERK和c-fos蛋白水平显著低于AMI组(P<0.05)(表3、图3)。

表3 各组p-ERK/ERK和c-fos蛋白水平比较
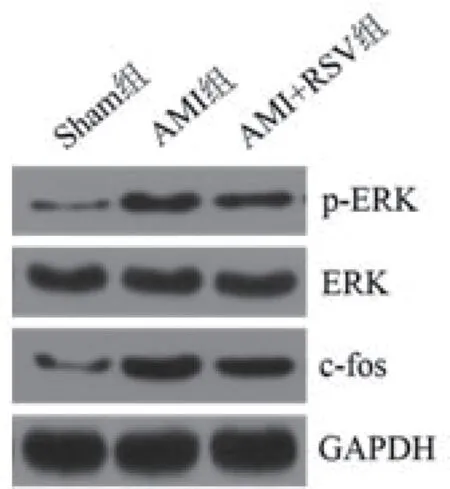
图3 Western blot检测p-ERK/ERK和c-fos蛋白水平
3 讨论
AMI会引起氧化应激反应,导致活性氧的产生增加以及有害细胞信号的激活,促进内皮细胞中促炎细胞因子和趋化因子的表达,导致炎症细胞向梗塞区域浸润,引起心肌细胞损伤[5],中药在AMI治疗中取得了一定进展。RSV主要从毛叶藜芦根和葡萄叶中分离得到,是一种非黄酮类多酚化合物,具有抗血小板、抗氧化应激、抗凋亡和抗炎作用。近年来研究发现RSV具有保护心肌细胞改善心脏功能的作用[6]。本研究发现使用RSV干预的大鼠细胞形态和排列恢复,血清中CK-MB、LDH水平和心功能指标均显著改善。说明RSV可保护心肌细胞损伤,改善AMI后大鼠心功能。最近研究发现RSV可促进AMI大鼠心脏神经重塑,改善心功能[7]。且通过调节心肌缝隙连接蛋白43改善AMI后心律失常[8]。Cheng等[9]发现RSV可通过调节Nrf2 / ARE途径减轻心肌缺血再灌注损伤所致的炎症和氧化应激,这些均提示RSV具有缓解AMI后心肌损伤和保护心功能的作用,但具体机制仍需进一步研究。
在急性缺血阶段,心肌细胞死亡是心功能损伤和丢失的重要原因,并且是梗死面积的主要决定因素[10,11]。抑制心肌梗死后心肌细胞凋亡是缓解心肌损伤和保护心功能的重要方法[12]。本研究结果显示在AMI建模7 d后,心肌细胞凋亡显著增多,而RSV可缓解心肌细胞的凋亡。心肌细胞凋亡受到多种通路的调节,在AMI后,ERK/c-fos的激活会引起炎性反应,损伤心肌细胞;同时炎性反应进一步引起心肌细胞凋亡,加重心功能损伤[13]。而抑制c-fos相关通路会缓解凋亡[14]。本结果显示AMI大鼠心肌细胞凋亡水平及p-ERK/ERK和c-f蛋白水平均显著升高,而使用RSV干预后明显减少凋亡并抑制c-fos相关通路。Lu等[15]研究发现RSV具有抑制凋亡缓解氧化应激损伤的作用。此外,也有研究显示RSV具有抑制ERK/c-fos通路的作用[16]。Thiel等[17]研究结果显示RSV通过调节ERK通路调控c-fos表达。提示RSV可通过调节c-fos相关通路抑制凋亡。
综上所述,RSV通过调节c-fos通路抑制AMI模型大鼠的心肌细胞凋亡,缓解心肌细胞损伤并发挥保护AMI后心功能的作用。关于RSV调节c-fos通路和调控心肌细胞凋亡的相关机制需进一步研究。

