过表达番茄LeDnaJ基因提高陆地棉(Gossypium hirsutum Linn.) R15的耐盐性
闻甜 陈祥龙 武晓刚 权永刚 徐鹏 郭琪 倪万潮 陈爱民

摘要:DnaJ蛋白不仅在生物体应对热激胁迫方面起作用,而且能响应盐、重金属和氧化等多种胁迫,因此,DnaJ蛋白的相关研究对植物抗逆研究具有重要意义。在前期的研究中,笔者所在课题组已经利用电子克隆及逆转录-聚合酶链式反应(RT-PCR)的方法从番茄中克隆了全长为465 bp的热激蛋白基因LeDnaJ。为了进一步验证其功能,针对LeDnaJ基因构建了含有35S启动子及NOS终止子的植物表达载体,通过农杆菌介导法转化到陆地棉(Gossypium hirsutum Linn.)品系R15中。目的基因的PCR检测结果表明,LeDnaJ基因已经整合到陆地棉R15基因组中;耐盐性鉴定结果表明,LeDnaJ基因的表达,提高了陆地棉R15萌发期、苗期的耐盐性。该研究结果为棉花耐盐性的改良提供了新的基因资源。
关键词:陆地棉;LeDnaJ基因;过表达;耐盐性
中图分类号:S332.6文献标识码:A文章编号:1000-4440(2020)02-0271-06
Abstract:DnaJ protein not only plays a role in the response of organisms to heat shock stress, but also responds to various stresses such as salt, heavy metals and oxidation, so the related researches are of great significance to stress resistance investigations in plants. The heat shock protein gene LeDnaJ with a whole length of 465 bp was cloned from tomato by the methods of electronic cloning and reverse transcription-polymerase chain reaction (RT-PCR) in the previous studies. In order to verify the functions of LeDnaJ gene, the plant expression vector containing LeDnaJ gene with NOS terminator and 35S promoter was constructed and transformed into Gossypium hirsutum Linn. R15 by Agrobacterium-mediated method. The PCR detection result of the target gene showed that the LeDnaJ gene had been integrated into the cotton genome. The results of salt tolerance identification indicated that the expression of LeDnaJ gene improved the salt tolerance of Gossypium hirsutum Linn. R15 at germination and seedling stages. These results provide new genetic resources for the improvement of salt tolerance in cotton.
Key words:Gossypium hirsutum Linn.;LeDnaJ gene;overexpression;salt tolerance
DnaJ蛋白是首次从大肠杆菌中分离出来的一种41 000大小的热激蛋白(Heat shock protein, HSP),又名HSP40[1]。热激蛋白是植物为了适应不断变化的逆境胁迫而诱导自身产生的一种具有抵御作用蛋白质。作为HSP70蛋白的辅助伴侣蛋白,DnaJ蛋白由腺嘌呤核苷三磷酸(ATP)为HSP70蛋白供能,并引导蛋白质的正确组装和折叠。HSP70蛋白本身并不直接参与新生多肽底物的结合,其功能的行使必须依赖能与其特异性结合的DnaJ蛋白。DnaJ蛋白结构复杂,在通常情况下含有3个保守的结构域,分别是位于N端的核心结构为组氨酸/脯氨酸/天冬氨酸三肽的J结构域、富含甘氨酸(G)和苯丙氨酸(F)的G/F结构域和含有4个Cys-X-X-Cys-X-Gly-X-Gly(Cys为半胱氨酸,Gly为甘氨酸,X为任意氨基酸)基序的锌指结构域[2]。根据结构域的种类,DnaJ蛋白家族成员可以分为以下3类:第1类,同时含有J结构域、G/F结构域及锌指结构域;第2类,含有J结构域及G/F结构域或锌指结构域中的1个;第3类,只含有J结构域[3]。以上3类蛋白家族成员都具有与HSP70蛋白直接作用的J结构域。
DnaJ蛋白在响应许多生物及非生物胁迫的过程中起着重要作用。植物中的DnaJ可以响应很多诱导因素,如重金属、高温、冷害、干旱、盐碱及病原菌等。另外,DnaJ蛋白基因的表达有组织特异性,并受生物发育阶段的调节。尽管目前人们已经从拟南芥[4]、报春花[5]、苜蓿[6]等植物中获得了DnaJ蛋白,但是关于植物中DnaJ蛋白的研究仍远远滞后于人类、动物及细菌中DnaJ蛋白的相关研究。在前期的研究中,笔者电子克隆了番茄LeDnaJ基因的全长。为了进一步验证其功能,笔者构建了含有35S启动子及NOS终止子的植物表达载体,通过农杆菌介导法将LeDnaJ基因转化到陆地棉(Gossypium hirsutum Linn.)品系R15中,经过目的基因的PCR检测,获得阳性转LeDnaJ基因棉花株系,进一步分析该基因在盐胁迫下的功能,從而为棉花耐盐性的改良提供新的基因资源。
1材料与方法
1.1材料与试剂
本研究的供试番茄材料为Moneymaker,由江苏省农业科学院蔬菜研究所提供;转基因棉花受体材料为陆地棉R15,是由晋棉7号多代再生选育出的胚胎发生纯合系,由山西省农业科学院棉花研究所提供。采用天根生化科技(北京)有限公司的试剂盒提取番茄总RNA,再用DNA酶去除其中的gDNA,然后用M-MLV(莫洛尼鼠白血病病毒)反转录酶反转录合成cDNA第一链。
1.2植物表达载体的构建
在LeDnaJ基因的上、下游设计1对带有BamH Ⅰ、Kpn Ⅰ 酶切位点的特异引物(LeDnaJ-F-BamH Ⅰ:5′-CGGGATCCATGGCTTCTTCTTCTTTTCTTCTCTC-3′;LeDnaJ-R-Kpn Ⅰ:5′-GGGGTACCCTACCAACACTGATCGGTTTCCCATC-3′,引物中的下划线表示酶切位点),将逆转录-聚合酶链式反应(RT-PCR)产物连接到经BamH Ⅰ、Kpn Ⅰ 双酶切处理的pCAMBIA2301载体上,构建pCAMBIA2301-CaMV35S-LeDnaJ植物表达载体。用热激法将PCR和酶切鉴定验证正确的重组质粒转入农杆菌菌株EHA105感受态细胞中,获得工程农杆菌EHA105用于下一步的遗传转化。
1.3农杆菌介导的棉花遗传转化及阳性植株的鉴定
通过农杆菌介导的遗传转化方法[7]将pCAMBIA2301-CaMV35S-LeDnaJ转化到受体棉花R15中。用特异性引物LeDnaJ-F和LeDnaJ-R进行PCR扩增,以筛选阳性植株。进一步提取PCR检测结果呈阳性植株的RNA,以反转录生成的cDNA为模板,以LeDnaJ-RT-F(5′-CTCTACAATCGCCTCACATACA-3′)、LeDnaJ-RT-R(5′-TTCCCATCCTCGGCGAACAGTA-3′)为引物进行RT-PCR扩增,分析目的基因的表达水平。
1.4萌发期和苗期棉花耐盐性表型的鉴定
先用体积分数为30%的H2O2对棉花种子消毒2~3 h,再用ddH2O清洗3~5次。萌发期发芽率的测定方法:将棉花种子置于含有200 mmol/L NaCl的玻璃培养皿中,重复3次,每个重复设50粒种子,以蒸馏水处理作为空白对照(CK),将玻璃培养皿置于温度为(30±1) ℃、相对湿度为80%±2%的无光照环境中进行催芽,以种子露白部分超过5 mm视为种子发芽,7 d后统计种子的发芽数量。计算公式:种子萌发率=露白部分超过5 mm的种子数/种子总数×100%。萌发期根长的测定:将棉花种子置于含有200 mmol/L NaCl的固体MS培养基上进行培养,每个材料设3个重复,每个重复设50粒种子,种子发芽(露白部分>5 mm)后,测量种子的根系长度(cm)。
将预先发芽的转基因株系及其对照R15种子播于一次性纸杯中,置于温度为28 ℃、光照时间为16 h/d的房间内进行培养。待植株长至2叶1心期时开始进行盐处理,分别用350 mmol/L NaCl和清水各处理10株幼苗,同时,另取生长一致的10株幼苗,测量处理前植株的株高、地上部鲜质量和地上部干质量等。处理30 d后分别测定350 mmol/L NaCl和清水处理植株的株高、地上部鲜质量、地上部干质量等。分别计算盐胁迫、清水处理植株培养30 d的生长量,以植株在清水中的生长量作为对照,计算植株在盐胁迫下的相对生长量,评价其耐盐性。
1.5数据分析方法
用t检验测试组间平均值的差异,分析转基因材料与非转基因对照之间的表型是否存在差异。
2结果与分析
2.1LeDnaJ基因序列分析
在前期的研究中,筆者电子克隆了番茄的LeDnaJ基因,该基因序列全长465 bp,GenBank登录号为EF208898.1。利用DNAStar等软件分析得出,该基因编码的蛋白质含有155个氨基酸,相对分子质量为17 030,理论等电点为10.49。通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.Cgi)对蛋白质保守结构域进行分析,结果表明,LeDnaJ基因编码的蛋白质仅在N端含有1个高度保守的长约70个氨基酸的J-结构域,属于仅含有1个J结构域的第3类DnaJ-like蛋白家族成员。
2.2转LeDnaJ基因棉花的鉴定结果
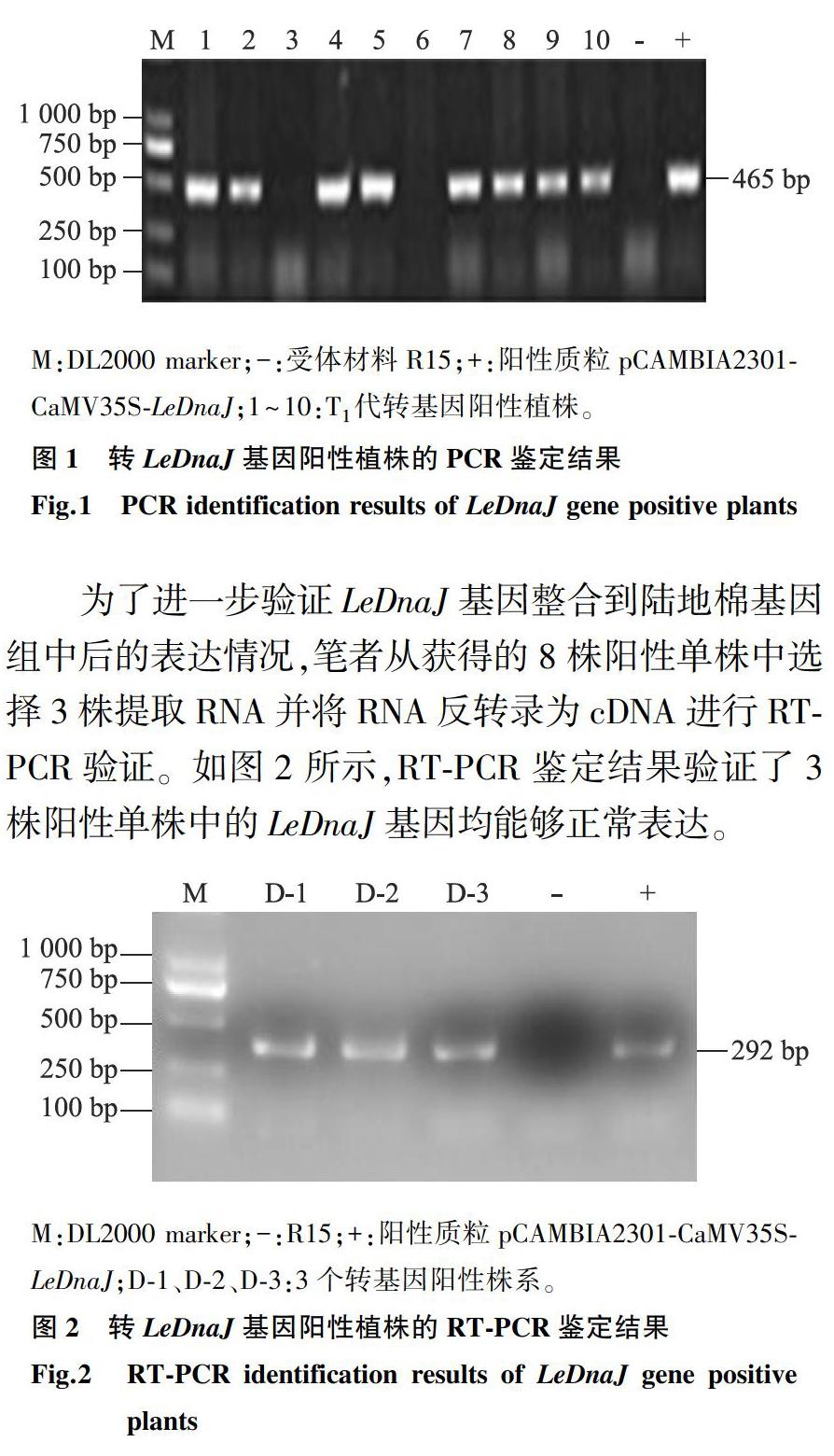
分别用KpnⅠ、BamHⅠ对LeDnaJ目的片段和载体质粒pCAMBIA2301-CaMV35S进行双酶切,然后连接、转化,用引物LeDnaJ-F、LeDnaJ-R对转化后得到的重组质粒pCAMBIA2301-CaMV35S-LeDnaJ进行PCR扩增,得到465 bp大小的片段,与预期大小一致。经酶切鉴定及测序验证正确后,筛选出构建成功的植物表达载体pCAMBIA2301-CaMV35S-LeDnaJ。通过农杆菌介导的遗传转化方法,将pCAMBIA2301-CaMV35S-LeDnaJ转化到受体棉花材料R15中,经过植物组织培养,得到T0代植株。将T0代转基因种子通过种植进行加代,提取T1代植株叶片的DNA,并进行PCR检测,获得8株pCAMBIA2301-CaMV35S-LeDnaJ阳性单株(图1)。
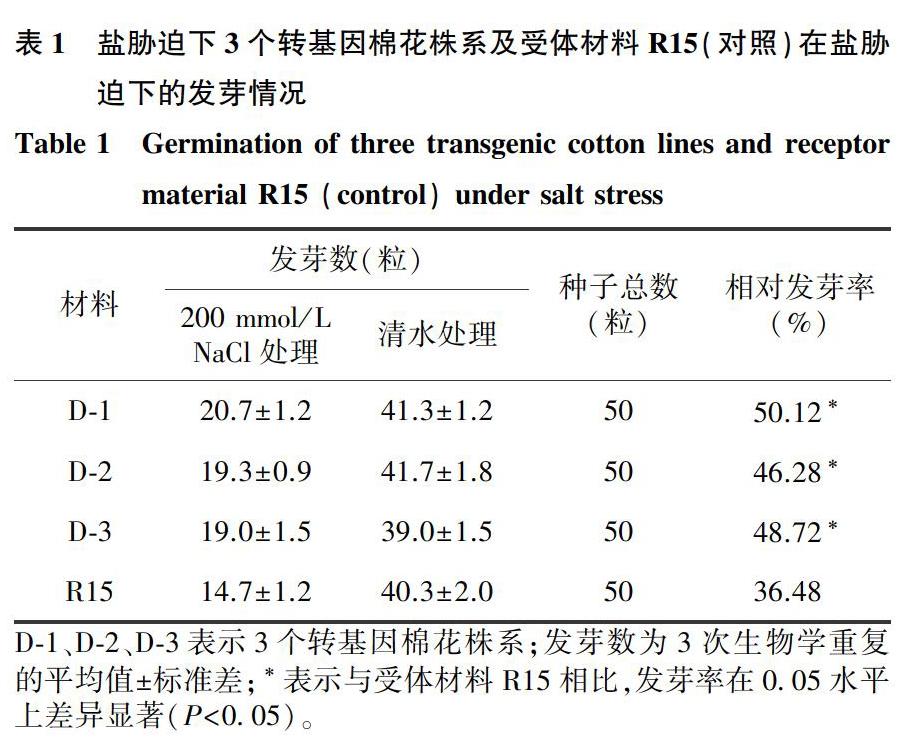
为了进一步验证LeDnaJ基因整合到陆地棉基因组中后的表达情况,笔者从获得的8株阳性单株中选择3株提取RNA并将RNA反转录为cDNA进行RT-PCR验证。如图2所示,RT-PCR鉴定结果验证了3株阳性单株中的LeDnaJ基因均能够正常表达。
2.3转LeDnaJ基因棉花株系萌发期的耐盐性
在前期进行同源比对后发现,LeDnaJ基因与AT2G17880基因同源,后者编码DNA J protein C24。Sottosanto等研究发现,AT2G17880基因受到盐胁迫的诱导[8]。因此,本研究从表型上对转LeDnaJ基因棉花株系后代在萌发期、苗期的耐盐性进行鉴定。经过连续自交,获得3个T5代转LeDnaJ基因棉花纯系后代,分别挑选3个转LeDnaJ基因棉花株系、受体材料R15(对照)50粒饱满的种子用于萌发期发芽率的测定。在第7 d统计棉花种子的发芽数量,从表1可以看出,盐胁迫下3个转基因棉花株系的相对发芽率均显著高于对照,因此认为,LeDnaJ基因的表达提高了棉花R15种子在盐胁迫下的发芽率。
本研究同时测量了3个转基因棉花株系及其受体材料R15(对照)在盐胁迫下萌发期的根长。由图3可见,在含有200 mmol/L NaCl的MS培养基上催芽3 d后,对照的根系伸长受到了明显抑制,而3个转基因棉花株系的根系伸长相对正常,均明显高于对照。将盐胁迫下的棉花根长与清水处理的棉花根长的比值作为相对根长,由表2可知,D-1、D-2、D-3这3个转基因株系的相对根长均极显著高于对照,说明LeDnaJ基因的表达提高了陆地棉R15萌发期的耐盐性。
2.4转LeDnaJ基因棉花株系苗期的耐盐性
待3个转LeDnaJ基因棉花植株长至2叶1心期时,分别用350 mmol/L NaCl和清水处理植株,30 d后测定盐胁迫、清水处理植株的相关表型指标,从而鉴定转基因棉花株系苗期的耐盐性。由图4可见,处理30 d后盐胁迫下转基因棉花株系的株高明显高于其受体材料R15(对照)。表3显示,3个转基因棉花株系的相对株高、地上部分相对鲜质量和地上部分相对干质量均显著或极显著高于受体材料R15(对照),表明LeDnaJ基因的表达提高了陆地棉R15苗期的耐盐性。
3讨论
近期的研究发现,DnaJ蛋白作为一种广泛存在于植物细胞内的分子伴侣参与了多种植物抵抗非生物胁迫的过程。张大栋等[9]通过抑制消减杂交方法,从盐生植物海蓬子中克隆了DnaJ-like基因,Northern杂交结果显示,在200 mmol/L NaCl胁迫下,该基因的表达量显著增多。赵志常等[10]通过RT-PCR技术从野生型拟南芥中克隆了DnaJ基因,并构建了含有目的基因的pET32a原核表达载体,在细菌中过量表达DnaJ基因后发现,其在含有0.5 mol/L NaCl的培养基中仍然可以正常生长,推测DnaJ基因的过表达提高了细菌的耐盐性。拟南芥中的BIL2基因是定位在线粒体上的DnaJ基因家族成员[11],过表达BIL2基因能增强拟南芥植株对盐和强光胁迫的耐受性[12]。Fu等[13]研究发现,ER-sHSP基因能够提高番茄的耐盐能力,在盐胁迫下,转ER-sHSP番茄植株通过更粗壮的根来维持其体内相对较高的含水量,同时也能够吸收少量的Na+,积累更多的渗透物质和Ca2+,以减少盐胁迫对光系统的伤害。Sun等[14]研究发现,AsHSP17能够被高温、盐胁迫或脱落酸(ABA)处理所诱导。过表达AsHSP17基因会提高匍匐剪股颖(Agrostis stolonifera)对外源脱落酸和盐的超敏性,在这一过程中AsHSP17蛋白作为分子伴侣负调控光合作用和脱落酸依赖/独立的信号通路,提高了匍匐剪股颖对不良环境的抗性。
本研究从番茄中克隆了热激蛋白基因LeDnaJ,并通过转基因棉花株系验证了其耐盐功能,发现LeDnaJ基因显著提高了陆地棉的耐盐性。目前,关于陆地棉中已克隆的热激蛋白基因的研究仍然较少。Kosmas等[15]从陆地棉中克隆了HSPCB基因,RT-PCR结果显示,该基因的表达受到干旱胁迫的诱导。Maqbool等[16]从受干旱胁迫的亚洲棉中克隆了GHSP26基因,發现在干旱胁迫后的亚洲棉脱水叶片组织中GHSP26基因显著表达,过量表达GHSP26基因提高了陆地棉对干旱和热胁迫的耐受性[17-18]。此外,Wang等[19]应用表达序列标签(Expressed sequence tag,EST)组装法和全基因组鉴定技术克隆了40个GhHsf基因,对植物不同发育阶段、不同组织中基因表达谱的分析结果表明,GhHsfs基因在棉花响应非生物胁迫耐受性和纤维发育等方面发挥重要作用。近年来,越来越多的非生物胁迫严重影响棉花的生长发育过程,导致其产量减少和纤维品质下降。其中盐害和干旱对于棉花产量潜力发挥的影响最严重。DnaJ蛋白家族成员作为胁迫响应因子将在棉花抵御干旱和盐害胁迫中扮演重要的角色,进一步加强棉花DnaJ蛋白家族成员的研究将为棉花抗旱、抗盐碱的遗传改良提供更丰富的基因资源。
鉴于在响应逆境胁迫过程中的保护性角色,DnaJ蛋白在多种作物中已经受到广泛的关注。通过分子遗传学手段已经证实了DnaJ蛋白在多种逆境胁迫下起调节作用,并且在多种植物中过表达DnaJ基因可以改良植物抵抗逆境胁迫的能力。植物在面临逆境胁迫时,能够激活并表达DnaJ蛋白,保护正常蛋白质不被降解以维持植物自身正常的生长发育。然而,DnaJ蛋白如何抵抗逆境胁迫以发挥保护作用的具体机制还未被解析。因此,进一步加深DnaJ蛋白与其他蛋白质之间互作的研究将有助于解析其抵抗逆境胁迫的分子机制,从而为植物的抗逆育种提供依据。
参考文献:
[1]GEORGOPOULOS C P, LAM B, LUNDQUIST-HEIL A, et al. Identification of the E. coli dnaK (groPC756) gene product[J]. Molecular and General Genetics, 1979, 172(2): 143-149.
[2]KELLEY W L. The J-domain family and the recruitment of chaperone power[J]. Trends in Biochemical Sciences, 1998, 23(6): 222-227.
[3]MIERNYK J A. The J-domain proteins of Arabidopsis thaliana: an unexpectedly large and diverse family of chaperones[J]. Cell Stress & Chaperones, 2001, 6(3): 209-218.
[4]SO H A, CHUNG E, LEE J H. Arabidopsis atDjC53 encoding a type Ⅲ J-protein plays a negative role in heat shock tolerance[J]. Genes & Genomics, 2014, 36(6): 733-744.
[5]ZHANG L, GAO Y K, PAN H T, et al. Cloning and characterization of a Primula heat shock protein gene, PfHSP17.1, which confers heat, salt and drought tolerance in transgenic Arabidopsis thaliana[J]. Acta Physiologiae Plantarum, 2013, 35(11): 3191-3200.
[6]LI Z Y, LONG R C, ZHANG T J, et al. Molecular cloning and functional analysis of the drought tolerance gene MsHSP70 from alfalfa (Medicago sativa L.)[J]. Journal of Plant Research, 2017, 130(2): 387-396.
[7]WU S J, WANG H H, LI F F, et al. Enhanced Agrobacterium-mediated transformation of embryogenic calli of upland cotton via efficient selection and timely subculture of somatic embryos[J]. Plant Molecular Biology Reporter, 2008, 26(3): 174-185.
[8]SOTTOSANTO J B, GELLI A, BLUMWALD E. DNA array analyses of Arabidopsis thaliana lacking a vacuolar Na+/H+ antiporter: impact of AtNHX1 on gene expression[J]. The Plant Journal, 2004, 40(5): 752-771.
[9]张大栋,周春霖,任丽娟,等. 海蓬子DnaJ-like基因片段的表达和生物信息学分析[J]. 江苏农业学报, 2006, 22(3): 222-224.
[10]赵志常,张建军,张皖蓉,等. 拟南芥DnaJ蛋白的过量表达对细菌耐盐性的影响[J]. 广西师范大学学报(自然科学版), 2010, 28(1): 54-57.
[11]RAJAN V B V, D′SILVA P. Arabidopsis thaliana J-class heat shock proteins: cellular stress sensors[J]. Functional & Integrative Genomics, 2009, 9(4): 433-446.
[12]BEKH-OCHIR D, SHIMADA S, YAMAGAMI A, et al. A novel mitochondrial DnaJ/Hsp40 family protein BIL2 promotes plant growth and resistance against environmental stress in brassinosteroid signaling[J]. Planta, 2013, 237(6): 1509-1525.
[13]FU C, LIU X X, YANG W W, et al. Enhanced salt tolerance in tomato plants constitutively expressing heat-shock protein in the endoplasmic reticulum[J]. Genetics and Molecular Research, 2016, 15(2): 15028301.
[14]SUN X B, SUN C Y, LI Z G, et al. AsHSP17, a creeping bentgrass small heat shock protein modulates plant photosynthesis and ABA-dependent and independent signaling to attenuate plant response to abiotic stress[J]. Plant Cell and Environment, 2016, 39 (6): 1320-1337.
[15]KOSMAS S A, ARGYROKASTRITIS A, LOUKAS M, et al. Isolation and characterization of stress related heat shock protein calmodulin binding gene from cultivated cotton (Gossypium hirsutum L.)[J]. Euphytica, 2006, 147(3): 343-351.
[16]MAQBOOL A, ZAHUR M, IRFAN M, et al. Identification, characterization and expression of drought related alpha-crystalline heat shock protein gene (GHSP26) from desi cotton[J]. Crop Science, 2007, 47(6): 2437-2444.
[17]MAQBOOL A, ABBAS W, RAO A Q, et al. Gossypium arboretum GHSP26 enhances drought tolerance in Gossypium hirsutum[J]. Biotechnology Progress, 2010, 26(1): 21-25.
[18]ZAHUR M, MAQBOOL A, IFRAN M, et al. Functional analysis of cotton small heat shock protein promoter region in response to abiotic stresses in tobacco using agrobacterium-mediated transient assay[J]. Molecular Biology Reports, 2009, 36(7): 1915-1921.
[19]WANG J, SUN N, DENG T, et al. Genome-wide cloning, identification, classification and functional analysis of cotton heat shock transcription factors in cotton (Gossypium hirsutum)[J]. BMC Genomics, 2014, 15(1): 961.
(責任编辑:徐艳)

