靶向GPC3的人源化GPC3抗体的CAR-T细胞的构建
张皓然 门燕娟 徐凤 陈全刚

摘 要:GC33是一种重组的全人源化单克隆抗体,可与磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)结合。为构建人源化GPC3抗体的CAR-T细胞,试验选择已有的GC33单链抗体序列成功构建了人源化GPC3-CAR分子,即GC33-CAR分子,并通过Western Blot对该CAR的表达进行验证,通过免疫荧光检查CAR的细胞定位。结果表明:GCC33-CAR分子能在T细胞中稳定表达且且该CAR表达后可被定位于细胞膜上。CAR-T细胞中CAR的人源化有望提升其治疗效果,本研究为下一步的临床研究提供了基础。
关键词:嵌合抗原受体细胞;肝细胞肝癌;人源化;磷脂同醇蛋白聚糖-3
引言
肝细胞癌(Hepatocellular Carcinoma,HCC)目前是世界第5大肿瘤,也是癌症致死的第3大因素。磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)是一种硫酸乙酰肝素糖蛋白(heparin sulfate proteoglycans,HSPGs),在大多数的肝癌组织中呈特异性高表达,是一种较为理想的肿瘤治疗靶点。以GPC3为靶点治疗肝细胞癌的研究广泛开展,目前利用GPC3-CAR-T细胞治疗晚期肝细胞癌的Ⅰ期临床试验已正式启动(受理号:CXSL 1700203)。相关研究表明,鼠源scFV序列的免疫原性会导致CAR-T细胞在体内无法活化及持续存在。在卵巢癌及肾细胞癌的治疗过程中,针对鼠源scFV制备的CAR-T细胞的免疫应答导致了CAR-T细胞在输入患者体内后很快耗竭,持久性差,影响了治疗效果。GC33是一种重组的可与GPC3结合的全人源化单克隆抗体,一期临床试验结果显示GC33在HCC中有良好的耐受性,且与靶向GPC3的抗体相比丧失了对人类的免疫原性,因此,本研究构建了GC33-CAR-T细胞并对其进行了初步验证,为其后期应用于临床治疗奠定了基础。
1 材料
293T细胞为本实验室保存。RPM11640,DMEM,100x青霉素/链霉素,胎牛血清(GIBCO,美国),DNA聚合酶,DNA Maker,蛋白Maker,淋巴细胞分离液(GE,美国),抗人CD3抗体(eBio-science,美国),IL-2(PeproTech,美国),生物素标记的羊抗人IgG、HRP羊抗小鼠的二抗(Jackson,美国)。
2 方法
2.1 人源化GPC3抗体的构建
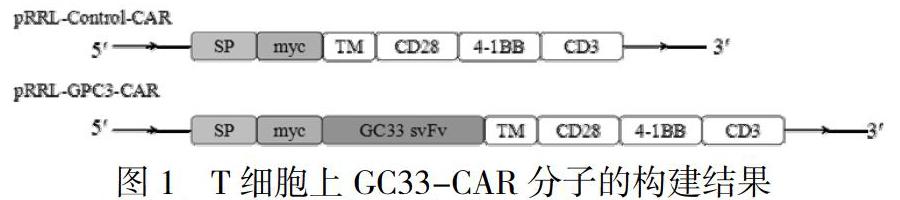
选择已有的靶向GPC3的单链抗体序列GC33作为胞外区,CD8α作为铰链区,CD28的跨膜结构域作为跨膜区,CD3ζ和共刺激分子CD28、CD137组成传导信号的胞内信号区,通过基因合成上述序列,并插入至pRRL慢病毒载体,共同组成可以稳定表达于T细胞上的GC33-CAR分子。
2.2 携带人源化GPC3-CAR慢病毒的制备
使用分子克隆技术按上述设计将识别GPC3抗原的单链抗体GC33与共刺激分子CD28、CD137和CD3ζ链的胞内信号结构域进行基因重组,随后通过人工合成和拼接技术,获得靶向GPC3抗原的GC33-CAR基因片段。以XbaⅠ和BamHⅠ限制性酶切位點为克隆位点,利用亚克隆技术将GCC33-CAR基因片段插入慢病毒表达载体中,最终获得携带GCC33-CAR基因片段的慢病毒表达载体pRRL-GC33-CAR。同时构建不含单链抗体区段的对照pRRL-control-CAR。293T细胞汇合度70%~80%时用更换含10%胎牛血清的DMEM新鲜培养基。将构建的慢病毒包装质粒及辅助包装质粒共转染293T细胞,培养16 h后弃掉上清液并加入含10%胎牛血清的DMEM培养基继续培养。24 h后荧光显微镜观察绿色荧光的发光情况,48 h后收取上清液,于4℃条件下12000×g离心20 min,0.45 μm滤器过滤后用1.5 mlEP管分装后-80℃冻存备用。
2.3 人外周血单核细胞(PBMC)的制备及人源化GPC3-CAR慢病毒感染T细胞。
抽取健康志愿者外周血,经Ficoll-hypaque(葡聚糖-泛影葡胺)密度梯度离心法获取单个核细胞(PBMC)后用培养基重悬。将细胞接种于6孔板中,加人IL-2和抗CD3抗体,置于37℃、5% CO2条件下培养过夜,观察PBMC状态,加入携带人源化GC33 CAR的重组慢病毒、对照病毒及聚凝胺。感染后的T细胞继续培养后离心,吸弃1/2上清,再加入等量的新鲜培养基。继续培养48 h后,荧光显微镜下观察GFP表达情况,确定大部分PBMC被慢病毒感染,即为CAR-T细胞或对照T细胞。
2.4 Western blot检测GPC3-CAR分子在T细胞内的表达
将上述收集的GC33-CAR-T细胞、未转染的T细胞分别加入预冷的细胞裂解液,将提取的蛋白经10%的SDS-PAGE进行分离后,恒流转印至PVDF膜上,并用5%的脱脂奶粉封闭,孵育Flag蛋白以及β-actin抗体4℃孵育过夜。用PBST洗涤3遍,每次5min,用HRP羊抗小鼠的二抗(1:2500)室温孵育1 h。加人显色剂化学发光后用印记显影系统采集图像。
3. 结果
3.1 高亲和力人源化GPC3 scFv的构建。
将已有的靶向GPC3的单链抗体序列GC33,CD8α铰链区,CD28,CD38链和共刺激分子CD28、CD137,通过连接链将这些结构串联在一起,构建可以稳定表达于T细胞上的GC33-CAR分子(图1)。
3.2 慢病毒包装质粒转染效率鉴定
将构建的的慢病毒包装质粒转染293T细胞,通过荧光显微镜观察质粒转染效率,从而确定病毒包装情况。结果显示,90%以上细胞呈现GFP阳性。
3.3 GC33-CAR分子在CAR-T细胞内表达。
包装好的慢病毒分别侵染人T细胞,并添加IL-2促进T细胞增殖。72 h后通过Western Blot检测各CAR的表达情况。结果显示,在Control-CAR-T中可同时检测到内源性CD3ζ和大小在40 KD左右的对照CAR条带;而在GC33-CAR-T细胞中可见内源性CD3ζ和分子质量约55 kD的GC33 CAR的表达。提示构建的CAR可成功在T细胞中表达。
3.4 CAR的亚细胞定位鉴定
使用包装好的Control-CAR及GC33-CAR慢病毒感染Hela细胞,通过使用myc抗体检测CAR的亚细胞定位情况,结果显示,Control-CAR及GC33-CAR均呈现明显的细胞膜定位。
结论
本研究利用已知的GC33 scFv与其他序列连接构建出人源化CAR结构。经慢病毒包装、感染,从而获得了GC33-CAR-T细胞。并通过Western Blot证实了该CAR可成功在T细胞中表达,通过免疫荧光证实表达的CAR具有细胞膜定位的特性,进而成功构建了靶向GPC3的人源化CAR-T细胞的构建,为肝细胞癌的CAR-T治疗提供了新的可行性手段。
参考文献
[1] 谢春梅、徐伟文,GPC-3在肝癌诊治中的价值及存在的问题,分子诊断与治疗杂志2016.1第八卷第一期。
[2] 戴顺志.人源化单抗在初期临床试验中能解决某些免疫原性问题[J].细胞与分子免疫学杂志,1992(01):83-84.

