含氢硅烷化合物的制备方法
苏 腾,谢鹏辉,伍 川,董 红,瞿志荣
(1.杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121;2.氟硅精细化学品与材料制造协同创新中心,浙江 杭州 311121;3.杭州师范大学材料与化学化工学院,浙江 杭州 311121)
有机硅材料包括硅油、硅橡胶、硅树脂和硅烷,其中前3种是由重复的Si-O-Si链节构成的聚合物,硅烷则属于小分子化合物,其分子中含有Si-C键,且Si原子上至少含有1个取代基。硅烷品种众多,既包括用作核磁基准物的四甲基硅烷[(CH3)4Si,简称TMS]这样的惰性硅烷,也包括氯代烷基硅烷、烷氧基烷基硅烷、烷氧基硅烷、乙烯基硅烷或硅氧烷、含氢硅烷或硅氧烷等活性硅烷。从这些活性硅烷出发,可进一步制备其它的硅烷、硅氧烷及有机硅聚合物,应用非常广泛[1]。其中,含活泼Si-H键的硅烷即含氢硅烷属于重要的有机硅化合物之一,从分子结构划分可分为两类,第一类是分子中仅含有Si-H这一种活泼的官能团,其余为惰性的烃基,其结构通式为RnSiH4-n(n为1~3的正整数),常见的硅烷化合物有CH3SiH3及(CH3)2SiH2等;另一类则是分子中除了含有活泼的Si-H键外,还含有诸如Si-Cl或Si-OR这样的活性官能团,其结构通式为RnHmSiX4-(m+n),其中,R为烃基,X为卤素或烷氧基等,n与m为1或2,m+n为2或3,常见的化合物有 CH3SiH(OCH3)2、(CH3)2HSiCl、HSi(OC2H5)3等。第一类含氢硅烷可以通过硅氢化反应,合成许多重要的碳官能团硅烷,或者将有机硅基团引入碳链中;第二类含氢硅烷分子中含有至少2种活性官能团,既可以如第一种硅烷那样发生硅氢加成反应,又可以通过Si-Cl或Si-OR官能团发生的水解、醇解、中和及其他反应,生成其它的下游衍生物,或实现对材料表面的官能化处理。
含氢硅烷是一种温和的还原剂,广泛应用于制备甲硅烷基取代的有机化合物的各类还原反应中,例如进行硅氢化反应[2]及C-H甲硅烷基化[3]等。此外,含氢硅烷还可替代高度危险的LiAlH4作为还原剂,将有机化合物催化转化为烷基卤化物[4]、醛[5]、酮[6]、酯[7]、酰胺[8]、环氧化物[9]及硝基[10]等。本文综述了制备含氢硅烷的主要方法,包括直接合成法、卤代硅烷还原法、烷氧基硅烷还原法,以及再分配法、格氏法、分解法等其它方法,以期为高附加值硅烷化合物的合成与应用提供指导,进一步拓展有机硅产品的应用领域,丰富硅烷产品链,提升硅烷制造企业的盈利空间。
1 直接法制备含氢硅烷
当代有机硅产业化技术来源于美国GE工程师Rochow在20世纪40年代发明的直接法合成甲基氯硅烷技术[11]。在直接法合成主产物(CH3)2SiCl2的同时,会产生少量的MeSiHCl2和Me2SiHCl副产物,其含量分别为0.1%~1%和0.01%~0.5%。用氯乙烷、氯丙烷和氯代正丁烷等其它卤代硅烷代替氯甲烷,与硅粉通过直接法工艺,也可合成其它种类的卤代硅烷,但生成的EtSiHCl2、PrSiHCl2及BuSiHCl2的含量均超过30%,远远超过合成(CH3)2SiCl2时生成的MeSiHCl2含量。因此,提高直接法合成产物中MeSiHCl2和Me2SiHCl的含量,成为人们获得含氢硅烷的主要途径。
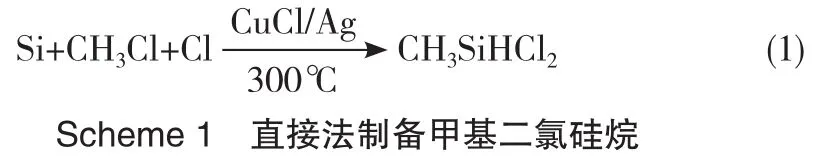
北京化工研究院将银粉以助催化剂形式加入到Si-CuCl触体中,同时用掺有HCl的CH3Cl代替单纯的CH3Cl作为气相组分,可将氯硅烷粗单体中MeSiHCl2的含量大幅提高至30%~40%(Scheme 1),缺点是Me2SiCl2的含量较少,且MeSiCl3的含量也达到了30%。该方法虽然适合工业化生产,但仍存在副产物甲基三氯硅烷含量高、催化剂昂贵、防腐困难等问题。
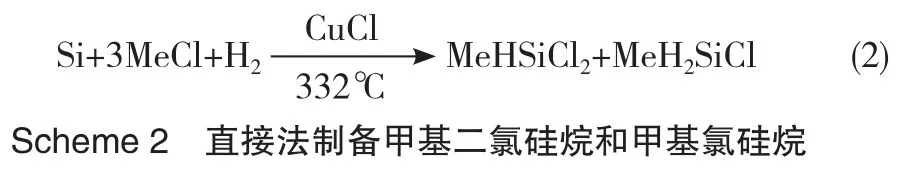
此后,北京化工研究院又用H2代替掺入的HCl组分,与CH3Cl一起作为气相反应原料,继续进行直接法合成氯硅烷的研究[12]。与HCl相比,H2成本更低,粗产物中MeHSiCl2和MeH2SiCl的含量可达30%~40%(Scheme 2)。未完全反应的H2与CH3Cl气体虽然可通过压缩实现分离,但成本较高。
吉林石化公司以CuCl-Zn-Ni合金代替CuCl作为直接法合成氯硅烷的催化剂,在搅拌床中即使不通入易燃易爆的H2,也可将MeSiHCl2的含量提高至13%~17%[13]。Ni与Cu之间的协同作用有利于将CH3Cl原位分解成HCl,后者可促进MeSiHCl2的生成,同时也避免了直接通入HCl时,因HCl浓度过高导致的多氯化合物含量增高的风险。
以Cu-Zn-Sr-P代替Cu粉作为直接法合成氯硅烷的催化剂,同时在CH3Cl中掺入HCl作为混合反应气体,经315℃反应后,粗产物中MeSiHCl2的含量达到了9.5%[14]。在流化床反应器中,将作为助催化剂的Zr和Sr与Si-Cu触体混合后,经HCl加热预处理,然后再通入掺杂H2的CH3Cl混合气体,可有效抑制多氯产物的生成[15],粗产物中MeSiHCl2的含量达到39%,Me2SiHCl的含量介于14%~22%之间,而MeSiCl3含量低至6.6%。
经过70余年的发展,直接法合成甲基氯硅烷的工艺已非常成熟,工业化规模不断扩大,单套氯硅烷装置的生产能力已大于10万t·a-1。2019年4月国家发展改革委员会公布的《产业结构调整指导目录(2019年征求意见稿)》(2019指导目录)中,已将新建初始规模小于20万t·a-1、单套规模小于10万t·a-1的甲基氯硅烷单体生产装置列为限制类投资项目。常规的Me2SiCl2单体面临产能过剩的风险,如何提高高附加值含氢氯硅烷的含量并开发下游产品,实现各单体生产企业之间的差异化发展,将是各单体企业未来必须面临的挑战。
2 卤硅烷还原制备含氢硅烷
直接法合成的各种甲基氯硅烷分子RnSiCl4-n(n为1~3)中含有活泼的Si-Cl键,将Si-Cl键在特定条件下进行选择性还原,也可高收率地得到含氢硅烷 RnHmSiCl4-n-m。LiAlH4、LiH、NaH、CaH2、MgH2、LiBH4、NaBH4等都是常见的还原剂。直接法的合成产物中,含氢硅烷的种类和含量都有限,但氯硅烷含量可达95%以上,种类多且来源广泛。采用还原法可有效解决含氢硅烷含量较低的问题;此外采用选择性还原技术,还可制备得到分子中既含Si-H又含有其它不饱和官能团的硅烷,从而得到种类更多的含氢硅烷。
2.1 金属氢化物还原
金属氢化物是最常使用的还原剂,品种繁多,各有特点,为制备不同的产物提供了多种可能。LiAlH4属于强还原性的还原剂,即使不使用催化剂,在较低的温度下也可以高产率地完成许多还原反应。LiH、NaH、CaH2和MgH2的还原性较弱,通常需要升高反应温度或者使用助催化剂才能完成还原反应。LiAlH4价格昂贵,危险性大,且还原Si-Cl键产生的AlCl3有引发其它催化反应的可能,导致副产物多,影响后处理尤其是分离过程,因此通常采用NaBH4、LiH、NaH、CaH2和 MgH2等价格便宜、性质温和、易于后处理的金属氢化物作为Si-Cl键的还原剂。
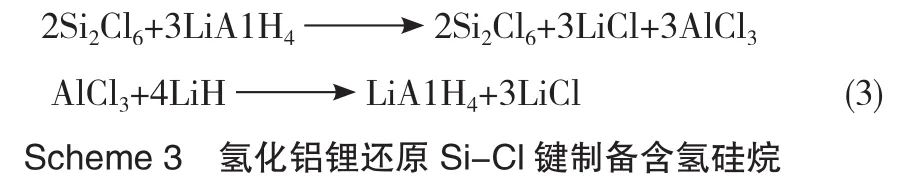
以LiH作为还原剂时,可加入LiAlH4作为催化剂,当LiH和LiAlH4的摩尔比为0.8~40时,可将Cl3SiSiCl3有效还原为H3SiSiH3,产物收率达到90%,该反应在室温条件下即可进行(Scheme 3)[16]。
在没有LiAlH4这样的强还原剂存在时,LiH对氯硅烷的还原性较低,这是由于有机溶剂中LiH的溶解度较小,同时反应生成的LiCl颗粒附着在LiH表面,使得LiH无法与反应物接触,抑制了反应的进行[17]。采用球磨、超声波分散或者高速搅拌的方式,可将未反应的LiH暴露出来,有利于反应的持续进行,达到较好的反应效果。采用机械方式促进反应进行的方法工艺简单,既不需要额外提高反应温度,也不需要添加其它催化剂,具有较好的应用前景,但工业化放大过程中需强化过程的传质。
价格便宜的NaBH4还原剂易溶于二乙二醇二甲醚、三乙二醇二甲醚、四乙二醇二甲醚等乙二醇醚类溶剂,室温下即可催化NaH对氯硅烷的还原反应(Scheme 4)。式中MX为氯硅烷,该反应转化率接近100%[18]。

以LiBH4代替NaBH4,以LiH代替NaH,也可将Si-Cl还原为Si-H[18],且可取得同样好的效果。但与LiAlH4相比,NaBH4的价格更便宜且安全性更高,在当前所有催化NaH还原Si-Cl键为Si-H键的催化剂中,NaBH4是最适宜的选择。
与LiH及NaH相比,虽然CaH2和MgH2的还原能力更弱,但两者价格更加低廉,而且从安全角度考虑,两者的安全性更高。CaH2来源广泛,但还原性较弱,无法直接作为还原剂使用,需要加入其它的助催化剂。例如在将Me3SiCl还原为Me3SiH的过程中,加入CaH2量5mol%的AlCl3,可使Me3SiH的产率达到80%以上[19],但该反应的温度需高于270℃才能实现催化剂的循环,反应体系温度很高,能耗较高,实际应用价值不大。
Everett等[20]提出了一种利用MgH2还原卤代硅烷的方法。先将金属Mg氢化成MgH2,再与卤硅烷反应得到氢硅烷,生成的MgX与强碱反应,将镁还原出来,同时生成强碱盐副产物。这种方法所得的氢硅烷纯度较高,但是使用活泼的MgH2,而且有大量副产物,成本较高。Burgie等[21]发明了一种以含有LiCl和其他碱金属氯化物的LiH作为催化剂,利用H2直接将SiCl4还原成SiH4的方法,能实现SiH4的连续生产,但是需要高温(600℃)和高压等苛刻的反应条件。Holl[22]先用H2将路易斯酸碱对氢化,再利用氢化的路易斯酸碱对还原低聚或高聚合的卤化硅等单体,反应完成后分离出卤化氢,将反应后含有卤素的路易斯酸碱对进行再生,即可实现路易斯酸碱对的循环使用。该方法的优点在于转化率高且副产物少,并且实现了催化剂体系的循环。Yokoyama等人[23]提供了一种安全可靠地生产硅烷化合物的方法。首先用NaBH4或NaBH4与AlCl3的反应产物还原卤代硅烷化合物,同时对拟还原的化合物进行第二次还原。该方法的缺点在于反应分批进行,效率及收率较低,会产生大量的副产物。
John等[24]先用叔胺催化剂将六卤代二硅烷转化成四(三卤代甲硅烷基)硅烷,再用二异丁基氢化铝氢化,得到纯度93%以上的新戊硅烷。Oh等人[25]介绍了一种将至少含有3个硅原子的卤硅烷还原成氢硅烷的方法,以i-Bu2AlH为氢化试剂,叔胺为催化剂时,可将Si5Cl12还原成Si5H12,该方法可以用于聚合的卤硅烷,产率高且副产物少。
2.2 氢气还原
随着绿色化学的发展,人们一直在研究更少产生废弃生成物的反应。传统的金属氢化物催化还原卤硅烷时,往往会产生大量无用的金属卤化物,对生产成本的控制以及环境的保护都很不利。作为一种清洁能源,氢气是一种很好的反应物,国内外学者也考察了氢气直接还原卤硅烷的反应。
在将SiCl4氢化还原为HSiCl3的过程中,先将粉末镍触媒与硅粉按一定比例均匀混合,H2气氛下,逐步从室温升温至450℃进行活化处理,然后再将H2与SiCl4按一定比例通过活化处理后的混合物粉末,可实现氯化硅的还原反应[26]。氢化反应可连续进行,随反应消耗可连续补充混合物料。
采用SiCl4冷氢化工艺生产HSiCl3时,先将SiCl4与H2混合后进行气化,然后将硅粉和铜粉催化剂一起加到桶状冷氢化反应器中,控制气体流速为12m·s-1。反应可连续进行,制备的HSiCl3可直接用于生产电子级多晶硅,反应过程物料可循环使用,污染小,减少了企业成本,有利于环境保护[27]。
David等[28]以卤化铝为催化剂,H2为还原剂,将卤代硅烷还原为相应的含氢硅烷,最合适的反应底物是SiCl4,卤化铝用量为SiCl4用量的1mol%~2mol%。调节氢气与卤硅烷的摩尔比,可得到不同的产物。该方法的主要优点是三卤化铝催化剂几乎可以完全回收再利用。
随着配位催化的发展,国外一些研究者也尝试使用配位催化剂催化H2与卤硅烷的还原反应,并取得了一些成果。还原反应中通常伴随有碳-杂键(或C-C键)的断裂反应,即氢解反应,在此过程中,H会取代离去的杂原子(C原子)或基团生成相应的烃,氢解反应可采用催化氢法或化学还原法。Daisuke等[29]用氢解反应代替氢化铝锂等强氢化物还原法合成了含氢硅烷,在胺存在下,以铱络合物为催化剂,在温和的反应条件下成功地将含氢的HSiF3和卤化物转化为相应的Si-H化合物。该反应利用铱配合物催化剂,有效地催化H2的杂化裂解和N-杂环化合物的氢化反应,优点在于采用绿色价廉的H2代替昂贵且容易产生金属废弃物的还原剂,环保且经济。
Beppu等人[30]发现,在金属配体双功能铱催化剂的催化下,通过卤代硅烷的氢解反应可以有效制备出各种硅氢化合物,该方法适用于多种低成本的市售氯硅烷与NaI预处理相结合的反应。他们研究了二氯硅烷和三氯硅烷选择性单氢解制备单氢氯硅烷的反应,为合成各种有机硅化合物提供了良好的前驱体,采用该方法还可将Me3SiCl原位还原成Me3SiH。
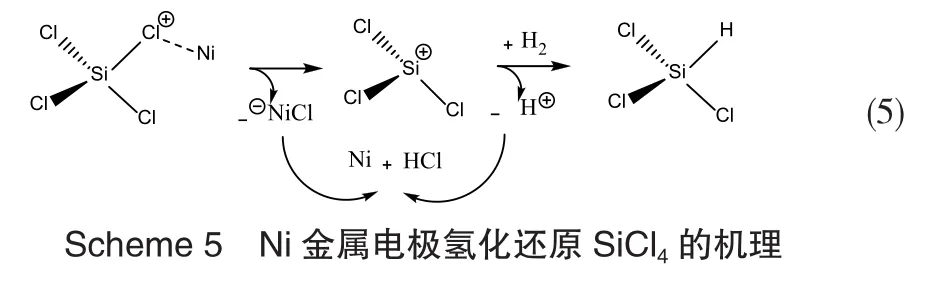
除使用催化剂外,还可使用等离子体促进氯代硅烷在H2作用下的还原反应。Gusev[32]研究了在射频(40.68MHz)等离子体中的SiCl4的氢化反应,并确定了HSiCl3的收率与摩尔能量输入、H2与SiCl4之间的摩尔比、反应压力之间的关系,HSiCl3最高产率可达60%,生成1mol SiHCl3的最小能量为0.3kW·h-1。Kornev等人[33]研究了射频等离子体的电极材料对SiCl4加氢还原反应选择性的影响,比较了Cu、Ni、Nb、Zr、W电极对四氯化硅氢化还原反应的影响,发现采用钨作电极材料时,其射频电弧等离子体放电对四氯化硅的氢化反应最为有效。以Ni电极为例,初步研究了金属电极氢化还原四氯化硅的机理(Scheme 5)。
3 烷氧基硅烷还原
除了卤硅烷外,烷氧基硅烷也能经过还原变成氢硅烷,可使用上述卤硅烷还原方法对烷氧基硅烷进行还原。与卤硅烷相比,烷氧基硅烷的来源较少,通常来自于卤代硅烷的醇解反应或者醇与硅粉的直接法合成。但近期有文献报道了由二氧化硅(SiO2)和醇生成烷氧基硅烷的方法[34],拓展了烷氧基硅烷的来源渠道。烷氧基硅烷还原反应的文献报道较少的另一个原因是Si-O键键能较大,比较稳定,将其断裂通常需要高反应性的金属氢化物,因此迄今为止,文献仅报道了烷氧基硅烷催化加氢的少数例子[35]。
Corrkj等[36]报道了通过Ti、Zr或Ni配合物与烷基格利雅试剂的反应,来催化烷氧基硅烷的氢化反应,反应过程中甲氧基硅烷的构型可以得到保留。反应方程式如Scheme 6所示(其中X=OCH3、Cl、F;R=Et、n-Pr、i-Pr、n-Bu、i-Bu)。

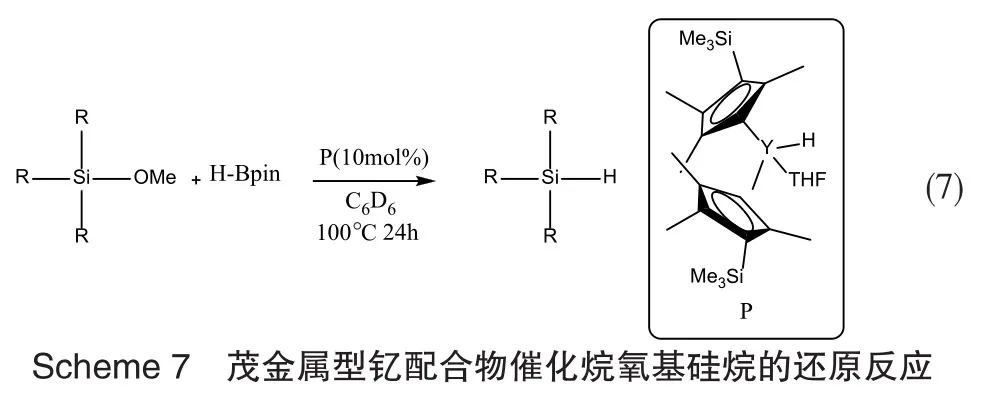
除了使用金属配合物和烷基格氏试剂催化烷氧基硅烷的氢化反应外,使用茂金属型钇配合物作为催化剂,HBpin(频哪醇酯)也可将烷氧基硅烷还原为相应的含氢硅烷[37]。在10 mol%的Cp’2YH(THF)(催化剂 P,Cp’=η5C5Me4SiMe3)存在下,以 C6D6为溶剂,将Me2PhSiOMe与HBpin在100℃下反应可生成Me2PhSiH,收率为57%。反应机理如Scheme 7所示。
以六甲基磷酸三酰胺(HMPA)为路易斯碱催化剂,烷氧基硅烷也可由硼烷BH3得到有效还原[38],其反应机理如Scheme 8所示。除了使用BH3外,还可构建一个由NaBH4原位生成BH3的反应体系,可实现用廉价的NaBH4试剂对烷氧基硅烷的还原。此外,在THF溶剂中,以HMPA为催化剂,通过EtBr与NaBH4的还原反应,生成的BH3可将甲氧基硅烷还原成氢硅烷。

4 制备含氢硅烷的其他方法
除了上述方法外,还可通过再分配法、格利雅法等方法制备含氢硅烷。
4.1 再分配法
在催化剂作用下,有机氯硅烷、烷氧基硅烷及氢硅烷分子中的Si-Cl、Si-R、Si-OR及SI-H键,可以通过再分配反应得以互换,生成新的含氢硅烷。以有机硅铵盐[MeN(C3H6SiO3/2)3]+Cl-作为反应的催化剂时,可促进Me2SiCl2与MeSiH2Cl之间发生官能团的交换反应,得到收率高达32.2%的Me2SiHCl[39]。采用再分配法,可由一种含氢硅烷单体制备另一种含氢硅烷单体,且能控制反应方向,生产较为灵活,但原料成本高,工艺复杂,可以用于辅助小规模生产,难以大规模工业应用[40]。
4.2 格利雅法
采用格利雅法,可在保持Si-H键不变的情况下,由含有Si-H键的氯硅烷或者烷氧基硅烷得到另一种含氢硅烷。典型的格利雅反应是由HSiCl3与PhMgBr反应制备PhSiHCl2,反应方程式如Scheme 9所示。

采用格利雅法虽然可以制备含氢硅烷,这是钠缩合法(Wurtz-Fittig)不具备的优势,但反应条件较为苛刻,反应后产物分离困难,尤其是溶剂回收困难,产物浓度较低。此外,使用醚类溶剂容易产生过氧化合物,存在一定的安全风险,制约了格氏法的工业化放大。
5 结语
总的来说,现阶段含氢硅烷的合成方法主要以直接法和还原法为主。将直接法所得产物中的不同组分分离出来,可直接进行工业生产,或者利用还原法,将直接法的产物转化为新的有机氢硅烷。但直接法的产率低,产物组分较复杂,分离困难,传统的还原法会产生大量废弃的金属盐,这些都不能满足未来工业生产的需要。随着有机合成工艺的不断发展,越来越多新的合成方法被开发,包括用廉价环保的氢气代替金属还原剂,用新的配位催化剂代替传统的催化剂,用电化学的方法代替传统合成方法中所需的高温反应条件等,含氢硅烷的合成越来越向着高产率、低能耗、无污染的方向发展。随着含氢硅烷在有机硅下游领域、医药、电子电气、芯片、大规模集成电路制造等高新技术领域的广泛应用,发展更为高效的含氢硅烷的制备方法,必将进一步完善有机硅产业链,同时也为有机硅行业的持续发展注入新的活力。

