药物涂层球囊治疗冠状动脉支架内再狭窄临床试验方案中入选、排除标准的探讨
陶苑茹,张晓燕
(1.内蒙古医科大学生物医学工程专业,呼和浩特 010110;2.内蒙古自治区人民医院医学工程处,呼和浩特 010017)
0 引言
2016年,国家食品药品监督管理总局联合国家卫生和计划生育委员会颁布了《医疗器械临床试验质量管理规范》,明确了临床试验方案中应包含的内容。2018年,国家药品监督管理总局制定并颁布了《医疗器械临床试验设计指导原则》及《接受医疗器械境外临床试验数据技术指导原则》,对临床试验设计的类型、受试对象、评价指标及统计分析等内容均进行了详细的解释,但并未发布药物涂层球囊技术的相关指导原则。
临床试验是获得临床评价基础数据的主要途径之一[1],其真实性、科学性和合规性直接影响着试验产品的安全性和有效性。医疗器械临床试验是指对拟申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认、检验或验证的过程[2]。由于医疗器械的固有特征,其试验设计有自身的特点,故设计一份科学、合理、可行的临床试验方案对开展临床试验尤为重要。
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)如今已成为国内外治疗冠状动脉粥样硬化性心脏病的一种主要方法[3-4]。而支架置入部位总是存在内膜过度增生和新生内膜粥样硬化斑块形成的现象[5],导致了支架内再狭窄(in-stent restenosis,ISR)[6]的发生。近年来,我国接受 PCI的冠心病患者年均增长率为15%~20%[7],冠状动脉ISR已成为冠心病介入治疗领域中的一个大难题。当前,应对冠状动脉ISR的治疗方法主要有药物治疗、普通球囊、切割球囊、金属裸支架、可降解支架、药物洗脱支架、药物涂层球囊等[7]。2016年,基于多项国内外临床研究、由20多位国内PCI领域知名专家制定了《药物涂层球囊临床应用中国专家共识》[8],推荐药物涂层球囊可应用于分叉病变、小血管病变、ISR病变及包含有高出血风险患者等人群。其中,冠状动脉ISR是药物涂层球囊的优选适应证,也是经过国家药品监督管理局批准的临床适应证[9]。大量研究证明[10-12],药物涂层球囊与药物洗脱支架相比有较突出的优势,药物涂层球囊涂层的抗增殖药物通过血管壁时释放,起到了抑制血管内膜增生的效果[10],从而避免了金属异物的植入,实现了介入无植入,并在治疗冠状动脉ISR时显现出很好的安全性和有效性[11-12]。
然而,对于药物涂层球囊治疗冠状动脉ISR临床试验方案(以下简称“临床试验方案”)设计及实施过程的科学性和合理性的相关研究案例较少,且缺乏对临床试验方案中每项条目具体的解释及限定,在实际临床试验方案的设计和实施中仍然存在一些值得关注的问题。比如在选择入选和排除标准时,必须有明确的理论数据做支撑[13]。基于上述背景,本文对该临床试验方案的入选和排除标准进行探讨,旨在为其他相关临床试验项目方案的设计提供参考。
1 研究对象及方法
选择临床试验方案的入选、排除标准,结合文献分析法、案例调查法及实地调研法分析具体内容。
(1)文献分析法。以英文关键词drug eluting balloon、coronary in-stent restenosis、clinical trial protocol、inclusion criteria、exclusion criteria 及中文关键词医疗器械临床试验方案、入选标准、排除标准、药物涂层球囊治疗冠状动脉ISR等对PubMed、Web of Science、万方数据库和中国知网等数据库进行全面检索,检索范围为2014年1月至2019年6月的中、英文文献。从结果来看:多数文献对医疗器械临床试验质量控制[14]、存在问题[15-16]、知情[17-18]、监管[19]、伦理[20-21]等方面进行了探讨;对于药物涂层球囊治疗冠状动脉ISR的相关文献,多为与药物洗脱支架在靶血管重建率、心血管事件发生率、9个月晚期管腔丢失情况[22]、再狭窄率[23-24]及主要不良心血管事件(major adverse cardiovascular events,MACE)发生率[25]等临床疗效方面的比较,以及对相关检测技术及指标等成果[26]的研究及回顾性的随访研究[21-27]等。但整体上对临床试验入选、排除标准相关内容的探讨较少。
(2)案例调查法。选择已有的临床试验方案进行案例剖析,分析并对比其优、缺点。
(3)实地调研法。实地调研心血管内科既往药物涂层球囊治疗冠状动脉ISR的病例,全面了解药物涂层球囊在治疗冠状动脉ISR临床试验的现实案例,与临床医师探讨方案中存在的问题,并寻求解决办法。
2 入选、排除标准问题分析及建议对策
科学、详尽、清晰的临床试验方案不仅可以保证临床试验取得成功,还能保证其可靠性和准确性。因此,结合临床实际工作分析临床试验方案,归纳其入选和排除标准中存在的问题并提出相关建议对策具有重要意义。
2.1 入选标准
入选标准是指欲参与临床试验的受试者能够入组的基本条件,即临床试验方案中以清单的方式列出的对受试者选择时规定的入组指标[28],包括疾病的诊断标准,受试者相关病史、病程及治疗情况等内容。入选标准主要考虑受试者对总体人群的代表性,例如适应证、疾病的分型、疾病的程度和阶段、使用具体部位、受试者年龄范围等因素[2]。医疗器械临床试验方案中入选标准的制定十分重要,其不仅直接决定受试者的筛选情况、影响受试者的生命安全,还是临床试验顺利进行的前提条件,同时也为医疗器械上市后的适用范围提供了依据与参考。
2.1.1 案例呈现
A临床试验方案入选标准包括:年龄18~75岁,男性或者未孕女性;无症状心肌缺血证据、稳定性或不稳定性心绞痛或陈旧性心肌梗死的受试者;第一次支架后再狭窄的受试者;适合接受经皮冠状动脉腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA)或 PCI治疗的受试者;支架内再狭窄(直径)≥50%,如果支架内再狭窄(直径)≥70%,无心肌缺血证据和症状也可以入选;参考血管直径1.25~5.0 mm,病变长度≤40 mm;能够理解实验目的,自愿参加并签署书面知情同意书的受试者。
E临床试验方案入选标准中提到:靶病变能被成功预扩(导丝可以通过病变,球囊预扩血管后内径残余狭窄≤50%,无限流夹层或血栓)。
2.1.2 问题分析
对比临床试验方案,针对入选标准中靶病变情况涉及的内容进行归纳总结,如图1所示。结果发现,不同方案所包含内容的全面程度不同。多数临床试验方案包含了对靶病变血管直径、病变长度、狭窄程度的描述,而对于心肌梗死溶栓(thrombolysys in myocardial infarction,TIMI)血流等级、靶病变数目的要求只在个别临床试验方案中提及,而这2个方面也会直接影响临床试验方案的有效性和合理性,影响筛选工作的顺利进行。
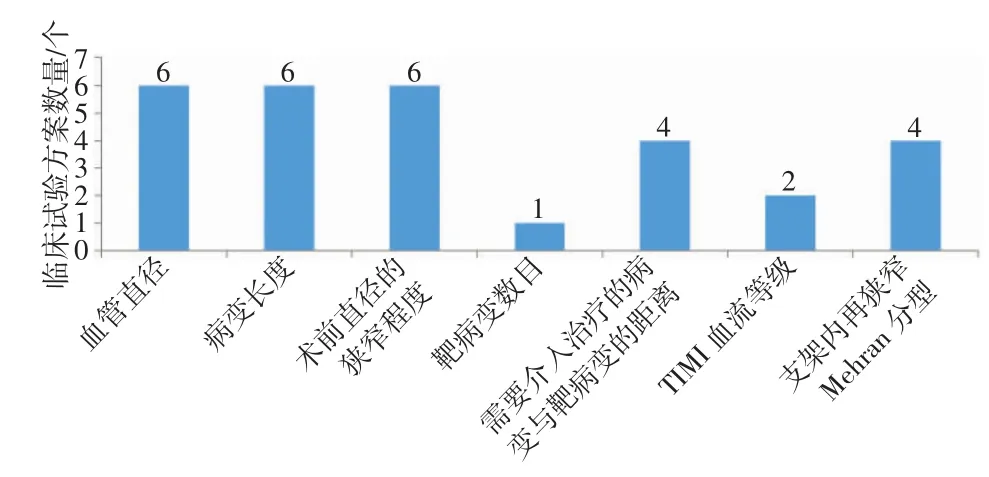
图1 入选标准中与靶病变情况相关内容
2.1.3 建议对策
临床试验方案的入选标准应包含以下几个方面的内容:
(1)基础信息。建议包括年龄(上下限)、性别、是否怀孕、是否计划怀孕、受试者预期寿命是否超过2 a等内容。
(2)受试者相关病史、病程和治疗情况。建议包括稳定型心绞痛、急性冠状动脉综合征(acute coronary syndrome,ACS)或缺血性心肌病;受试者原位血管病变第一次支架手术治疗后发生再狭窄等内容。
(3)靶病变情况。建议包括病变性质、血管直径、病变长度、狭窄程度、TIMI血流等级、靶病变数目、需要介入治疗的病变与靶病变的距离等内容。
(4)知情同意[29]部分。建议包括受试者从语言和心理上能够理解临床试验研究目的;受试者表示认可知情同意书中所陈述的临床试验风险和受益等内容。
(5)随访及受试者依从性部分。建议包括受试者有较好的依从性,且必须接受9个月的血管造影随访;受试者必须接受1个月、6个月和12个月的随访等内容。
判定受试者的依从性以及确认受试者能接受并完成术后的多次随访,是本项临床试验方案中必须体现的内容。完成1个月、6个月、9个月和12个月的随访并记录相关指标,是临床试验顺利推进并能得到最终研究结果的必要条件。选取术后9个月作为主要随访点,观察靶病变节段内晚期管腔丢失情况,并完成相关实验室检查,包括心电图、血常规、肝功能、肾功能、血脂、心肌酶等。在术后1个月、6个月、9个月、12个月的随访时间节点,需要观察并记录靶病变血运重建、靶病变失败率、MACE发生率、主要心脑血管事件等相关信息。
2.2 排除标准
排除标准是指在符合入选标准的基础上其他不满足临床试验要求的特殊情况[28],即从保障受试者生命安全、影响或可能影响试验顺利进行、影响研究结果等多个角度出发,通过排除标准把不符合或不完全符合临床试验标准的受试者排除。排除标准旨在尽可能规范受试者的同质性,将可能影响试验结果的混杂因素(如影响疗效评价的伴随治疗、伴随疾病等)予以排除,以达到评估试验器械效果的目的[2]。排除标准并不是入选标准的对立面,也不可以简单理解为排除准则,而是依据临床试验的实际案例规定的一种入组排除指标。
2.2.1 案例呈现
F临床试验方案中排除标准包括肾功能不全[估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<30 ml/min]者;已知对紫杉醇类药物过敏者;入组前一周内发生过心肌梗死者;入组前6个月发生脑中风或过去6个月内有消化性溃疡或胃出血病史,或者研究者判断受试者为出血体质者;禁用抗凝剂或者抗血小板药物,不能耐受阿司匹林或氯吡格雷者;进行过心脏移植术者。
2.2.2 问题分析
C临床试验方案的排除标准为与受试者相关和与靶病变相关,其将受试者的用药禁忌、研究者的判断等条目笼统地归纳到与受试者相关项中。D临床试验方案在靶病变相关项中包括不能成功预扩张的再狭窄病变,但未对成功预扩张的含义进行界定。
对排除标准中与受试者其他病史、病程相关的部分进行归纳总结后发现(如图2所示),不同方案对受试者的其他病史、病程的规定有所不同。且对患有严重性瓣膜心脏病受试者的排除涉及较少,仅有一个临床试验方案排除了ISR已经行冠状动脉旁路移植术冠状动脉旁路移植术(coronary artery bypass grafting,CABG)治疗者。
2.2.3 建议对策
建议临床试验方案的排除标准应包含以下方面的内容:
(1)与受试者其他病史、病程相关的部分。建议包括入组前一周内发生心肌梗死者;有严重性瓣膜心脏病者;有严重充血性心衰或纽约心脏病协会(New York Heart Association,NYHA)Ⅳ级的严重心衰者;心脏移植术者;肾功能不全者;手术前6个月内发生脑中风者;ISR已经行CABG治疗者;妊娠期或哺乳期女性等。
入组前一周内发生心肌梗死者、有严重性瓣膜心脏病者、心脏移植术者、有严重充血性心衰或NYHAⅣ级的严重心衰者由于其心脏本身病变,不能耐受PCI手术,故应列入排除标准。术前6个月内发生脑中风者,因其有过出血史、凝血功能障碍,故不建议纳入。这些与受试者其他病史、病程相关的排除标准会直接影响受试者的生命安全。
(2)与靶病变相关的部分。建议包括介入治疗前靶血管内广泛血栓证据;靶病变的分叉病变中分支血管直径≥2.5 mm。
(3)与合并用药相关的部分。建议包括受试者不能耐受阿司匹林和/或氯吡格雷者,有白细胞减少或血小板减少病史者或严重肝功能不全者;已知对肝素、造影剂以及紫杉醇类药物过敏的受试者。
当前市面上的药物涂层球囊涂层的抗增生药物大多采用脂溶性好的紫杉醇,更容易进入血管内皮细胞。许多细胞培养结果表明,平滑肌细胞与紫杉醇化合物短暂接触就可保持较长时间的抑制作用[30]。而紫杉醇类药物过敏者不能耐受药物涂层球囊,故建议排除。
(4)与造影相关的部分。建议包括三支冠状动脉血管病变或以上者;左主干和2 mm内的开口病变;靶病变近段存在严重扭曲或重度钙化病变等。
(5)研究者的判断。建议包括研究者判断受试者依从性差,无法按照要求完成研究;研究者认为不合适参加本试验的受试者。
(6)其他部分。建议包括预期寿命不超过12个月或预计很难完成12个月内随访的受试者;正在参与其他任何临床试验且未完成的受试者。
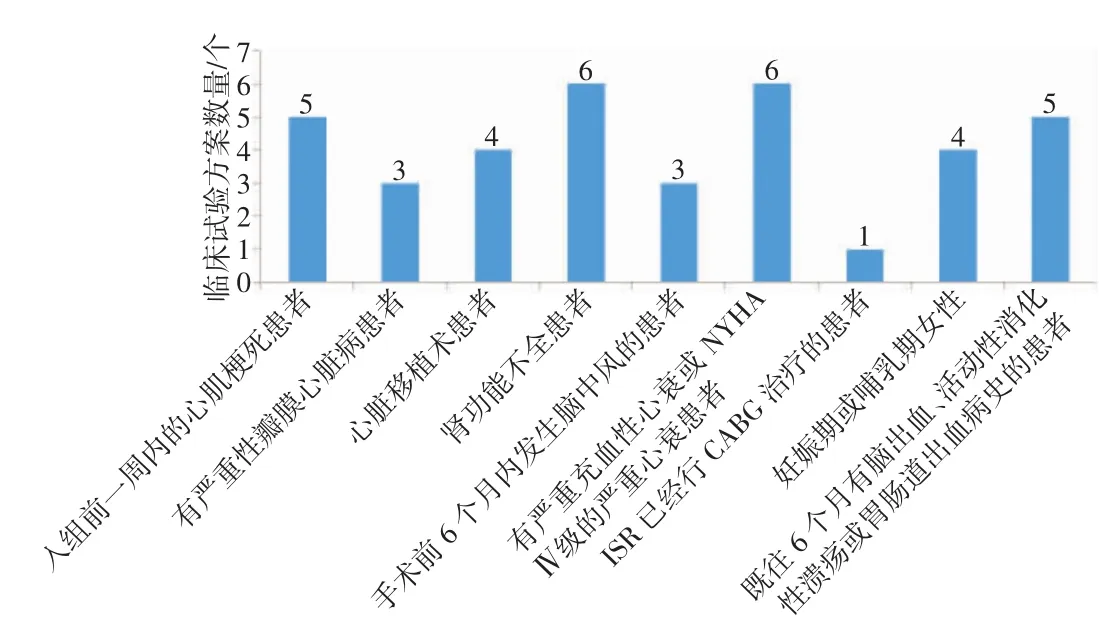
图2 排除标准中与受试者病史、病程情况相关内容归纳
3 结语
受试者不应该因为参加任何一项临床试验而处于不必要的风险之中。根据美国国立卫生研究院(National Institutes of Health,NIH)要求,临床试验的入选、排除标准必须明确、实用、可推广,并能为研究建立伦理基础[31]。本文结合大量文献,对比分析了药物涂层球囊治疗冠状动脉ISR临床试验方案的入选、排除标准,通过剖析其具体内容、了解受试者情况,归纳了较为科学、准确、可行的入选、排除标准,为其他相关临床试验项目方案的设计提供了参考。
临床试验方案的好坏直接决定了临床试验开展的科学性、合理性,直接影响着参与临床试
验受试者的生命安全与权益。本研究样本量有限,下一步将通过扩大样本量、对临床试验方案中的其他条目进行分析与对比、加强与临床实际工作的结合、制订受试者的调查问卷等方法,得到更为科学、合理、详尽、准确的临床试验方案,以保证受试者的生命安全和权益。

