低温胁迫下油菜素内酯对高山离子芥悬浮细胞膜系统的影响
刘亚洁, 安黎哲
(1.兰州大学草地农业生态系统国家重点实验室, 兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心, 兰州大学草地农业科技学院, 兰州 730020; 2.兰州大学生命科学学院, 兰州 730000)
1 引 言
生物膜是细胞与外界环境联系的接口,各种逆境对细胞的伤害多始于细胞膜.大量研究表明,低温胁迫下植物细胞膜系统是最先受到伤害的部位,造成大量电解质向组织外渗漏,使组织浸泡液的离子渗漏率增高[1].在低温胁迫下,细胞内产生大量的活性氧自由基(ROS),自由基的增加首先攻击膜系统,膜脂脂肪酸的不饱和键被过氧化,产生膜脂过氧化作用,造成丙二醛(MDA)含量的增加[2].低温对膜脂的直接影响是改变膜脂成分的含量及其脂肪酸组成,膜的流动性和稳定性主要由膜脂脂肪酸的不饱和程度来决定[3],大量研究表明膜脂脂肪酸不饱和程度高,可增强光和有机体对冷、低温和盐胁迫的耐性[4-5].
质膜ATPase是一类功能性蛋白,对维持细胞内外环境的代谢平衡具有十分重要的作用,它同各种膜体系和细胞器有着广泛的联系,对能量代谢、物质的吸收和运输等许多生理过程具有重要作用[6].质膜H+-ATPase被形象地称为植物生命活动的“主宰酶”,它通过泵出质子建立跨膜的电化学梯度,驱动次级离子或溶质的跨膜运输[7].研究表明H+-ATPase对低温引起的氧化胁迫十分敏感[8].K+-ATPase存在于细胞质膜中,该酶在细胞质膜中的唯一功能是水解ATP进行K+的逆浓度梯度运输[9].低温胁迫能引起胞质Ca2+水平升高[10-11],胞内Ca2+浓度过高或维持高浓度时间过长会干扰细胞能量代谢系统和许多生理功能.因此,要维持细胞生理代谢和Ca2+第二信使功能的正常进行,必须把受刺激升高的胞质Ca2+浓度在其完成信息传递后迅速回落到静息态即低稳态水平.这种动态调节行为主要依赖于细胞质膜和细胞器外膜上的Ca2+-ATPase和Ca2+/H+逆向运输两种方式[12].细胞膜上Mg2+-ATPase对有生命的细胞维持内外环境生理代谢的平衡具有极其重要的作用[13].总之,研究低温环境条件下质膜各类ATPase活性的变化对进一步阐明植物的抗寒机理具有重要意义.此外,低温胁迫诱导了一些基因的启动和大量表达,这些基因称之为冷诱导基因或冷调节基因(COR),它们在提高植物耐低温能力方面发挥重要作用.
油菜素内酯(brassinosteroids, BRs)是以甾醇为基本结构的具有生物活性的化合物,广泛存在于植物体内,对茎和花粉管伸长、叶片弯曲和偏上性生长、乙烯合成、质子泵活化、木质部分化、光形态建成、衰老和基因表达等具有广泛的调节作用[14-15].在农业生产中,BRs可以提高作物对高温、干旱、冷害、除草剂、盐害等逆境的抗性,特别是在提高植物耐冷性方面表现出了良好的效果[16].BRs可以提高植物对低温胁迫的抗性,但是其深层次的机理在很大程度上尚未探究.细胞膜是植物遭受冷害损伤的原初部位,本文以高山离子芥(Chorisporabungeana)悬浮细胞为材料,通过研究在低温胁迫下BRs对其离子渗漏率,膜脂过氧化程度,膜脂脂肪酸不饱和程度,质膜上执行重要生理功能的ATPase活性,以及冷调节基因CbCOR15表达水平的影响来探讨在低温胁迫下BRs对细胞膜系统的影响,从而阐明BRs提高植物抗寒性的原初生理机制.
2 材料与方法
2.1 材 料
高山离子芥取材于新疆天山乌鲁木齐河源区,悬浮细胞的培养参照Guoetal.的方法[17].
2.2 方 法
2.2.1 悬浮细胞的处理 将悬浮培养好的处于指数生长期的同一批材料转接于加入0.05 mg/L表油菜素内酯(24-epibrassinolide, EBR)的MS液体培养基中,常温处理3 d后,立即置于4 ℃低温光照培养箱中摇床培养处理1~5 d,摇床转速为120 r/min,每天取样一次,以不加EBR的细胞为对照.研究BRs对CbCOR15基因表达的影响时取样时间为低温处理1 h、3 h、6 h、9 h、12 h、24 h、48 h、72 h、96 h和120 h,以不加EBR的细胞为对照.除处理时间外,其它环境条件均一致.处理结束后,按照Ishikawa等提供的方法用400目双层筛网过滤细胞[18],蒸馏水清洗3遍,用滤纸吸干表面水分,鲜样称重,测定以下各指标.
2.2.2 生理指标测定 离子渗漏率的测定参照Rapacz的方法[19].膜脂过氧化程度用MDA含量表示,其测定参照李合生的方法[20].膜脂脂肪酸的双链指数(Double bond index, DBI)是反映膜脂脂肪酸不饱和程度的综合指标.膜脂的提取,脂肪酸含量的测定,DBI的计算均参照李合生的方法[20].质膜的提取纯化和质膜H+-ATPase活性的测定参照张志良等人的方法[21].质膜K+-ATPase活性的测定参照乙引等人的方法[9].质膜Ca2+-ATPase活性的测定参照李新民等人的方法[22].质膜Mg2+-ATPase活性的测定参照王精明等人的方法[13].
2.2.3CbCOR15基因的表达分析 采用Trizol法提取总RNA,以总RNA为模板,用引物oligdT进行反转录得到相应的cDNA.根据高山离子芥CbCOR15基因(基因登记号:EF208112)设计特异引物:上游引物:5′-CGCAAGAAGTCGTCGTT-3′,下游引物:5′-GTGGCATCCTTAGCATCT-3′.同时根据已知的高山离子芥Actin基因(基因登记号:AY825363)设计特异引物作为内参,来调节每个样品中的RNA含量.上游引物:5′-ATACGCTCTTCCACACGCTATTC-3′,下游引物: 5′-TCACGATTTCACGCTCTGCT-3′.按SYBR Premix Ex Taq(TaKaRa)操作手册的要求在Multicolor Real-Time PCR Detection System)(Bio-Rad)上进行实时荧光定量PCR检测.高山离子芥CbCOR15基因的扩增程序为95 ℃预变性10 s,95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸20 s,共进行40个循环.高山离子芥Actin基因的扩增程序为95 ℃预变性10 s,95 ℃变性5 s,59 ℃ 退火及延伸20 s,共进行45个循环.以梯度稀释的cDNA为模板,进行与样本条件相同的实时荧光定量PCR反应,电脑会通过软件自动绘制标准曲线.
2.2.4 数据分析 所有实验至少重复三次,用SPSS19.0对数据进行统计和方差分析,用Origin9.0绘制数据图.
3 实验结果
3.1 低温胁迫下,EBR对离子渗漏率的影响
离子渗漏率是直接反映细胞膜透性的指标,如图1所示,低温处理导致没有经过EBR处理的细胞内电解质大量外渗,在前2 d,其离子渗漏率明显提高,在第3~5 d又略微有所下降,但均高于常温(0 d).而EBR处理的细胞离子渗漏率明显低于对照,其变化趋势维持在一个比较稳定的状态.
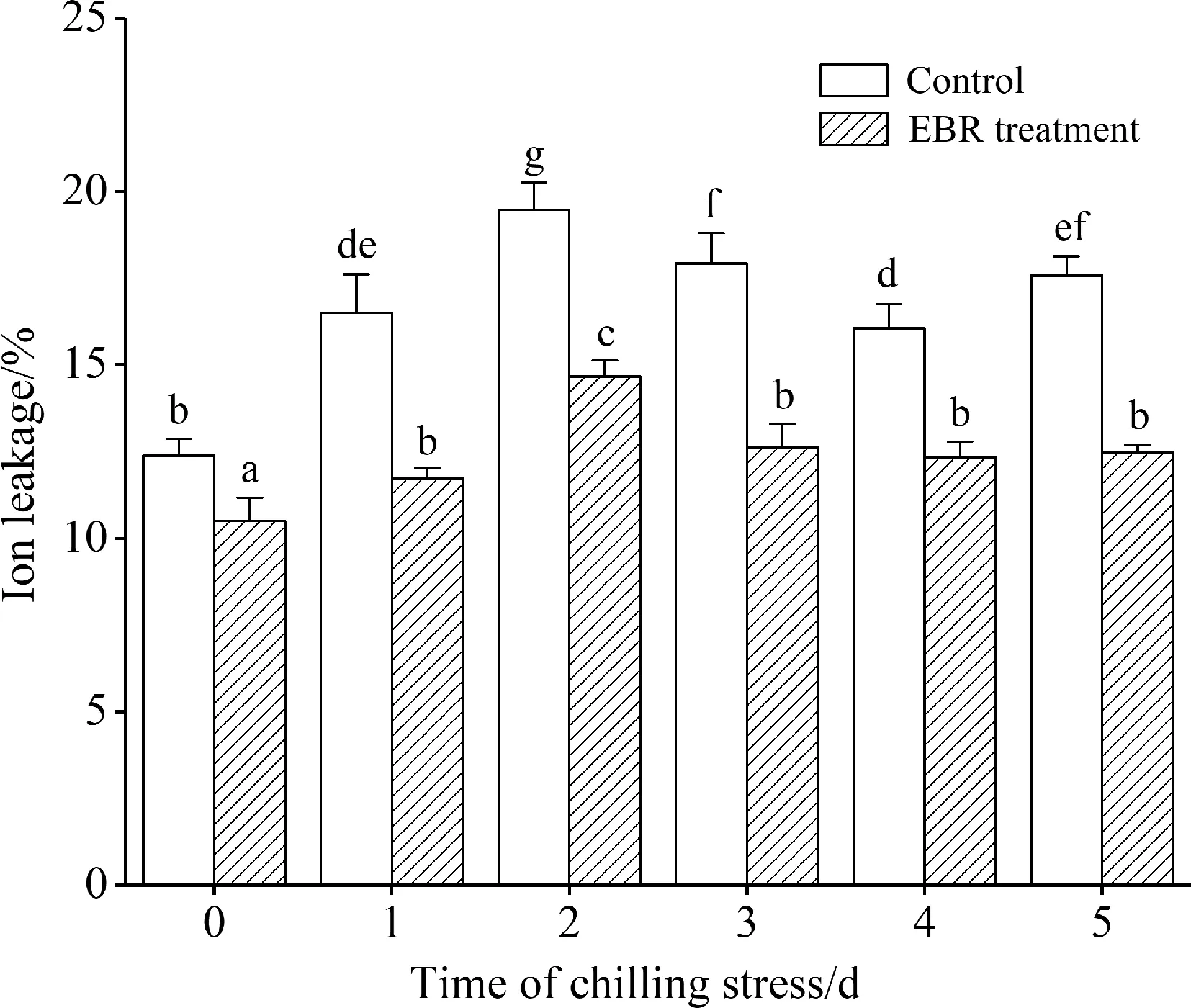
图1 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞离子渗漏率的影响
图中数据为平均数±标准差(SD).柱上不同字母表示经Duncan法检验在P<0.05水平差异显著(下同)
Fig.1 Effect of EBR on ion leakage of suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
Each value represents mean ± standard deviation (SD). Different letters on the bars indicate significant difference atP<0.05 level by Duncan test.
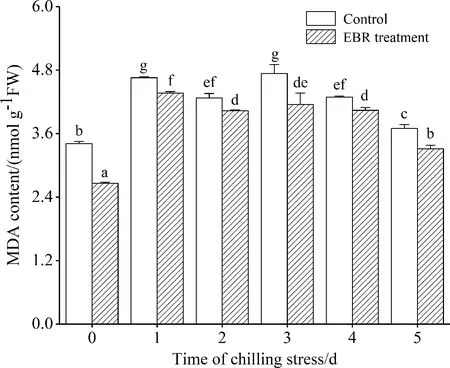
图2 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞MDA含量的影响
Fig.2 Effect of EBR on MDA content in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
3.2 低温胁迫下,EBR对膜脂过氧化程度的影响
MDA的含量反映了膜脂过氧化程度,如图 2所示,低温胁迫下,没有经过EBR处理的细胞其MDA含量在前3 d呈明显上升趋势,然后又缓慢下降,而EBR处理可以抑制MDA含量的增加,降低膜脂过氧化程度.
3.3 低温胁迫下,EBR对膜脂脂肪酸不饱和程度的影响
经过气相色谱分析,高山离子芥悬浮细胞中膜脂脂肪酸的主要组分为棕榈酸(C16∶0),棕榈油酸(C16∶1),油酸(C18∶1),亚油酸(C18∶2)和亚麻酸(C18∶3).图 3显示了4 ℃胁迫下,EBR对细胞膜脂脂肪酸DBI的影响.对照中DBI在胁迫处理前3 d略微升高,随后又呈缓慢下降趋势,而EBR处理在一定程度上提高了膜脂脂肪酸DBI,在低温胁迫第2、3、5 d时,EBR处理细胞的DBI值比对照分别提高了10.9%、8.9%、15.6%.

图3 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞膜脂脂肪酸DBI的影响
Fig.3 Effect of EBR on DBI of membrane fatty acids in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
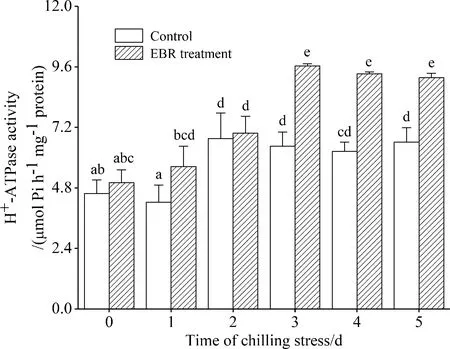
图4 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞质膜H+-ATPase活性的影响
Fig.4 Effect of EBR on the activity of plasma membrane H+-ATPase in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
3.4 低温胁迫下EBR对质膜ATPase活性的影响
3.4.1 对质膜H+-ATPase活性的影响 图4反映了低温胁迫下,EBR处理对质膜H+-ATPase活性的影响.在低温处理第1 d,对照中H+-ATPase活性略微有所下降,随后呈上升趋势,在第2 d以后呈比较平稳的状态.而EBR处理可以显著提高H+-ATPase活性,尤其在低温胁迫第3~5 d时表现得更为明显,比对照分别提高了49.3%、49.3%、38.7%.
3.4.2 对质膜K+-ATPase活性的影响 如图5所示,低温胁迫下,对照细胞K+-ATPase活性在处理第1 d没有变化,在第2 d达到最大,随后又呈明显下降趋势.而EBR处理的细胞表现出更高的K+-ATPase活性,在前4 d,经EBR处理的细胞K+-ATPase活性呈上升趋势,只有在第5 d有所下降,但比对照提高了121.9%.
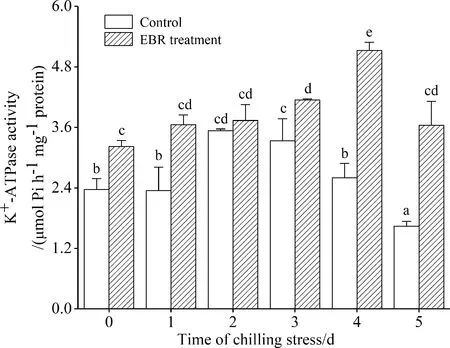
图5 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞质膜K+-ATPase活性的影响
Fig.5 Effect of EBR on the activity of plasma membrane K+-ATPase in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress

图6 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞质膜Ca2+-ATPase活性的影响
Fig.6 Effect of EBR on the activity of plasma membrane Ca2+-ATPase in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
3.4.3 对质膜Ca2+-ATPase活性的影响 图6显示了低温胁迫下,EBR处理可以明显提高细胞Ca2+-ATPase活性.在处理前3 d,对照Ca2+-ATPase活性缓慢上升,而第3 d后又明显下降.EBR处理的细胞其Ca2+-ATPase活性在前4 d呈上升趋势,在第5 d时又有所下降,在第4 d和第5 d,其Ca2+-ATPase活性要比对照分别提高86.8%和118.1%.
3.4.4 对质膜Mg2+-ATPase活性的影响 图7显示了低温胁迫下,EBR处理对质膜Mg2+-ATPase活性的影响.低温胁迫下,经EBR处理的细胞其Mg2+-ATPase活性变化趋势与Ca2+-ATPase活性的变化趋势相似,与对照相比,其活性明显升高,尤其是在处理后期即第4 d和第5 d,这种促进效应更为明显,比对照要提高75.6%和89%.

图7 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞质膜Mg2+-ATPase活性的影响
Fig.7 Effect of EBR on the activity of plasma membrane Mg2+-ATPase in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress
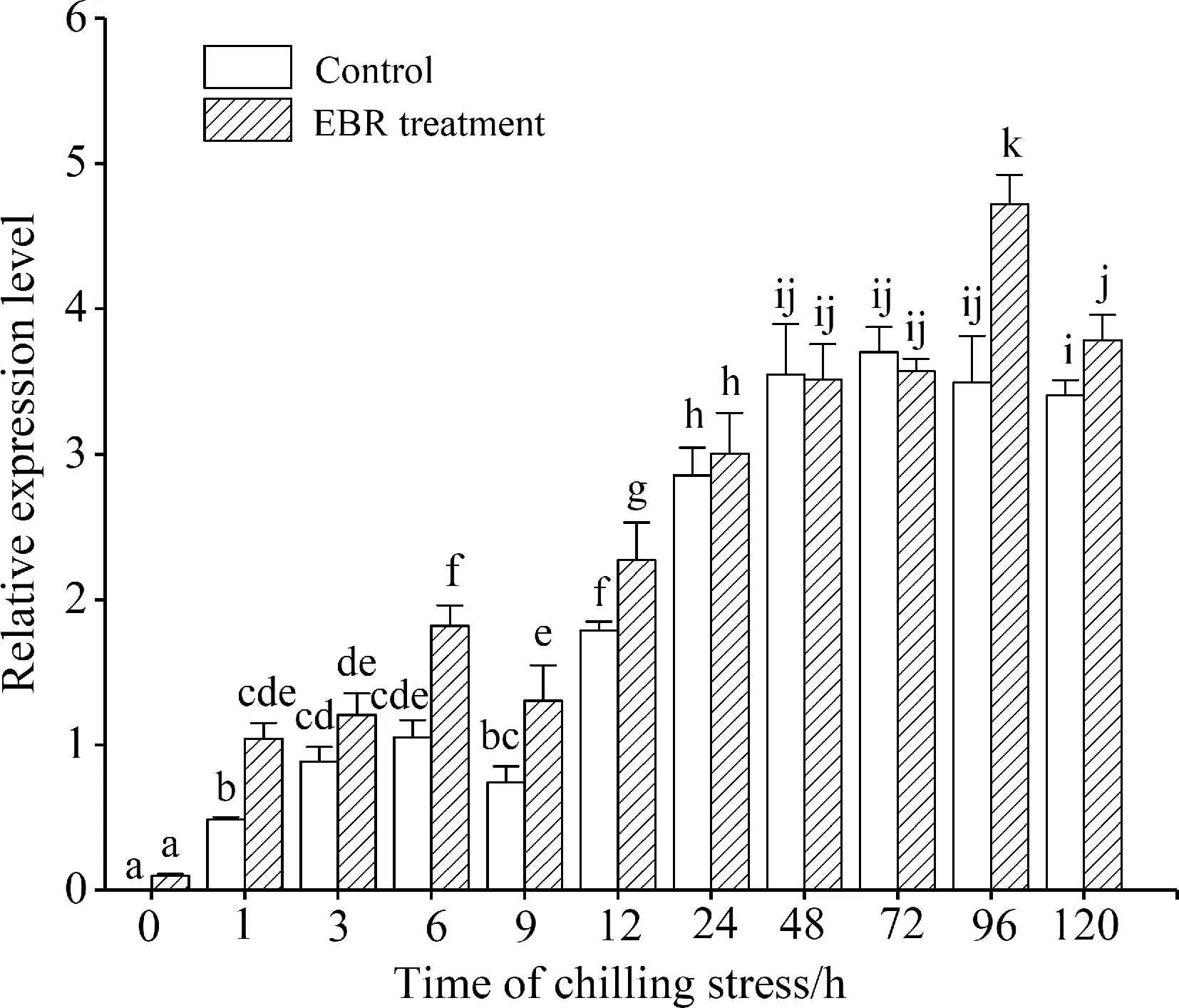
图8 4 ℃低温胁迫下EBR对高山离子芥悬浮细胞CbCOR15基因表达的影响
Fig.8 Effect of EBR on expression ofCbCOR15 in suspension cultured cells ofChorisporabungeanaunder 4 ℃ stress.
3.5 低温胁迫下EBR对高山离子芥CbCOR15基因表达的影响
低温胁迫诱导了对照细胞CbCOR15基因大量表达,在低温胁迫处理初期(1~48 h),CbCOR15表达量迅速增加,随后呈相对稳定的状态(图 8).在胁迫1~12 h时,EBR处理可以明显提高CbCOR15基因的表达量,在24~72 h时,EBR的处理效果并不明显,对照和EBR处理细胞的CbCOR15表达量没有显著差异,但在低温胁迫后期(96~120 h),EBR处理细胞中CbCOR15表达量又明显高于对照.
4 讨 论
本研究通过对细胞离子渗漏率的测定后发现,在持续低温胁迫下,EBR处理的细胞其离子渗漏率明显低于对照,变化趋势比较平稳(图 1),EBR在很大程度上抑制了低温胁迫所造成的细胞内电解质大量外渗,从而使细胞内外的离子浓度维持在一个较平衡的状态,保护细胞膜的稳定性.低温胁迫会诱导高山离子芥悬浮细胞积累较多的MDA,而EBR处理在一定程度上降低了细胞内MDA含量(图 2),从而减轻低温所造成的膜脂过氧化程度,有利于维持细胞膜正常的结构与功能.总之,EBR处理可以缓解低温胁迫对细胞膜造成的损伤,这也最直观地表明EBR可以提高高山离子芥悬浮细胞的抗寒能力.
研究表明增加膜脂不饱和脂肪酸含量,可以使细胞膜在低温胁迫下维持一定的流动性和稳定性,这对提高植物对低温的耐受性是有利的[4-5].在低温胁迫下,EBR可以在一定程度上提高高山离子芥悬浮细胞的膜脂脂肪酸不饱和程度(图 3),这说明EBR处理可以增加膜脂不饱和脂肪酸的含量,有利于细胞膜保持一定的流动性,这对维持细胞膜正常生理代谢,提高植物的抗寒性具有积极意义.推测EBR提高膜脂脂肪酸不饱和程度可能通过2条途径,一是EBR的应用可以维持低温下与脂肪酸代谢相关的酶特别是去饱和酶的活性,可能是EBR刺激了编码这些酶的基因的表达;二是直接改善膜脂的物理状态,防止其低温下发生相变.
植物在冷害或冻害中质膜H+-ATPase较其它膜上的ATPase更敏感,它们会首先发生活性的降低或丧失[23-24].在本实验中,与对照相比,EBR可以提高冷胁迫下细胞质膜H+-ATPase活性(图 4),这说明EBR可以保护质膜上的H+-ATPase,使之维持正常的生理功能.EBR提高H+-ATPase的活性可能是通过EBR促进H+-ATPase基因的表达或酶蛋白的修饰来执行的.
植物在低温胁迫下,质膜失去半透性,膜功能发生变化使得膜上与K+运输的酶系统失活,胞内K+大量向胞外渗漏.在本研究中,EBR可以在低温下提高K+-ATPase的活性,而且这种促进效应随着胁迫时间的延长表现得越为明显(图 5),可见EBR可以保护质膜K+-ATPase,维持其正常的K+运输能力,从而使细胞质中的K+浓度处于一个正常水平.
许多研究证明质膜上Ca2+-ATPase的活性与植物的抗寒力有密切的关系.Jianetal.报道在低温下不抗寒植物的质膜和核膜中Ca2+-ATPase失活,胞质内和核内Ca2+的增加不能被泵回胞外或胞内钙库,造成细胞死亡[25].冷预处理诱导水稻幼苗抗寒性的提高,可能与其能较强的维持或激活质膜和液泡膜上的Ca2+-ATPase活性有关[26].从本实验结果可以看出,低温下EBR处理的细胞Ca2+-ATPase活性显著高于没有经过EBR处理的细胞(图 6).EBR处理能较好地维持或激活悬浮细胞质膜Ca2+-ATPase活性,使细胞能更有效地把因冷胁迫刺激所升高的过量胞质Ca2+及时地运到胞外或运入胞内钙库储藏起来,从而使胞质Ca2+浓度迅速降低到静息态水平,以维持细胞生理代谢和Ca2+信使功能的正常进行.质膜H+-ATPase的活性受蛋白激酶调控,蛋白激酶活性又受到胞质Ca2+含量的影响,低温胁迫下EBR处理可以增强Ca2+-ATPase活性,从而维持细胞内正常的Ca2+浓度,这对于间接提高H+-ATPase的活性也是有利的.
王精明等人采用冷胁迫和低温锻炼两种方式处理水稻幼苗,研究低温对根质膜和液泡膜Mg2+-ATPase活性的影响[13].结果表明,冷胁迫可降低质膜和液泡膜Mg2+-ATPase活性.然而,低温锻炼可增加其冷稳定性.冷害可能首先是通过影响植物细胞膜Mg2+-ATPase活性,使之降低或完全失活,从而破坏植物的生命力.本实验中,EBR处理可以明显提高冷胁迫下高山离子芥悬浮细胞质膜Mg2+-ATPase活性,而且这种效应随着胁迫时间的延长表现的越为明显(图 7),这说明EBR提高细胞抗寒能力与质膜Mg2+-ATPase活性的增强有关.
低温胁迫可以诱导COR基因的大量表达,如图 8所示,在4 ℃胁迫初期,离子芥悬浮细胞CbCOR15基因的表达量大幅度上升.已有研究证明拟南芥AtCOR15a编码的多肽具有两亲性的α-螺旋结构域,可能通过影响膜磷脂层内部的弯曲性来减少膜遇冷时所产生的由脂双层向六角形HII相位转变的发生率,从而保护膜结构的稳定性,缓解低温对植物细胞膜造成的损伤[27].高山离子芥CbCOR15基因编码的亲水性多肽也具有类似的功能[28].而EBR处理可以明显提高低温胁迫最初期CbCOR15基因的表达水平,从而有利于在一开始就防止细胞膜六角形HII相位的产生,这对于稳定细胞膜的结构和功能,从分子水平上提高植物的抗寒性具有重要意义.
综上所述,EBR处理可以抑制低温胁迫所引起的高山离子芥悬浮细胞离子渗漏率和MDA含量的升高,提高膜脂脂肪酸不饱和程度,增强质膜H+-ATPase,K+-ATPase,Ca2+-ATPase以及Mg2+-ATPase的活性,并在胁迫最初期诱导CbCOR15基因大量表达,从而稳定高山离子芥悬浮细胞膜系统的结构与功能,保证细胞生理代谢的正常进行,以提高其抗寒能力.

