系列四氮唑乙酸基配合物的合成及对HMX热分解的影响研究
张鹤丹,卫芝贤,曹雪芳
(中北大学 环境与安全工程学院,山西 太原 030051)
0 引言
奥克托今(HMX)是硝酸酯增塑的聚醚(NEPE)推进剂中主要的氧化剂,HMX的热分解行为直接影响固体推进剂的燃烧行为[1]。传统的燃烧催化剂一般为金属及金属氧化物,它们的表面具有吸附性,可以对推进剂或其分解产物起到吸附和催化作用,进而加速推进剂的燃烧分解。但是,金属氧化物和金属复合氧化物本身并无能量,这会导致推进剂燃烧过程的能量损失。含能配合物作为固体推进剂的添加剂不仅不损失推进剂的能量,而且可以在推进剂表面上原位分解生成新鲜的微细金属氧化物,这些金属氧化物用作添加剂可大大改善NEPE的燃烧性能[2-3]。因此含能配合物作为添加剂用于固体推进剂具有非常好的应用前景。
四唑及其衍生物是在五元环上含有4个氮原子的唑类化合物,这类配体合成出的配合物含氮量高,能量密度大且其本身感度低、分解产物对环境友好,是近年来含能催化剂领域的研究热点。在过去几十年中,科学工作者基于四唑类配体合成了一系列含能配合物,并研究了它们对推进剂主要成分黑索金(RDX)、高氯酸铵(AP) 及HMX热分解的影响。卫芝贤[4]等合成的{[Bi(tza)(C2O4)(H2O)]·H2O}n和 [Fe3O(tza)6(H2O)3]NO3对AP有较好的催化作用。Chen等[2]合成出的两种镍的5,5’-偶氮四唑(AZT)含能配合物:[Ni(en)3]AZT·THF (其中en为乙二胺,THF为四氢呋喃)和[Ni(AZT)(pn)2]n(其中pn为丙二胺)对RDX、HMX和AP都有较好的催化效果。Yang等[5]用5-氨基双四唑配体合成出了3种含能配合物[Pb(bta)(H2O)]n,[PbCu(bta)2(H2O)5]·2H2O和PbCu(bta)2(其中H2bta为5-氨基双四唑),3种配合物都可以降低RDX的分解峰值,并且增加了反应体系的放热量。Li[6]等以二茂铁四唑(HFcTz)为配体合成出了系列碱金属含能配合物,这些配合物对AP和RDX都具有很好的催化作用,但并没有测试对HMX的催化效果。Gao等[5,7]以二茂铁四唑为配体合成出了一系列的过渡金属配合物,对它们的燃烧催化效果进行测试发现与Li的测试结果类似,这些二茂铁四氮唑配合物也都对AP和RDX具有明显的催化效果,但对HMX的催化效果不佳。
四氮唑乙酸Htza配体中含氮量高达43.8%(质量百分含量),具有非常高的生成焓。四唑环上的N原子和羧基O原子对于软硬程度不同的金属离子具有很好的区分度,且四唑环和羧基之间还有一个亚甲基(-CH2-),可以使羧基自由旋转,使配位模式多变,有利于构筑结构新奇的含能配合物。因此,本文以Htza为配体,以Ag+、Cu2+、Zn2+为中心离子合成了系列四氮唑乙酸的配合物,研究了它们对HMX热分解的影响,并对效果较好的配合物与HMX相容性进行了研究,为寻找NEPE推进剂中含能燃烧促进剂作了部分基础工作。
1 实验部分
1.1 药品与仪器
四氮唑乙酸,无水乙醇,AgNO3,Cu[(CH3COO)]2·H2O,Zn(NO3)2·6H2O均为阿拉丁试剂公司的分析纯。
SMART-1000X-射线单晶衍射仪(XRD),IR-84005傅里叶变换红外光谱仪,GC10联用热分析仪(TG-DSC),DSC823e差示扫描量热仪(DSC),81-2恒温磁力搅拌器,101-3电热恒温鼓风干燥箱。
1.2 合成方法
1.2.1 含能配合物[Ag(tza)]n (1)的合成
称取Htza (0.012 81 g,0.1 mmol)和AgNO3(0.021 65 g, 0.1 mmol)溶于5 mL乙醇与水体积比为1∶2的溶剂中,封口、室温静置,100 d后有无色透明块状晶体析出。用蒸馏水和乙醇清洗风干,计算其产率为80%(以Htza为基准)。元素分析C3H3AgN4O2(234.87)的理论值为:C, 15.32%; H, 1.33%; N, 23.84%; 实验值为C, 15.34%; H, 1.29%; N, 23.85%。以上提到百分比均为质量百分含量。用此方法的合成的配合物1经单晶衍射分析,与董文文[8]课题组合成结构相同。具体的晶体学参数列于表1。
董文文等用水作为溶剂,水浴80℃恒温加热0.5 h,1 d后得到了配合物1。与此方法相比,文中提到的方法没有加热,配合物在自组装的过程中耗能最小。
1.2.2 含能配合物[Cu(tza)2]n(2)的合成
称取Htza (0.012 81 g, 0.2 mmol)和Cu[(CH3COO)]2·H2O(0.019 97 g, 0.1 mmol)溶于5 mL乙醇与水体积比为1∶2的溶剂中,封口、室温静置,第2天后有蓝色针状晶体析出。用蒸馏水和乙醇清洗风干,计算其产率为45%(以Htza为基准)。元素分析的理论值为C6H6CuN8O4(317.74)理论值:C, 22.66%; H, 1.89%; N, 35.25%; 实验值为C, 22.57%; H, 1.91%; N, 35.11%。以上提到百分比均为质量百分含量。用此方法的合成的配合物2经单晶衍射分析,与余庆[9]课题组合成结构相同。具体的晶体学参数列于表1。
余庆等用水作为溶剂,调节pH=2.5,80℃下反应2 h,7 d后得到了配合物2。与此方法相比,文中提到的方法具有3个优点:1)晶体合成时间为2 d,耗时更短。2)没有加热的步骤,耗能更少。3)没有用酸碱调节pH,合成条件简单。
1.2.3 含能配合物[Zn(tza)2]n (3)的合成
称取Htza (0.076 85 g, 0.6 mmol)和Zn(NO3)2·6H2O(0.029 75 g, 0.1 mmol)溶于5 mL乙醇与水体积比为3∶1的溶剂中,封口、室温静置,183 d后有无色块状晶体析出。用蒸馏水和乙醇清洗风干,计算其产率为63%(以Htza为基准)。元素分析的理论值为C6H6ZnN8O4(319.56):C, 22.53%; H, 1.88%; N, 35.05%;实验值为C, 22.48%; H, 1.91%; N, 35.09%。以上提到百分比均为质量百分含量。用此方法合成的配合物3经单晶衍射分析,与董文文[10]课题组合成结构相同。具体的晶体学参数列于表1。
董文文课题组通过甲醇作溶剂,先合成得到β-[Zn(tza)2]n粉末,再将β-[Zn(tza)2]n粉末溶于水中,逐滴加入甲醇,最终得到配合物3。与此方法相比,文中提到的方法有2个优点:1)无须合成中间体,简化了合成步骤。2)用水和乙醇作为溶剂,较甲醇而言,试剂的毒性小。

表1 配合物1-3的结晶学参数
1.3 配合物1-3对HMX热分解影响研究
将合成的含能配合物与HMX按质量比1∶19机械混合后进行DSC测试,分析配合物对HMX热分解的影响,探讨其作为燃烧催化剂的可行性。所有样品的热分解测试都进行了两次,实验结果取其平均值。各实验样品的用量为0.5 mg。用METTLERTOLED公司的DSC823e差示扫描量热仪,在流动N2气氛中,流速为20 mL/min,升温速率为10 K/min对样品进行测试。
1.4 配合物1与HMX相容性研究
按照相容性试验方法,用热技术(DSC)研究了HMX与配合物1的相容性[11]。配合物1与HMX的混合物是用机械混合的方法按1∶1的质量比进行5 min研磨后得到。用METTLERTOLED公司的DSC823e差示扫描量热仪,在流动N2气氛中,流速为20 mL/min,升温速率分别为5、10、15 K/min对样品进行测试。
2 结果与讨论
2.1 配合物热稳定性能研究
为研究配合物1-3的热稳定性能,我们对晶体进行了TG-DSC测试,所得的TG-DSC曲线如图1所示。配合物1的DSC曲线在159.4℃出现放热峰。TG曲线在158.9℃有明显失重现象,失重率为50.3%,最终剩余残渣量为49.7%,与形成Ag2O残渣的理论值49.4%基本相同,可以认为分解最终产物为Ag2O。配合物2的DSC曲线在202.3℃出现放热峰。TG曲线表在202.1℃现出明显失重状态,失重率为74.9%,残渣的剩余量为25.1%,与形成CuO残渣的理论值25.2% 基本相同,可以认为分解最终产物为CuO。配合物3的DSC曲线在228.2℃出现放热峰。TG曲线225.4℃表现出明显失重状态,失重率约74.7%,残渣的剩余质量为25.3%,与形成ZnO残渣的理论值25.5%基本相同,可以认为其最终产物为ZnO,相关数据列于表2。
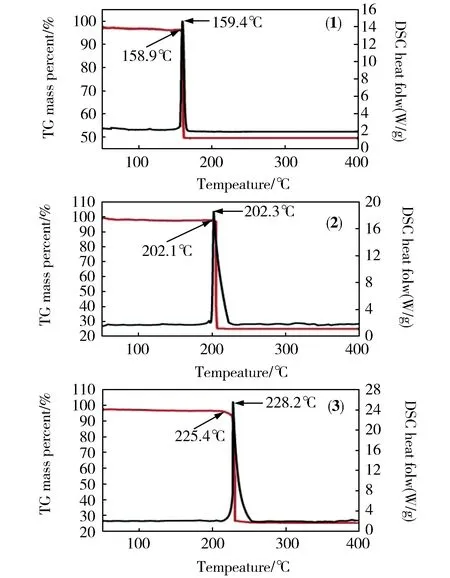
图1 配合物1-3的TG和DSC曲线图

表2 配合物1-3的分解温度和放热量
配合物1-3的TG曲线分别在158.9,202.1,225.4℃开始出现快速明显的失重过程,说明配合物构架开始垮塌,分解出新的固体产物,并释放出大量能量。随着温度继续升高,固态分子进一步分解为气体产物,在图中体现为DSC曲线走向逐渐平缓。另外对DSC曲线求积分面积得出配合物1-3的放热量分别为762.1,743.2,857.0 J·g-1。屈媛媛等[4]报道的含能配合物[Mn(tza)2]n放热量706.2J·g-1,刘传芳等[12]报道的[Zn3(C5HN10)2(H2O)2]·(H2O)在152.0℃开始分解,与之相比,文中合成的3种配合物都具有较高的放热量和分解峰,均是热稳定性较好的含能配合物。
2.2 配合物1-3对HMX的热分解的影响
为了探讨化合物1-3对HMX热分解的影响,用DSC法分别研究了纯HMX及HMX和配合物1-3混合物的热分解过程。如图2所示,纯HMX的分解过程包含两个吸热峰和一个放热峰。在194.3℃处的吸热峰为HMX的晶型转化峰,而在278.2 ℃的第二个吸热峰为HMX的融化峰。HMX融化之后很快就开始分解放热,它的放热峰的峰值为282.6℃,放热量为1 198.3 J·g-1。这个结果与之前文献所报道的HMX的分解过程基本一致[4,13-14]。
比较图2中的DSC曲线可知,加入配合物后,HMX的第一个吸热峰的位置基本没有改变,这说明配合物的加入对HMX的晶型转化温度没有影响。但配合物1-3的加入使HMX的放热峰的峰位分别降低了1.7℃、1.6℃、1.4℃,使HMX的放热量也明显增加,配合物1-3使HMX的放热量分别增加了109.8、37.7和53.1 J·g-1。具体数据见图2及表3。
从图2及表3可知,配合物对HMX分解温度影响不大,但却明显增加了放热量。配合物1-3对HMX热分解的影响可以做出如下解释:1)在HMX与1-3的混合物的热分解过程中,随着温度的升高,配合物可原位分解成分子水平上的金属氧化物。这些金属氧化物由于其高的比表面积和多的活性位点而具有更好的催化效果,导致HMX的分解峰温降低。此外,在分子水平上形成的金属氧化物还可以吸附更多的HMX及其热解产物,从而释放了吸附热[15]。2)HMX分解的主要气态产物是CH2O、NO2、CO2、NO、CO和N2O[16-17]。由于Ag2O、CuO和ZnO[18-20]可催化分解产物之间的放热反应,包括CO的氧化反应、CO和NO之间的反应,从而增加了HMX热分解的放热量。配合物1表现出最好的促进HMX热分解的效果。
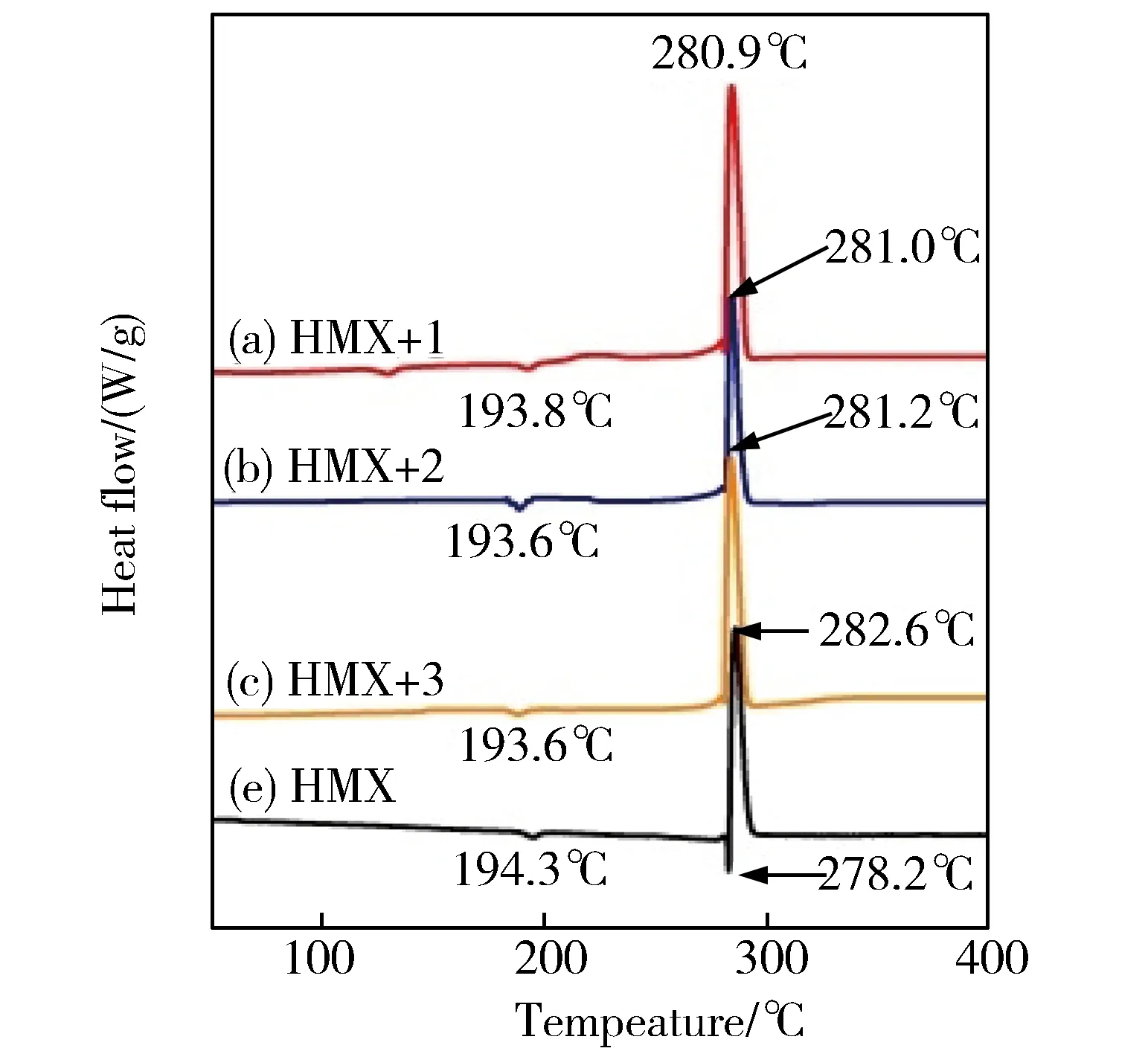
图2 纯HMX及其加入配合物1-3后的热分解曲线
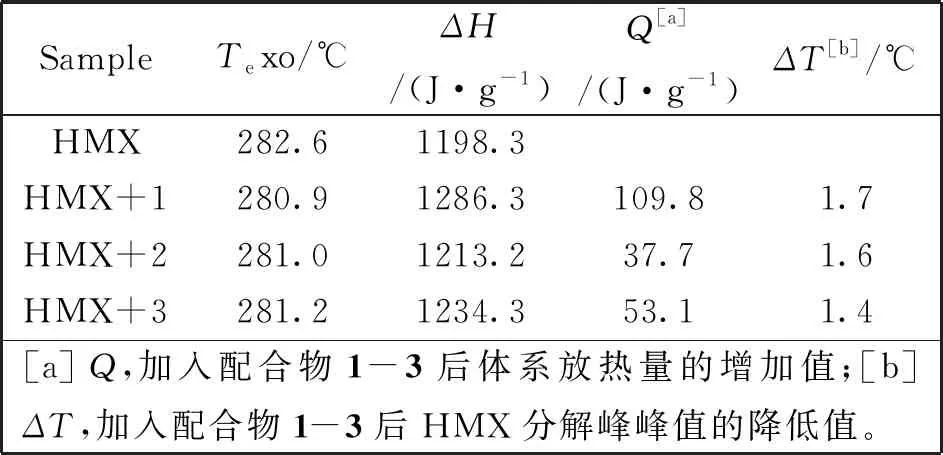
表3 配合物1-3对HMX热分解影响
2.3 配合物1与HMX相容性研究
相容性是指两种及以上的材料相互接触包覆,组成混合体系后,各组分之间彼此相互容纳,其物理、化学性质不发生显著变化的能力。较好的相容性是指组分之间不会产生不良的物理及化学反应,是评价药剂如推进剂贮存安全性与使用可靠性方面的一项重要指标[21-22]。因此,本文探讨了对HMX热分解有显著作用的配合物1与HMX的相容性。
配合物1,1+HMX,HMX在不同升温速率下的DSC曲线如图3所示,有关炸药和接触材料的相容性评价标准列于表4[3,23-25]。

图3 不同升温速率下配合物1, 1+HMX,HMX的DSC曲线

表4 炸药和接触材料的相容性评价标准
如图3所示,随着升温速率的提高,各物质的吸热融化峰峰形没有显著的变化,但分解峰值温度会依次提高。配合物1与HMX混合物(1+HMX)的分解峰(峰位)较HMX而言,在升温速率为5 K/min时降低了1.9℃,升温速率为10 K/min时降低了1.3℃,升温速率为15 K/min时降低了1.7℃,均小于2℃。根据表4中炸药和接触材料的相容性评价标准可知:配合物1与HMX具有良好的相容性。
3 结论
本文用溶剂挥发法合成了3种热稳定性好的含能化合物,配合物1对HMX的热分解表现出了良好的促进作用,且与HMX具有良好的相容性,有望在NEPE推进剂中作为燃烧添加剂使用。

