温水浸种对杜仲种子萌发过程中保护酶活性及内源激素含量变化的影响
王 宁 董莹莹 袁美丽 王亚楠 曾胜蕴
(1.河南科技大学林学院,洛阳 471023;2.洛阳市城市管理局,洛阳 471002;3.洛阳市隋唐城遗址植物园,洛阳 471002)
杜仲(EucommiaulmoidesOliver)为杜仲科(Eucommiaceae)杜仲属(Eucommia)落叶乔木,中国特有名贵药材树种,国家二级保护植物,广泛分布于我国亚热带至温带的湖南、贵州、四川、河南、山西等地[1]。我国对杜仲认识及利用的记载至少已有2 000多年历史,明代《本草纲目》更是集前朝历代之经验,对杜仲的认识系统完备化[2]。现代科学技术也已发现了杜仲珍贵的药用价值。如杜仲中的绿原酸等酚酸类物质以及环烯醚萜类物质对肝功能及肝组织再生具有明显的促进作用[3~6]。杜仲的次生代谢产物桃叶珊瑚甙、松脂素二糖甙及绿原酸等,是降血压药的主要成分,丁香素二葡萄糖甙具有增强记忆力、安定镇静以及降低胆固醇等功效[7~8]。除了拥有较高的药用价值,杜仲还是世界上重要的胶源植物。杜仲胶在国际上被称为巴拉塔胶或古塔波胶[9],作为天然橡胶的同分异构体,已成为天然橡胶最佳的天然高分子材料替代品[10~11]。此外,杜仲也是较好的用材树种,并作为优良观赏植物被广泛应用于城市园林绿化。
播种育苗是杜仲苗木生产的主要方式之一,但至今有关其种子休眠及萌发的相关研究并不多。林坚[12]、申延[13]等研究认为,对萌发温度的敏感性及来自果皮胶质的机械束缚是限制和阻碍杜仲种子萌发而导致其休眠的主要原因。吴楚材等[14]研究发现,混沙湿藏及20~25℃的温度最适宜杜仲种子发芽。邹仁双[15]研究得出,50℃温水、赤霉素等植物生长调节剂浸种均能明显提高杜仲种子发芽率。至今为止,有关杜仲种子萌发进程中有关酶活性及内源激素含量变化的研究尚未见有报道。种子萌发过程中伴随着如呼吸代谢作用、贮藏物质的代谢及转化等一系列复杂而有序的生理变化,探讨参与这些生理活动的酶及内源激素的变化,可为杜仲种子萌发及出苗相关机理的研究提供参考,同时也为种子萌发不同阶段采取有效的针对措施,从而为提高其出苗率提供科学依据。
1 材料与方法
1.1 材料
2018年10月,供试种子来源于河南省伊川县杜仲种植基地。试验在河南科技大学园林植物实验室进行。试验前将种子倒入盛有自来水的盆中,充分搅拌后静止8~10 min,除去浮种,将沉底种子捞出并清水洗净,晾干备用。
1.2 方法
1.2.1 种子萌动处理
参照邹仁双[15]研究,对杜仲种子进行室温(CK)、40℃、50℃、60℃和70℃ 5个梯度恒温条件下(浸泡烧杯置于水浴锅内)24 h的浸种处理。将浸泡过并已晾干的种子进行5% NaClO溶液中消毒10 min,随后蒸馏水冲洗3次,滤纸吸去种子表面多余水分。采用培养皿滤纸法进行萌发试验,将处理好的种子均匀排列在铺有双层滤纸的培养皿(直径9 cm)内,10粒·皿-1,每处理5次重复,置于昼/夜为25℃/20℃及光暗比为12 h/12 h的光照培养箱内培养。萌发试验共进行15 d。每天统计种子萌发数(胚根长度为种子长度的1/2视为萌发),并定时补充蒸馏水保持滤纸湿润。试验结束后统计种子发芽率及发芽势。其中:
发芽率(Germination Rate,GR/%)=(萌发种子数量/供试种子数量)×100%
(1)
发芽势(Germination Energy,GE/%)=(从开始至发芽高峰的萌发种子数量/供试种子数)×100%
(2)
1.2.2 萌发生理生化指标测定
分别取室温(CK)和50℃温水浸种处理种子在培养的第0(CK)、3、6、9、12、15 d取样进行相关生理指标测定。参照参考文献[16~17],氮蓝四唑光还原法测SOD活性,愈创木酚法测定POD活性,硫代巴比妥酸法测定MDA含量。此外,采用酶联免疫法[16](Enzyme-linked Immunosorbent Assay,ELISA)测定内源激素赤霉素(GA3)、生长素(IAA)、脱落酸(ABA)、玉米素核苷(ZR)的含量,并分别计算GA3/ABA、IAA/ABA和ZR/ABA的比值。
1.3 数据处理
采用SPSS18.0统计分析软件对种子萌发、生理及内源激素等指标进行单因素方差分析,Duncan’s法检验其差异显著性。利用Excel制作图表。统计值以平均值±标准误差(Mean±SE)表示。
2 结果与分析
2.1 温水浸种对杜仲种子萌发的影响
从图1中可知,与室温浸种处理相比(CK),温水浸种能一定程度上提高杜仲种子的发芽率及发芽势,但随着水温的持续升高发芽率及发芽势又呈逐渐下降的变化。其中,以50℃温水浸种处理的发芽率及发芽势为最高,分别达到84.67%和43.50%,且均显著高于CK(P<0.05)。
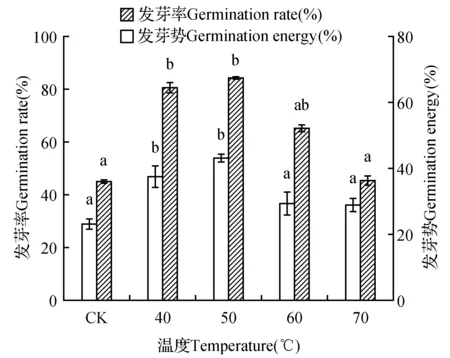
图1 不同浸种温度对杜仲种子发芽率及发芽势的影响 不同字母表示不同温度处理间差异显著,下同。Fig.1 Germination rate and germination energy of E.ulmoides by soaking seed at different temperature Different letters indicate significant different among different temperature treatment(P<0.05),the same as below.
2.2 杜仲种子萌发过程中生理特性的影响
2.2.1 保护酶活性及MDA含量
从图2可知,萌发进程中,杜仲种子内SOD及POD活性均呈不断增加的变化,且从第3天开始,50℃温水浸种处理中的SOD及POD活性均明显高于室温浸种处理。至第3天时,50℃温水浸种处理的SOD活性与CK差异显著,而室温处理则在第6天时与CK差异显著(P<0.05);50℃温水浸种处理的POD活性在第3天时与CK差异显著,而室温处理则在第15天时与CK差异显著(P<0.05)。

图2 杜仲种子萌发过程中SOD及POD活性的变化Fig.2 The change of SOD and POD activity in the germination process of E.ulmoides seeds
杜仲种子内MDA含量随萌发进程呈持续下降的变化(见图3)。室温浸种处理的MDA含量在第9天时与CK差异显著,而50℃温水浸种处理则在第3天时与CK差异显著(P<0.05)。从第3天开始,50℃温水浸种处理中的MDA含量均明显低于室温处理。

图3 杜仲种子萌发过程中MDA含量的变化Fig.3 The change of MDA content in the germination process of E.ulmoides seeds
2.2.2 内源激素
2.2.2.1 内源激素含量
从图4可看出,萌发进程中,50℃温水及室温浸种处理中杜仲种子内源GA3、IAA和ZR含量均呈不断增加的变化,而ABA含量则呈持续下降的变化。

图4 杜仲种子萌发过程中内源激素含量的变化Fig.4 Changes of endogenous hormone contents in the germination process of E.ulmoides seeds

图5 杜仲种子萌发过程中内源激素含量比值的变化Fig.5 The proportion of endogenous hormone contents in the germination process of E.ulmoides seeds
其中,50℃温水浸种处理种子内源GA3、IAA和ZR含量均在萌发的第3天时较CK增加达到显著水平(P<0.05);而室温浸种处理种子内源GA3含量至第12天时与CK差异显著(P<0.05),内源IAA和ZR含量则均在第9天时与CK差异显著(P<0.05)。50℃温水浸种处理种子内源ABA含量第3天时较CK下降达到显著水平(P<0.05);而室温浸种处理种子内源ABA含量至第6天时与CK差异显著(P<0.05)。
2.2.2.2 内源激素含量比
从图5可知,萌发进程中杜仲种子内源GA3/ABA、IAA/ABA及ZR/ABA值均呈持续增加的变化。其中50℃温水浸种处理种子内源GA3/ABA、IAA/ABA及ZR/ABA值均在至第3天时与CK差异达到显著水平(P<0.05),而室温浸种处理种子内源GA3/ABA值在第12天时与CK差异显著,IAA/ABA及ZR/ABA值则均在第9天时与CK差异显著(P<0.05)。此外,从第3天开始,50℃温水浸种处理的GA3/ABA、IAA/ABA及ZR/ABA值均明显高于室温浸种处理。
3 讨论
种子的休眠及萌发是植物维持生存及适应环境变化的重要特征[18~19]。种子的破眠及萌发进程中,内源激素通过调节一系列蛋白及酶的代谢,对种子内各种生理变化做出反应,进而调控种子的休眠与萌发。
3.1 温水浸种对杜仲种子萌发的影响
适宜的温水浸泡有利种子的破眠及萌发[20~22]。本研究发现,不同水温的浸种处理一定范围内均能不同程度提高杜仲种子的发芽率及发芽势。与CK相比,随着浸种水温的增加,发芽率及发芽势均呈先升后降的变化趋势。温水浸种可以一定程度上促进种子萌发,这与其软化种皮、增加种皮透性有关,而之后随着水温的持续升高,种子的发芽率及发芽势又均呈下降的变化,这可能是由于已进入吸水膨胀期的种子,依然处于水温较高的环境中可能对种胚造成一定的伤害,以至部分种子死亡,最终导致发芽率及发芽势的下降。此结果与蒙古黄芪(AstragalusmembranaceusBge. var)[21]、苦豆子(SophoraalopecuroidesL.)和苦马豆(Swainsoniasalsula(Pall.) DC.)[22]的研究结论相符,也与邹仁双[15]的研究结论一致。
3.2 杜仲种子萌发过程中保护酶活性及内源激素含量变化
3.2.1 保护酶活性及MDA含量变化

MDA是植物质膜受伤害程度的重要反映指标,而膜系统的变化则会对种子生活力造成一定影响[27]。本研究中,50℃温水浸种处理中杜仲种子内MDA含量明显低于室内浸种处理,且随萌发进程呈不断下降的变化。由此表明,50℃温水浸种处理由于提高了种子内保护酶活性,从而减轻了质膜氧化损伤程度,致使MDA含量的持续下降,最终达到促进种子萌发的效果。
3.2.2 内源激素含量的变化
种子萌发与其内源激素含量的变化密切相关,各种激素能够启动种子内贮藏物质的分解及合成并最终诱导种子的萌发[28]。在有关内源激素对种子萌发及萌发调控的研究中,最为经典的是1975年Khan提出的“三因子学说”[29],即萌发抑制物ABA与萌发促进物GA3、CTK之间的相互作用决定着种子的休眠及萌发。GA3通过提高各种酶活性加速种子内部物质的分解与合成,从而促进种子的萌发[30]。而ABA则具有拮抗GA3的作用,通过抑制核酸的正常代谢及干扰核糖核酸的合成,造成种子不能进行正常的代谢活动,最终导致种子的休眠[31~32]。本研究中,50℃温水浸种处理种子内源GA3含量明显高于室温浸种处理,这可能是由于温水浸种造成种子内部更多束缚态GA3逐渐转变为游离态,最终导致了内源GA3含量的增加。而50℃温水浸种处理种子内源ABA含量却明显低于室温浸种处理,且随萌发进程呈不断下降的变化。由此表明,温水浸种处理在提高种子内源GA3增加的同时,并降低了内源ABA含量,从而促使种子朝向有利于萌发的方向发展。IAA与种子休眠的关系存在不同的研究结论。有的研究认为,IAA对种子休眠的解除具有促进作用[33],但也有研究认为IAA含量与种子休眠解除的关系不大[34]。ZR对种子萌发抑制物具有拮抗作用,一定程度上与种子休眠性呈负相关[35]。本研究中,50℃温水浸种处理种子内源IAA及ZR含量均高于蒸馏水处理,再次表明温水浸种提高了种子内促进种子萌发的内源激素含量,从而有利杜仲种子萌发。
相对于单一内源激素,不同激素间的平衡变化对种子休眠和萌发具有更重要意义,尤其是促进与抑制生长激素之间的比例[18,36]。本研究中,50℃温水浸种处理杜仲种子内源GA3/ABA、IAA/ABA和ZR/ABA值均随萌发进程呈不断增加的变化,且均明显高于室温浸种处理,这表明温水浸种处理在提高种子内促进生长激素含量的同时,降低了抑制生长内源激素的含量,最终促进杜仲种子的萌发。

