荧光导航系统联合术中超声在精准腹腔镜肝肿瘤切除术中的应用
张新龙,刘杰
(1.新疆阿克苏地区第一人民医院 普外科,新疆 阿克苏 843000;2.浙江省人民医院 肝胆胰微创外科,浙江 杭州 310000)
肝脏肿瘤的治疗已步入微创时代,在大的腔镜中心全腹腔镜肝切除术占各类肝切除手术的比例已超过75%[1]。但腹腔镜在肝脏肿瘤手术中也存在缺少触觉感知及视野受限的缺点,常常因无法定位肝脏内在的微小肿瘤造成漏检,同时在边界不清肿瘤的局部切除中易造成肿瘤组织残留而导致术后肿瘤的复发。现阶段,术中超声以及吲哚菁绿(ICG)荧光导航技术在腹腔镜肝脏肿瘤切除术中发挥了越来越重要的作用[2],有助于发现微小肝脏肿瘤及难以鉴别的卫星病灶,对其进行精确定位,实时监控切缘,提高了肝癌手术的精准度及安全性。本文收集了12例浙江省人民医院2019年3月至2019年5月期间应用荧光导航系统联合术中超声完成的腹腔镜肝肿瘤切除术病例资料,现将治疗情况总结如下。
1 资料和方法
1.1 一般资料
12例荧光导航联合术中超声进行肿瘤定位及精准切除的腹腔镜肝肿瘤切除术,其中男5例,女7例,年龄45~79岁,平均(63.2±10.4)岁;术前Child-Pugh分级为A~B级,15 min ICG滞留率为2.1%~18.3%。疾病类型:原发性肝癌9例,转移性肝肿瘤3例;既往有肝肿瘤手术史5例,肝硬化患者8例。
1.2 ICG使用方法
所有患者术前5~7 d行ICG滞留率实验,按0.5 mg/kg体重静脉注射ICG,术中对直径>0.5 cm荧光结节均予以切除,肿瘤切除过程中取荧光及腹腔镜超声显示肿瘤外>1.0 cm处划出预切线,根据术前影像学检查及术中超声定位在荧光导航下修正预切线,术中腹腔镜超声标记肿瘤周围大血管情况。
1.3 手术方法
患者气管插管全身麻醉,体位根据肿瘤位置调整,肿瘤位于II~V段患者采用头高脚低平卧位,位于VI、VII、VIII段采用头高脚低左侧45°卧位。常规四孔或五孔法,观察孔一般位于脐下,但对于右后叶肿瘤,观察孔会偏脐部右侧3~5 cm,操作孔根据肿瘤部位略有调整。进腹后常规预置8号导尿管于第一肝门处,出血较多时行采用Pringle法第一肝门阻断,松解腹腔粘连,游离肝脏便于肿瘤显露及切除。腹腔镜下荧光显影观察肝脏,对于可直接显影的肿瘤,明确位置后超声定位肿瘤边界及周围大血管情况,根据术前相关检查及术中荧光联合超声定位下标记预切线。术中使用超声吸引装置(CUSA)、超声刀、电刀在荧光导航系统下沿预切线切除肿瘤,并根据荧光显像实时调整肝脏切面。对于位置较深的肿瘤,先予术中超声定位确定肿瘤位置、边界及周围血管情况,在肝脏表面标记,然后在荧光导航下按标记剖开肝脏或深挖进入肝实质内直至荧光显像的肿瘤处以保证切缘。然后由脐下完整取出标本,解剖标本,确定切缘距离,并再次行荧光导航系统下明确肿瘤荧光显影情况,术后常规病理检查。见图1。
1.4 观察指标
(1)术中术后肿瘤与荧光导航系统下显影情况;(2)术中腹腔镜超声定位肿瘤情况;(3)术后切除肿瘤病理情况;(4)术后肿瘤切缘情况。
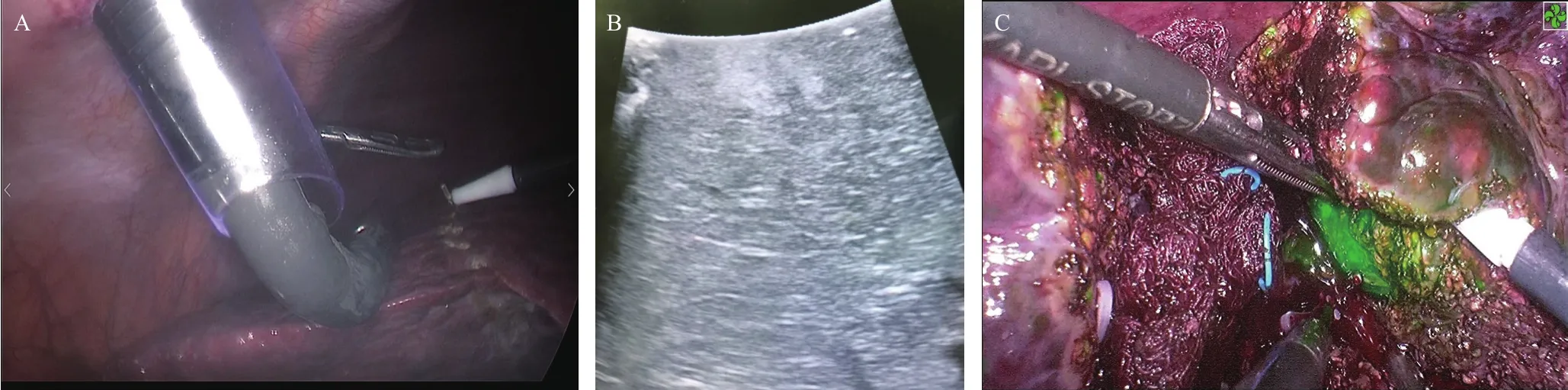
图1 腹腔镜超声联合荧光导航系统定位切除肝肿瘤
2 结果
12例均完成腹腔镜肝肿瘤切除手术,术中共发现病灶20个,术后病检提示恶性肿瘤15个(原发性肝癌10个,腺癌5个),肝硬化结节5个。术中直接于荧光导航系统下显影病灶13个,术后病理结果提示恶性肿瘤8个(原发性肝癌5个,腺癌3个),肝硬化结节5个;单独腹腔镜超声下发现病灶14个,均与术前影像学检查相符,肿瘤均为恶性肿瘤,腹腔镜下荧光显影病灶均于术中超声下显示;腹腔镜超声引导下定位肿瘤后切开部分肝脏后荧光导航系统下显影病灶6个;1例既往肝肿瘤切除术后患者1个病灶(原发性肝癌)术中荧光导航及腹腔镜超声均未发现,结合术前影像学检查切开部分肝脏组织后于荧光导航系统下显影后予以切除。术后所有肿瘤切缘均为阴性,切缘距肿瘤距离为0.8~2.5 cm,平均(1.59±0.58)cm。术后20例标本均于荧光导航系统下显影。病灶大小0.4~3.0 cm,平均(1.83±0.82)cm。
对于术中切除的20个病灶,15个恶性病灶术前相关影像学检查均有发现,而术中荧光导航系统中有5个病灶术后病检均为肝硬化结节病灶,标本取出后所有切除术的20个标本均于荧光导航系统下显影。故我们认为,荧光导航系统对于肝肿瘤的发现敏感度高,但一些肝硬化结节病灶也能显影,因此存在假阳性可能。而术中超声发现的14个病灶均为恶性肿瘤病灶,仅1例既往有过肝肿瘤切除术患者的肝脏内部肿瘤未发现(考虑术后粘连松解后,超声无法很好显影而漏检),故我们认为腹腔镜超声对于肝脏肿瘤的识别特异性优于荧光导航系统。而术中荧光导航系统联合超声对肿瘤定位后,切除过程中全程于荧光导航系统下切除术肿瘤可实时显示肿瘤位置,修正切割线,故对于保证肿瘤切缘阴性荧光导航明显优于腹腔镜超声。在手术中将腹腔镜超声及荧光导航系统联合应用能更好地对肝脏肿瘤进行定位及精准切除。
3 讨论
吲哚菁绿(ICG)在波长为760~810 nm的近红外荧光照射下能发出波长为820 nm的荧光[3],且具良好的穿透性,存在于深部组织中的ICG荧光也可被清楚地检测出来[4],荧光腹腔镜在此基础上产生的激发光能使被ICG标记的组织呈现荧光而显影。ICG其排泄主要通过毛细胆管上表达的多耐药相关蛋白完成,ICG排泄后进入胆道系统,不参与肝肠循环[5],ICG排泄完后肝脏表面及胆道内无ICG残留,于荧光导航系统下不显影。当肝脏发生癌变,病变肝组织内的毛细胆管细胞和肝细胞的分泌及排泄功能障碍,ICG则被滞留于病变的组织内,使得病变组织在荧光导航系统下延迟消失[6-7],故可以在荧光导航系统下很好地显示肿瘤的位置及边界,在手术过程中实时的荧光显像下行肿瘤切除术可达到精准手术,同时避免肿瘤残留。有研究表明,ICG介导的近红外光检测技术在肝癌手术应用过程中,可实现手术过程中实时导航,更有利于安全地切除肿瘤[8]。且有研究表明荧光导航技术在术中有助于实时初步鉴别癌灶的不同分化程度和发现微小肝脏肿瘤及难以鉴别的卫星病灶,从而提高肿瘤检出率,改善患者预后[9]。
然而,ICG荧光显像定位肿瘤也存在局限,由于近红外线的组织穿透力较低。虽然大多数肝包膜下表浅部位的肿瘤可以显示[10],但位于肝脏深部的肿瘤显像困难,lCG发出的荧光信号仅能穿透1.0 cm的肝脏实质[11],而本研究中,通过荧光导航系统直接发现的病灶为13个,有7个病灶因处于肝脏深处未显影,进一步验证了ICG在人体组织穿透力受限。同时荧光导航系统敏感性高,特异性差。Gotoh等[12]研究表明,对于肝硬化结节、肝脏不典型性增生结节等在该方法下可以显示较强的荧光,使得荧光导航系统出现假阳性,假阳性率为40%~50%。本研究中荧光导航系统直接显影的13个病灶中5个为肝硬化结节,亦显示出单独使用荧光导航系统对于肝脏肿瘤辨别存在较高的假阳性率。
术中超声在腹腔镜肝脏手术中的应用目前已较为广泛,在腹腔镜肝切除的手术中,术中超声能够明确病灶情况及肝内血管走行,确保术中没有意外血管损伤,在残留肝脏中没有肿瘤残余[13],有研究表明腹腔镜超声的应用提高了腹腔镜肝脏手术的安全性和可行性[14],相对于术中常规超声检查,腹腔镜超声可直接扫描肝脏表面减少了腹壁及气体干扰,结果更加清晰准确。结合患者术前CT及MRI检查,腹腔镜超声于术中引导手术,有助于术者及时调整肝实质离断的方向和深度,在保证肿瘤阴性切缘的同时保护好重要的管道结构不受损伤。尤其在恶性肿瘤根治手术,应始终贯彻“No-touch原则”。术中及时调整手术切面,可以最大程度避免气腹条件下肿瘤细胞的播散和种植转移,保证治疗效果[15]。郭玉娟等[16]认为腔镜超声对肝脏肿瘤不仅具有较高检出率,可发现术前影像学检查遗漏的病灶,且在术者选择手术方案方面提供精确的病灶信息,指导手术彻底、安全及合理地实施。而相对于荧光导航,在肝硬化患者应用中假阳性率高,腹腔镜超声可避免肝硬化结节的干扰,可降低术中肿瘤检查的假阳性率,本研究中15个恶性肿瘤病灶,术中超声检出14个,且未受到肝硬化结节干扰,对于肝脏深部肿瘤切除时,术中超声可精确定位肝脏肿瘤位置,但腹腔镜超声因受肝脏切面、电凝止血焦痂等因素影响,实时导航能力不如荧光导航系统。
我们将腹腔镜超声与荧光导航系统联合应用于腹腔镜肝肿瘤切除术中,二者可以优势互补,联合定位肝脏肿瘤位置、切缘及血管走形,避免肿瘤漏诊且尽可能地减少术中不必要的损伤;切除过程中荧光导航系统实时导航,根据导航情况修正预切线,保证切缘阴性的,同时对于因严重肝硬化无法行解剖性肝切除患者可以尽可能地保留正常肝脏组织,从而使患者取得更好地预后。
综上所述,腹腔镜下的荧光导航联合术中超声技术的应用对于肝脏肿瘤的定位、精准切除及保证切缘阴性有重要临床价值。