抵挡汤在高糖、高糖波动环境下对人脐静脉血管内皮细胞能量代谢相关因子表达的影响*
任秋月,田翰林,常 柏
(1.天津中医药大学,天津 301617;2.铜仁市碧江区中医医院,铜仁 554300;3.天津医科大学朱宪彝纪念医院,天津 300134)
糖尿病大血管病变是糖尿病的主要并发症之一,糖尿病患者中,大血管病变的患病风险是非糖尿病患者的2~4倍[1]。研究表明,相比持续性高糖,高糖波动更易导致大血管并发症[2-3],目前研究机制多涉及氧化应激、炎症反应等[4-5]。腺苷酸活化蛋白激酶(AMPK)即AMP依赖的蛋白激酶,是细胞的能量变化感受器,已成为研究糖尿病及其他代谢相关疾病的核心。过氧化物酶体增殖物激活受体γ(PPARγ)共激活因子 1α(PGC-1α)是一种转录共激活因子,在线粒体生物合成和氧化、骨骼肌葡萄糖摄取方面起到调节作用,可由磷酸化的AMPK介导激活,其下调时可直接导致线粒体功能障碍。抵挡汤方出于《伤寒论》,为破血逐瘀名方。前期研究基础表明,抵挡汤可明显改善2型糖尿病患者血管内皮舒张功能,减轻2型糖尿病大鼠大血管并发症炎症反应[6-7]。因此,本研究试图通过观察抵挡汤干预对人脐静脉血管内皮细胞(HUVECs)磷酸化腺苷酸活化蛋白激酶(p-AMPK)、PGC-1α、一氧化氮合酶(eNOS)、半胱氨酸天门冬氨酸特异性蛋白酶3(caspase-3)的影响,明确抵挡汤是否对高糖波动下血管内皮细胞起保护作用,并探讨其可能机制。
1 材料和方法
1.1 试剂与仪器 DMEM培养基、胎牛血清、0.25%胰蛋白酶消化液均购于Gibco公司;青霉素/链霉素购于 Biosharp公司;p-AMPKα(Thr172)抗体、PGC-1α抗体、eNOS抗体、β-actin均购买于Abbiotec公司;超纯RNA提取试剂盒购于北京康为试剂生物科技有限公司;Annexin V-FITC/PI试剂盒购于美国碧迪公司;倒置显微镜、全自动图像分析仪购于日本奥林巴斯公司;台式低/高速离心机购于德国Eppendorf公司;荧光定量聚合酶链反应(PCR)仪购于Applied Biosystems公司;流式细胞仪购于美国碧迪公司。
1.2 药物 抵挡汤(熟大黄10 g,水蛭3 g,桃仁5 g,虻虫1.5 g)购于天津中医药大学第一附属医院药剂科,盐酸二甲双胍和辛伐他汀标准品均购买于MCE公司。
1.3 抵挡汤含药血清制备 8只大鼠,雌雄各半,适应性喂养1周后,随机分2组,对照组、抵挡汤组。采用人鼠等效剂量,抵挡汤水煎剂3 g/(kg·d)灌胃,每日1次,连续7 d,对照组给以同剂量的生理盐水灌胃。末次灌胃前禁食12 h。末次灌胃后1 h,腹主动脉采血,静置2 h,离心半径160 mm,3 000 r/min离心15 min,分离血清,经56℃,30 min灭活处理后,用 0.45 μm(或 0.22 μm)微孔滤膜过滤除菌,置-20℃保存备用。
1.4 细胞培养及分组 HUVECs由天津市内分泌研究所馈赠。复苏后用含10%胎牛血清、青霉素/链霉素的DMEM培养基,置于37℃,5%二氧化碳(CO2)无菌培养箱中培养。取对数生长期的细胞,胰蛋白酶消化后制成细胞悬液,以1×105/浓度接种于六孔板中。根据不同的培养环境分为9组:1)正常对照组(NG):5 mmol/L 葡萄糖,正常糖环境,48 h。2)高糖组(HG):25 mmol/L 葡萄糖,高糖环境,10%对照组血清,48 h。3)高糖辛伐他汀组(HG-S):25mmol/L葡萄糖24h+25mmol/L葡萄糖、10μmmol/L辛伐他汀[8]24 h。4)高糖抵挡汤组(HG-D):25 mmol/L葡萄糖24 h+25 mmol/L葡萄糖、10%抵挡汤24 h。5)高糖盐酸二甲双胍组(HG-M):25 mmol/L葡萄糖24 h+25 mmol/L葡萄糖、2 mmol/L盐酸二甲双胍[9]24h。6)高糖波动组(FG):(5mmol/L葡萄糖、25mmol/L葡萄糖每6 h交换1次,24 h后,25 mmol/L葡萄糖 24 h)。7)高糖波动辛伐他汀组(FG-S):5 mmol/L葡萄糖、25 mmol/L葡萄糖每6 h交换1次,24 h后,25mmol/L葡萄糖、10μmmol/L辛伐他汀24h。8)高糖波动抵挡汤组(FG-D):5 mmol/L葡萄糖、25 mmol/L葡萄糖每6 h交换1次,24 h后,25 mmol/L葡萄糖、10%抵挡汤24h。9)高糖波动盐酸二甲双胍组(FG-M):5 mmol/L葡萄糖、25 mmol/L葡萄糖每6 h交换1次,24 h后,25 mmol/L葡萄糖、2 mmol/L盐酸二甲双胍24 h。
1.5 蛋白免疫印迹(Western Blot) 各组加入细胞裂解液(北京索莱宝公司),离心半径125 mm,12 000 r/min、4℃离心10 min,取上清液。采用BCA蛋白定量测定试剂盒(上海碧云天公司)测定总蛋白量。取样品上样,蛋白质双向电泳(SDS-PAGE)分离,转膜,10V恒压通电80min。加I抗:抗p-AMPKα(Thr172)(1∶1 000 稀释)、抗 PGC-1α(1∶1 000 稀释)、eNOS(1∶1 000),4 ℃过夜孵育。辣根过氧化物酶(HRP)标记的特异性Ⅱ抗(1∶2 000)及 HRP 标记的生物素抗体(1∶1 000)室温下孵育1 h。配置ECL发光液(北京索莱宝公司),曝光,保存条带,灰度值分析,以β-actin为内参,对蛋白条带进行相对定量分析。
1.6 逆转录聚合酶链式反应(RT-PCR) 超纯RNA提取试剂盒提取内皮细胞中总RNA,取RNA5 μL,用1%琼脂糖凝胶进行电泳。用DNaseⅠ试剂盒(2μL 10×buffer、2 μL DNase Ⅰ、2 μL RNA、14 μL RNase-Freewater)对RNA中残留的基因组DNA进行消化,37℃孵育30 min,向每个反应管中加入2 μL 200 mmol/L EDTA,65℃保温 10 min,使 DNaseⅠ失活。HiFi-MMLVcDNA第一链合成试剂盒进行反转录,37℃孵育50 min,70℃保温10 min。反应结束后的cDNA放置-20℃保存。扩增程序为:95℃10 min,(95 ℃ 15 s,60 ℃ 60 s)×45 个循环。反应体系:0.4 μL 上游引物(10 μmol/L),0.4 μL 下游引物(10 μmol/L),10 μL 2×UltraSYBR Mixture,2 μL 模板,并加入灭菌蒸馏水至20 μL。引物序列:caspase-3上游 5’TACTGCCGGAGTCTGACTG3’下游 5’CTCCAGGAATAGTAACCAGG3’。应用 ABI 7500型荧光定量PCR仪,并采用2-ΔΔCT法,对数据的相对定量进行分析。
1.7 流式细胞术 使用冷的磷酸缓冲溶液(PBS)洗细胞2次,1×Binding Buffer缓冲液制成 1×106细胞/mL悬液,试管中加入100 μL细胞悬液,按体积加入Annexin V与PI染料,混匀,室温避光放置15 min,使用Annexin V-Biotin试剂进行检测,各试管中分别加入 1×Binding Buffer缓冲液 400 μL,流式细胞仪测定结果。
1.8 统计学方法 数据分析采用SPSS 21.0软件。计量资料采用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间两两比较若方差齐采用 LSD 法,方差不齐采用 Dunnet’s T3 法,P<0.05为差异具有统计学意义。
2 结果
2.1 Western-blot检测各组内皮细胞p-AMPK、PGC-1a、eNOS蛋白表达 与NG相比,HG组和FG组 p-AMPK、PGC-1α、eNOS 表达均下降(P<0.05),且以 FG 组最低(P<0.05)。高糖各干预组中,HG-D组 p-AMPK、PGC-1a、eNOS表达均高于 HG-S组(P<0.05),且与HG-M 组比较无统计学差异。高糖波动各干预组中,FG-D组p-AMPK、PGC-1α、eNOS表达均高于 FG-S 组(P<0.05),且与 FG-M 组比较无统计学差异。见图1。

图1 Western blot检测各组p-AMPK、PGC-1α、eNOS蛋白表达情况Fig.1 The protein expression of p-AMPK,PGC-1a,and eNOS by Western blot test in each group
2.2 RT-PCR法检测各种内皮细胞caspase-3 mRNA表达 HG、FG组caspase-3 mRNA表达明显高于 NG(P<0.05),且 FG 组最高(P<0.05)。高糖各干预组中,HG-D组caspase-3mRNA含量低于HGS 组(P<0.05),且与 HG-M 组比较无统计学差异。高糖波动各干预组中,FG-D组caspase-3mRNA含量低于 FG-S 组(P<0.05),且与 FG-M 组比较无统计学差异。见图2。
2.3 流式细胞术检测各组内皮细胞凋亡情况 与NG相比,HG组和FG组均可促进细胞凋亡(P<0.05),且以FG组凋亡率较高(P<0.05)。高糖各干预组中,HG-D 组细胞凋亡率低于 HG、HG-S组(P<0.05),且与HG-M组比较无统计学差异(P>0.05)。高糖波动各干预组中,FG-D组细胞凋亡率低于FD、FG-S组(P<0.05),且与 FG-M 组比较无统计学差异(P>0.05)。提示抵挡汤干预可削弱高糖、高糖波动对细胞的促凋亡作用,其抑制内皮细胞凋亡作用优于辛伐他汀,与盐酸二甲双胍比较无统计学差异。见图3。

图2 RT-PCR检测各组caspase-3 mRNA表达情况Fig.2 Caspase-3 mRNA expression by RT-PCR detection in each group
3 讨论
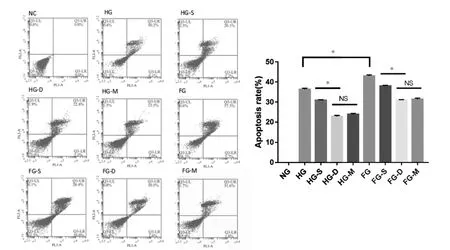
图3 流式细胞术检测各组细胞凋亡情况Fig.3 Apoptosis of cells by flow cytometry detection in each group
糖尿病大血管病变作为糖尿病慢性并发症之一,严重影响患者的生存质量,是致死、致残的主要因素。血管内皮是由血管内皮细胞通过细胞间的连接而形成的单细胞层屏障,糖尿病大血管病变中,内皮细胞是高血糖损伤的重要靶点,高血糖可导致内皮细胞损伤和凋亡,血管内皮完整性和血管功能破坏。研究显示,与无大血管并发症的糖尿病患者相比,合并大血管病变的糖尿病患者的血糖标准差、平均血糖波动幅度、最大血糖波动幅度均明显增高[10]。高糖波动较持续性高糖更易导致血管损伤,对其机制研究多涉及氧化应激、细胞凋亡、炎症、止血凝血等[11-13]。本研究显示,相比与持续性高糖环境,高糖波动环境更能损伤内皮细胞,促进其凋亡,与既往研究结果一致。
线粒体的结构和功能变化是细胞凋亡的枢纽环节,过量的活性氧簇(ROS)能引发内源性细胞凋亡途径[14-15]。线粒体作为细胞能量代谢的场所,是细胞内三磷酸腺苷(ATP)的主要生产中心。AMPK作为细胞能量代谢的主要调控者,其活性受一磷酸腺苷(AMP)/ATP比值调控,线粒体抑制、营养匮乏和运动等多种生理条件都能激活AMPK。越来越多的证据表明,AMPK是合成线粒体、维持线粒体稳态的关键调节因子,通过调节下游信号通路来维持线粒体的最佳状态[16]。AMPK还可通过促进游离脂肪酸(FFA)的氧化从而拮抗FFA造成的内皮细胞毒性,进而保护血管内皮[17]。PGC-1α是AMPK下游效应物,在能量压力下,AMPK可激活PGC-1α,通过与PPARγ或雌激素相关受体(ERRs)相互作用激活线粒体生物合成的基因,这一途径被认为可能是修复和维持血管内皮细胞线粒体功能的一项主要机制[18]。eNOS广泛存在于内皮细胞中,其激活可改善内皮和血管功能,可通过调控内皮源性一氧化氮产生的关键酶,促进细胞增殖、黏附、迁移和血管新生[19],另外在循环系统中eNOS是AMPK的一个重要靶标。Caspase家族在细胞凋亡转导通路尤其是线粒体途径中起到至关重要的调控作用,其中caspase-3在凋亡过程中占据核心地位,被称为“死亡执行蛋白酶”,其激活标志着细胞凋亡进入不可逆阶段[20-21]。
2型糖尿病大血管病变属于中医“消渴”变证,气阴两虚,阴损及阳,渐致痰浊瘀毒等病理产物积聚,络瘀脉损。而瘀血贯穿于2型糖尿病大血管病变的始终,所以治疗上把握脉络瘀阻的主要病机。抵挡汤方出于《伤寒论》,原方由大黄、水蛭、桃仁、虻虫组成,以善饮血之水蛭为君,善吮血之虻虫为臣,善破诸经瘀血之桃仁为佐,善行君令之将军大黄为使,破血逐瘀,荡涤邪热,推陈出新。研究表明,二甲双胍可阻碍细胞线粒体呼吸链复合体的电子传递过程,降低ATP合成,增加AMP水平,升高AMP/ATP比例,从而直接或间接激活AMPK[22-24]。本研究显示,抵挡汤在持续高糖和高糖波动环境下均可磷酸化AMPK,上调eNOS、PGC-1α蛋白表达,减少内皮细胞凋亡,且与盐酸二甲双胍干预无差异,表明抵挡汤可通过影响线粒体合成和能量代谢,减少内皮细胞凋亡,从而保护血管内皮,为临床破血化瘀法论治糖尿病大血管病变提供了理论依据。

