酚酸对水产品腐败希瓦氏菌的抑菌作用
朱金帅 李秋莹 于昕睿 孙 彤 励建荣
(1. 渤海大学食品科学与工程学院,辽宁 锦州 121013;2. 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
腐败希瓦氏菌(Shewanellaputrefaciens)是一种革兰氏阴性运动杆菌,具有较强的致腐败能力,是水产品的特定腐败菌之一,其生长代谢活动中能够分解肌肉蛋白,将氨基酸脱羧生成腐胺、尸胺等生物胺[1],产生H2S等臭味物质[2],其形成的生物被膜可导致水产品表面发黏。微生物的生长和繁殖是引起水产品腐败的主要因素。
酚酸是高等植物中分布广泛的一类含有酚羟基和羧基的重要次生代谢产物[3],有调查[4]显示,人体内每日摄入的酚酸是所摄入总酚含量的1/3,摄入含量为25~1 000 mg,目前许多保健品中均含有绿原酸及咖啡酸等成分,可以有效地促进血液循环、淡化黄褐斑、缓解腰酸腿痛等症状。将酚酸作为功能性食品添加剂,添加到各类啤酒和葡萄酒当中,能起到保肝护脾的作用[5]。常见酚酸如没食子酸、原儿茶酸、绿原酸等,已被应用于食品加工和保鲜等领域[6]。没食子酸作为一种较为常见的酚酸,对各种食源性致病菌如金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌和弗氏志贺菌均具有较强的抗菌作用[7]。没食子酸在体外具有抗假单胞菌的效果[8]。然而,目前尚未见没食子酸、原儿茶酸和绿原酸对水产品腐败希瓦氏菌的抑制作用的研究报道。研究拟比较没食子酸、原儿茶酸、绿原酸3种酚酸对腐败希瓦氏菌的抑制活性,并通过扫描电镜、流式细胞仪、细胞膜完整性和通透性测定研究没食子酸对腐败希瓦氏菌的抑菌作用及机制,以期为酚酸在水产品保鲜中的应用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
腐败希瓦氏菌SP22(ShewanellaputrefaciensSP22):渤海大学食品科学与工程学院实验室从腐败大菱鲆中分离获得并在-80 ℃下保藏;
LB营养琼脂培养基、LB营养肉汤:青岛高科园海博生物技术有限公司;
没食子酸、绿原酸、原儿茶酸:上海源叶生物科技有限公司;
蛋白浓度测定试剂盒:南京建成生物工程研究所;
碘化丙啶(PI)、戊二醛、PBS溶液:北京索莱宝科技有限公司。
1.1.2 仪器设备
立式高压蒸汽灭菌锅:mLS-3030CH型,日本三洋有限公司;
生化培养箱:LRH-150型,上海恒科技有限公司;
超速离心机:cs 150 gx3型,日本日立公司;
酶标仪:Victor X3型,新加坡珀金埃尔默仪器有限公司;
紫外可见分光光度计:UV2550型,尤尼柯仪器有限公司;
电子分析天平:MS105UD型,瑞士Mettler Toledo公司;
扫描电镜:S-4800型,美国BIO-RAD公司;
电导率仪:FE38-Meter型,瑞士Mettler Toledo公司;
流式细胞仪:Accuri C6 Plus型,美国BD公司。
1.2 方法
1.2.1 菌悬液制备 将贮藏于-80 ℃的腐败希瓦氏菌取出,接种于LB肉汤培养基中在28 ℃,110 r/min摇床震荡培养活化 2代,并稀释菌液浓度为105CFU/mL,备用。
1.2.2 不同酚酸的抑菌直径测定 分别配制浓度为7.5,5.0,2.5 mg/mL没食子酸(GA)、绿原酸(CA)和原儿茶酸(PA)水溶液。将2 mL菌悬液(105CFU/mL)加入到200 mL 无菌LB营养琼脂培养基中混匀,向垂直放置3个牛津杯的培养皿中倾注约20 mL,放置至LB营养琼脂彻底凝固。取出牛津杯,分别向孔中加入不同酚酸溶液200 μL,每个浓度做3个平行组。将平板倒置于28 ℃培养箱培养24 h,用游标卡尺测定抑菌圈直径大小。
1.2.3 最小抑菌浓度(MIC)及最小杀菌浓度(MBC)测定 采用微量肉汤二倍稀释法[9]进行抑菌剂MIC和MBC测定。采用LB液体培养基在96孔板中进行酚酸溶液的二倍梯度稀释,分别获得最终浓度为5.000 0,2.500 0,1.250 0,0.625 0,0.372 50,0.156 25 mg/mL的3种酚酸系列溶液。每孔接种100 μL腐败希瓦氏菌菌悬液(105CFU/mL),混匀后放入28 ℃培养箱中培养24 h。以肉眼观察,没有变浑浊的最低浓度为酚酸对该菌的MIC,每组重复3次。将无菌生长的孔中的液体吸出涂布于LB营养琼脂培养基上,培养24 h,无菌生长的浓度为酚酸的MBC。
1.2.4 生长曲线和时间杀菌曲线的测定 将没食子酸添加到腐败希瓦氏菌菌悬液(105CFU/mL)中,使其最终浓度为MIC,于28 ℃、110 r/min 条件下培养。以未添加没食子酸的菌液为对照组。每隔2 h用酶标仪测定OD595 nm值,每组重复3次,取平均值,绘制腐败希瓦氏菌生长曲线。每隔2 h吸取各组培养液200 μL,进行平板活菌菌落计数并绘制时间杀菌曲线[10]。
1.2.5 扫描电镜 取一定量已培养的腐败希瓦氏菌菌悬液,于3 000 r/min离心10 min,弃去上清液。将菌体用0.1 mol/L PBS (pH=7.4)清洗2次,于3 000 r/min离心10 min,再用PBS稀释,使菌悬液OD595 nm≈0.5。将没食子酸添加到菌悬液中,使其终浓度为MIC,置于28 ℃震荡培养(161 r/min) 12 h。以未添加没食子酸的菌液为对照组。将各组培养液于3 000 r/min离心10 min,弃去上清液,用无菌水清洗2次。将菌体与20 mL 2.5%的戊二醛溶液混匀,固定处理2 h。无菌水清洗2次后,分别在50%,70%,80%,90%的乙醇中浸泡30 min,在100%的无水乙醇中浸泡1 h进行逐级脱水。取适量菌悬液于盖玻片上,37 ℃下干燥72 h。将菌体进行喷金处理,采用扫描电镜对菌体微观形貌进行表征分析[11]。
1.2.6 细胞凋亡测定 细菌前处理参照1.2.5,置于28 ℃震荡培养(161 r/min) 12 h后,将培养液于1 000 r/min离心5 min,弃上清液,0.1 mol/L PBS (pH=7.4)清洗2次,于1 000 r/min离心5 min,弃上清液。菌体用1 mL PI染液染色,于4 ℃避光放置30 min。1 h内用流式细胞仪检测各组细胞凋亡情况[12]。
1.2.7 细菌核酸泄漏测定 细菌前处理参照1.2.5,置于28 ℃震荡培养(161 r/min)12 h后,用0.22 μm滤膜过滤菌悬液,用酶标仪测定滤液在260 nm波长下OD值,每组重复测定3次[13]。
1.2.8 细菌蛋白泄露测定 细菌前处理参照1.2.5,置于28 ℃震荡培养(161 r/min)12 h后,用BCA蛋白检测试剂盒对菌悬液蛋白浓度进行测定。
1.2.9 电导率测定 细菌前处理参照1.2.5,置于28 ℃震荡培养(161 r/min),每间隔10 min用电导率仪测定电导率,直至电导率值达到平衡值。
1.2.10 统计分析 采用Excel 2010及Origin 8.5软件处理数据和生成图表,数据为重复3次所得的平均值,用SPSS 19.0 (统计分析系统)进行统计学分析,检验数据的差异显著性,显著性水平为P<0.05。
2 结果与分析
2.1 酚酸对腐败希瓦氏菌的抑制活性
没食子酸、原儿茶酸和绿原酸对腐败希瓦氏菌的抑菌直径见表1。抑菌直径最大的为7.5 mg/mL的没食子酸,最小的为5 mg/mL的绿原酸,而2.5 mg/mL绿原酸几乎没有抑菌圈出现。3种酚酸的抑菌直径均随抑菌剂浓度的增加而增大,表明酚酸抑菌活性与其浓度呈正比。同等浓度的没食子酸、原儿茶酸和绿原酸中,没食子酸的抑菌直径均为最大,其次是原儿茶酸。表明3种酚酸对水产品腐败希瓦氏菌抑菌活性从大到小依次为没食子酸>原儿茶酸>绿原酸。
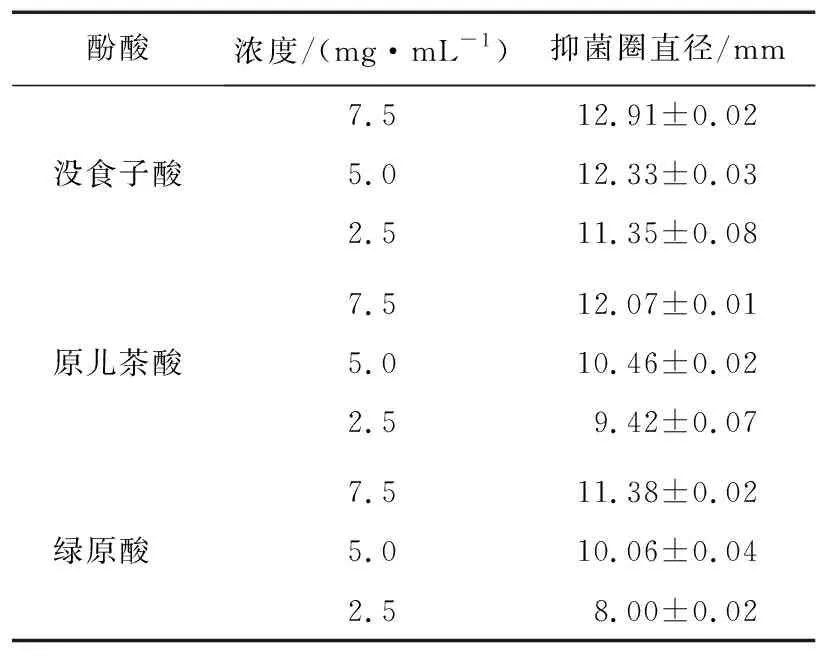
表1 酚酸对腐败希瓦氏菌的抑菌圈直径
采用肉汤二倍稀释法测定不同酚酸的MIC和MBC的数值,进一步比较各个酚酸对腐败希瓦氏菌的抑菌能力。没食子酸对腐败希瓦氏菌的MIC为1.25 mg/mL,MBC值为2.5 mg/mL,与其他两种酚酸相比,MIC和MBC值均最低(表2),表明其具有较强的抗菌活性。李建科等[14]研究了不同细菌对没食子酸的抑制效果,研究表明没食子酸对金黄色葡萄球菌、蜡状芽孢杆菌、巨大芽孢杆菌和枯草芽孢杆菌的MIC分别为2,4,4,4 mg/mL。表明没食子酸对腐败希瓦氏菌的抑菌效果比对金黄色葡萄球菌、枯草芽孢杆菌等细菌的好。
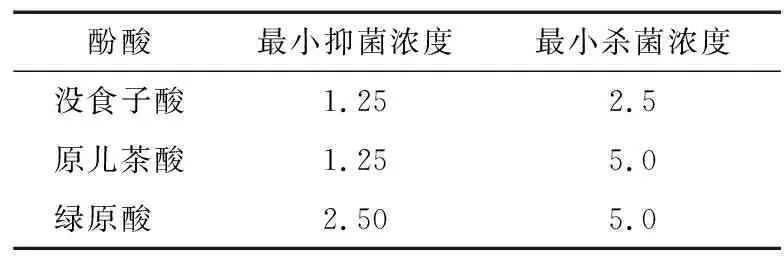
表2 酚酸对腐败希瓦氏菌的最小抑菌浓度及最小杀菌浓度
2.2 没食子酸对腐败希瓦氏菌生长曲线和杀菌曲线的影响
腐败希瓦氏菌的生长曲线见图1(a),整个培养期,对照组的腐败希瓦氏菌菌数呈逐渐增长趋势,经历了延滞期、指数生长期和稳定期[15]。而1.25 mg/mL (MIC)没食子酸处理组没有明显增长的趋势,不能进入对数生长期。表明在此浓度下,腐败希瓦氏菌的生长被完全抑制[16]。时间杀菌曲线如图1(b)所示,腐败希瓦氏菌培养过程中,对照组活菌数呈明显的上升趋势,经历了延滞期、指数生长期和稳定期,与生长曲线一致。没食子酸处理组的活菌数呈现下降趋势,表明此浓度下的没食子酸具有一定杀菌活性。结合生长曲线与杀菌曲线可说明,没食子酸在1.25 mg/mL (MIC)浓度下,活菌数量逐渐减少,能完全抑制腐败希瓦氏菌的生长。
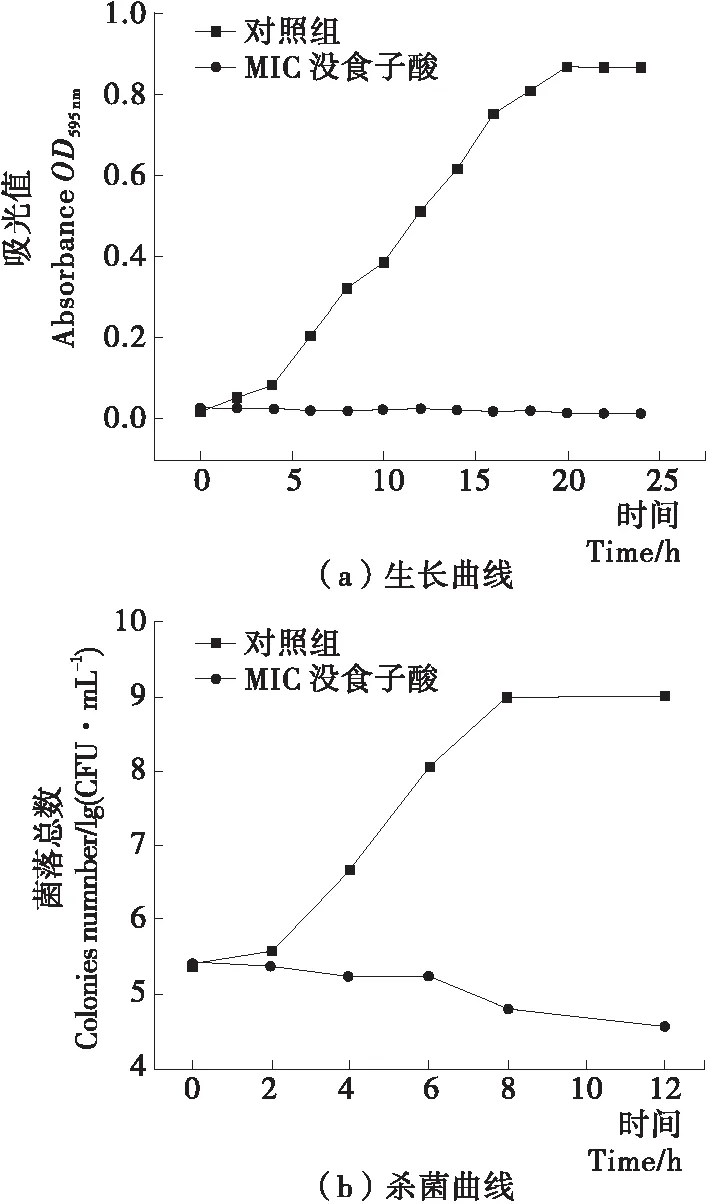
图1 食子酸对腐败希瓦氏菌的生长曲线和时间杀菌曲线
2.3 没食子酸对腐败希瓦氏菌细胞形态的影响
通过SEM观察1.25 mg/mL (MIC)没食子酸处理前后腐败希瓦氏菌细胞的形态变化。如图2(a)所示,对照组的腐败希瓦氏菌菌体完整饱满,菌体表面没有破损。而经没食子酸[图2(b)]处理细菌形貌发生变化,细胞破裂,扭曲变形,一些部位开始凹陷。可能是细胞膜破损造成细胞内容物的大量泄露,从而使细胞明显变形,粘连在一起。结果表明,没食子酸可引起腐败希瓦氏菌细胞的破损和变形,严重影响细胞正常生长,甚至造成细胞死亡。没食子酸分子结构中的酚羟基可能是其产生抑菌作用的活性基团,与细菌细胞膜上的蛋白质、脂类等发生反应,改变细菌细胞膜通透性,从而破坏细胞膜的完整性,导致细菌细胞形变[17]。
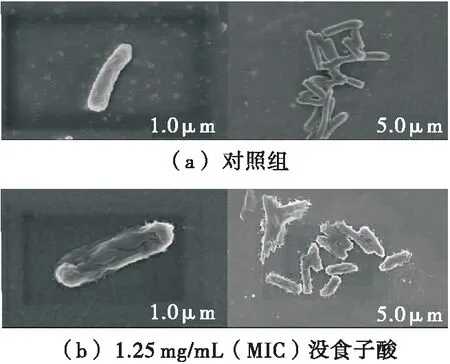
图2 没食子酸对腐败希瓦氏菌细胞形态的影响
2.4 没食子酸对腐败希瓦氏菌细胞凋亡的影响
流式细胞图分为4个区域,LL区为细胞存活,LR区为早期凋亡,UR区为晚期凋亡,UL区为细胞坏死。图3(a)为对照组流式细胞分析结果,LL区细胞存活率高达96.1%,细胞坏死率为2.5%,早期凋亡率和晚期凋亡率分别为0.6%和0.8%。由此可见,未经处理的细菌存活率非常高。经MIC没食子酸[图3(b)]处理的腐败希瓦氏菌,存活率达到78.6%,细胞坏死率为20.8%,早期凋亡率和晚期凋亡率分别为0.0%,0.6%,坏死率显著高于对照组。较对照组相比,经没食子酸作用后的腐败希瓦氏菌的凋亡率明显增大,可能是没食子酸能够破坏细胞壁膜结构,使细胞膜通透性增大。
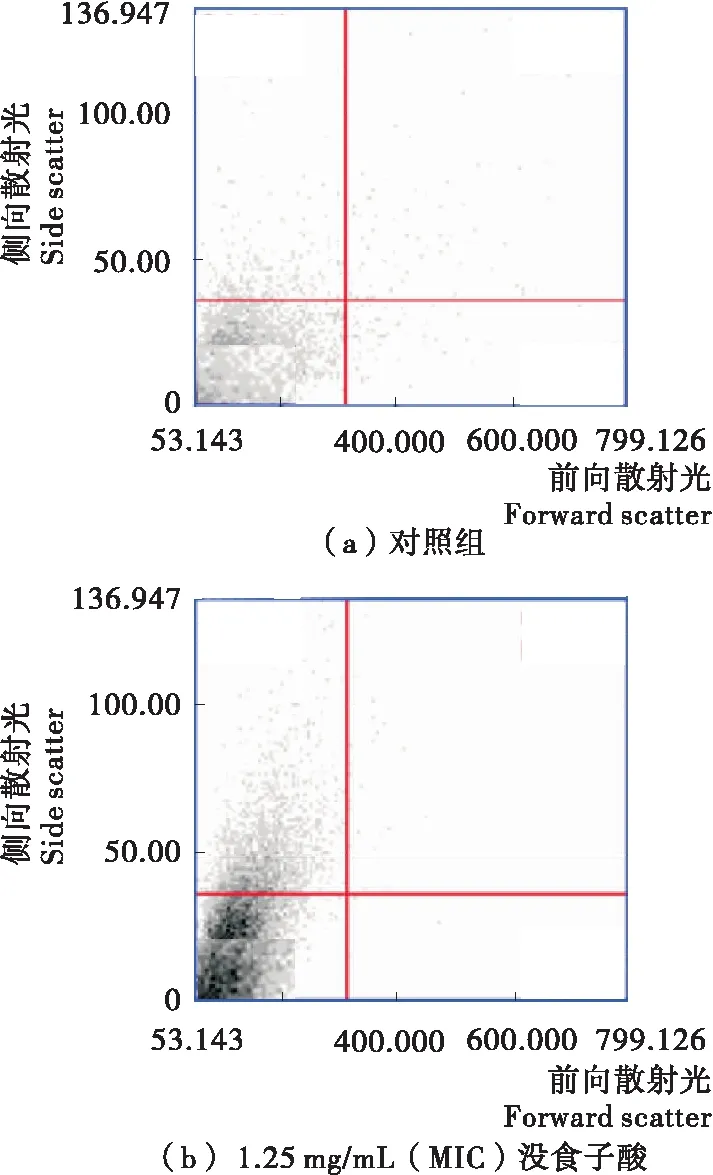
图3 没食子酸对腐败希瓦氏菌细胞凋亡的影响
2.5 没食子酸对腐败希瓦氏菌细胞膜完整性的影响
经没食子酸处理的腐败希瓦氏菌细胞中蛋白及核酸泄漏情况用于反映细菌细胞膜完整性的变化。图4(a)是1.25 mg/mL (MIC)没食子酸处理的腐败希瓦氏菌菌悬液在260 nm下的吸光值。对照组的OD260 nm为0.526,经没食子酸处理后的腐败希瓦氏菌菌悬液的OD260 nm达到1.024,显著高于对照组,表明没食子酸处理引起腐败希瓦氏菌核酸的外泄。对照组腐败希瓦氏菌菌悬液中总蛋白浓度为3.689 mg/mL,没食子酸处理后的蛋白浓度明显增加至15.841 mg/mL,表明没食子酸处理引起腐败希瓦氏菌蛋白的外泄。以上结果说明腐败希瓦氏菌的膜结构被破坏,导致细胞的内容物渗漏,进一步影响了菌体的代谢与生长。这可能是因为没食子酸具有较强的抗氧化性能,酚羟基能够提供质子,直接吸附于细胞,打破菌体原有的保护屏障,从而导致胞内物质的泄漏增加[18]。
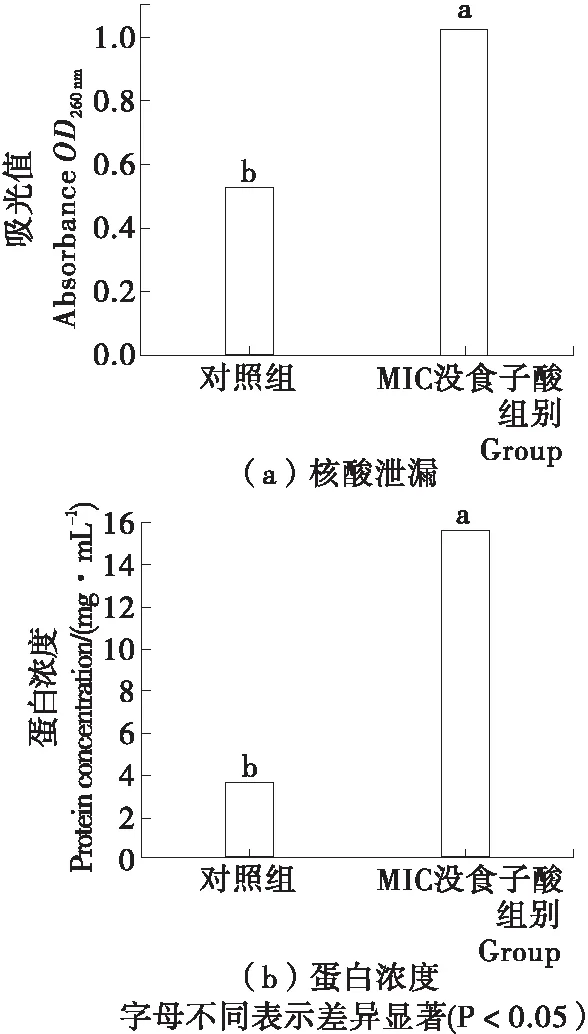
图4 没食子酸对腐败希瓦氏菌细胞完整性的影响
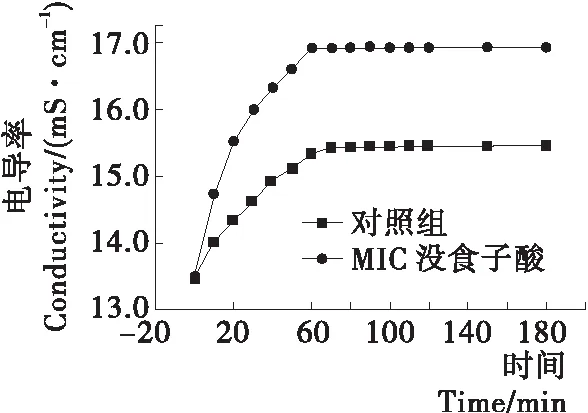
图5 没食子酸对腐败希瓦氏菌细胞膜通透性的影响
2.6 没食子酸对腐败希瓦氏菌细胞膜通透性的影响
测定1.25 mg/mL (MIC)没食子酸处理对腐败希瓦氏菌菌悬液电导率的变化,进而分析对细胞膜通透性的影响(图5)。前60 min,各组电导率均有所增加,对照组电导率从13.46 mS/cm升至15.32 mS/cm,没食子酸处理组腐败希瓦氏菌菌悬液电导率从13.46 mS/cm迅速增加至16.91 mS/cm,其电导率显著高于对照组。60 min 后,随着时间的延长,各组电导率趋于稳定。这一趋势与Li等[19]的研究结果相似,其研究发现ε-聚赖氨酸处理的大肠杆菌和金黄色葡萄球菌的电导率在培养前45 min下显著增加。结果表明,没食子酸处理使菌体的细胞膜通透性增加,导致胞内大量的电解质泄露至培养液中,电导率增加,这会影响其正常代谢,最终导致死亡[18]。
3 结论
没食子酸、原儿茶酸和绿原酸对腐败希瓦氏菌均具有较好的抑制作用,其中没食子酸对腐败希瓦氏菌的抑制作用更强,其最小抑菌浓度为1.25 mg/mL。1.25 mg/mL (MIC)没食子酸处理引起腐败希瓦氏菌细胞形态的改变,细胞膜完整性破坏,细胞膜通透性增大,核酸、蛋白质等大分子大量泄漏,致使细菌细胞凋亡率增加。没食子酸是一种具有潜在应用前景的水产品保鲜剂,后续研究可考虑探究没食子酸在水产品保鲜中的应用。

