怀菊转录组中SSR位点信息分析
邢冰 董诚明 魏硕

摘要:以转录组测序数据为基础,利用MISA软件对简单重复序列(simple sequence repeat,简称SSR)进行检测及分析,分析怀菊转录组中的SSR位点信息,并设计SSR引物,为后期SSR标记的开发和物种遗传多样性检测等提供参考。结果表明,共检测到8 553个SSR位点,它们分布在 7 369 条Unigene中,出现频率为2.83%,SSR位点的发生频率为2.44%;其中单核苷酸重复基序最多、其次为三核苷酸重复基序。怀菊转录组基序长度主要集中于 12~19 bp,多具有中等多态性。对SSR序列设计引物,共得到25 662对引物可供今后使用。总之,怀菊SSR位点类型丰富,具有良好的多态性潜力及可开发性。
关键词:怀菊;SSR;位点信息;转录组
中图分类号: S567.23+9.01 文献标志码: A 文章编号:1002-1302(2020)11-0057-04
收稿日期:2019-09-20
基金项目:2016年度中央引导地方科技发展专项资金“河南道地大宗药材种质评价及集约化种植与示范”。
作者简介:邢 冰(1995—),女,河南郑州人,硕士研究生,主要从事药用植物研究。E-mail:xingbingywz@163.com。
通信作者:董诚明,教授,主要从事药用植物研究。E-mail:dcm371@hactcm.edu.cn。 怀菊为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序[1],栽培及药用历史悠久,研究表明,经过长期的自然环境改变和人工干预,怀菊种质可能发生了变异与分化,品质下降[2]。目前关于怀菊的研究主要集中于人工栽培、组织培养、质量评价等方面,对于其种质资源和分子标记辅助育种的研究尚少[3-6]。因此,对于怀菊品种鉴别及遗传多样性的研究具有重要意义。
简单重复序列(simple sequence repeat,简称SSR)是指由1~6个核苷酸为重复单位组成的简单串联重复序列。简单重复序列能反映出物种间高度的等位基因多样性,不同物种的重复次数、基序类型、长度等差异很大,由此开发的SSR分子标记技术具有操作简便、稳定性好、多态性高等优点,已经在品种纯度鉴定、基因功能研究、遗传多样性分析等方面有广泛的应用[7-8]。转录组测序技术可开发大量的SSR标记,且速度快、成本较低[9],能够克服传统SSR分子标记技术的弊端。本研究基于高通量测序结果,获得大量怀菊转录组序列信息,并对转录组数据中的SSR位点进行检测,分析其分布及结构特点,以期为怀菊种质资源鉴定、遗传多样性分析及遗传图谱构建等提供基础。
1 材料与方法
1.1 材料
本试验中的转录组测序样本怀菊来源于河南省焦作市温县,种植于河南中医药大学药用植物园温室,采集后于河南中医药大学组织培养实验室进行离体培养得到怀菊愈伤组织、芽丛、幼苗。
1.2 方法
1.2.1 样品检测、文库构建与测序 将样品送至北京百迈客生物科技有限公司提取mRNA,分别采用Nanodrop、Qubit 2.0、Aglient 2100方法检测RNA样品的纯度、浓度和完整性等,检测合格后,进行文库构建,分别使用Qubit 2.0和Aglient 2100方法对文库的浓度和插入片段大小进行检测,使用Q-PCR方法对文库的有效浓度进行准确定量,以保证文库质量。库检合格后,利用Illumina HiSeqTM 2000 高通量测序平台对其进行转录组测序。
1.2.2 怀菊转录组SSR的筛选 采用MISA软件对组装出来的Unigene序列进行SSR检测、筛选。各重复次数搜索标准如下:单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸重复次数至少分别为10、6、5、5、5、5次。对不同SSR类型在基因转录本的密度分布进行统计。同时筛选被间隔≤100 bp 碱基间隔的复合型SSR。
1.2.3 怀菊SSR引物设计 使用Primer 3.0(235 版,默认参数)软件进行SSR引物设计,并针对预测到的每一个SSR位点分别设计3组引物供后期试验选择。主要的引物参数设置:退火温度(Tm)在57~63 ℃,上、下游引物Tm值相差小于 5 ℃;扩增产物大小为100~280 bp,引物长度为 10~27 bp;GC含量小于60%。
2 结果与分析
2.1 怀菊转录组测序结果
怀菊高通量测序后总计产出 83.67 GB 数据,干净读序经Trinity组装后最终获得302 379条Unigene,过滤后发现,质量不低于30的碱基比例(Q30,测序错误率 < 1%)为90.92%,表明测序结果良好,可对获得的数据进行进一步分析。
2.2 怀菊SSR数量与分布
采用MISA软件对Unigene进行SSR检测,共检出 8 553 个SSR位点,它们分布在7 369条Unigene中,其中有4 477条Unigene含单个SSR位点,有 2 553 条Unigene含2个及2个以上SSR位点。SSR发生频率为2.44%,出现频率为2.83%,平均每 10 kb 有1.27个SSR位点(表1)。
2.3 怀菊转录组中SSR基元类型和比例
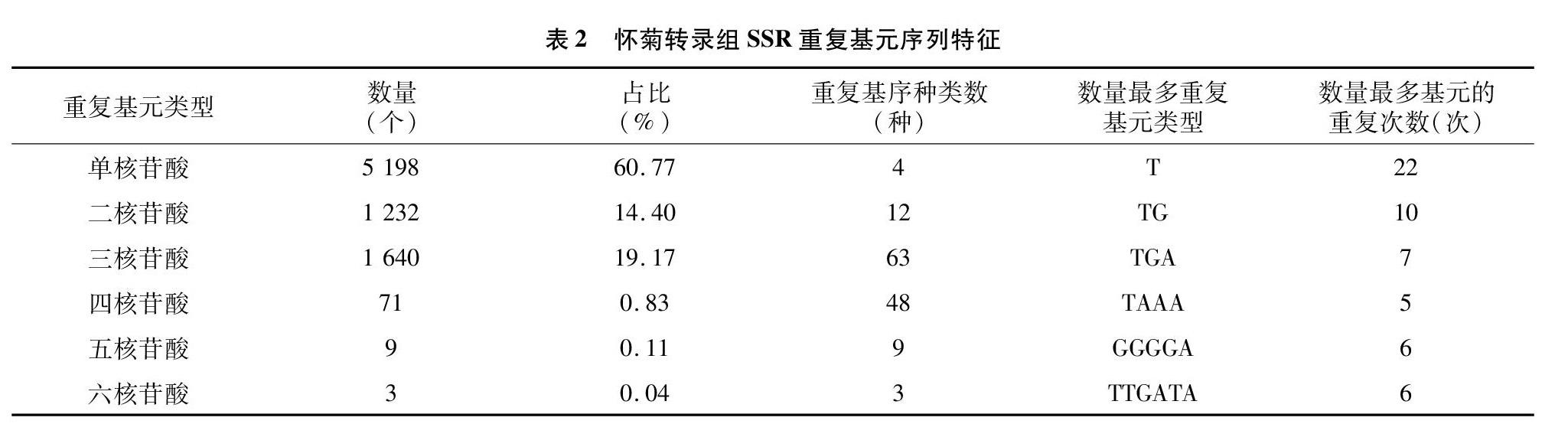
对SSR类型进行统计发现,二核苷酸至六核苷酸重复类型均有出现,不同核苷酸基序种类及重复次数差异明显。在考虑到碱基互补配对原则的情况下,单核苷酸重复单元有4种,占60.77%,多数重复次数为10~22次,主要为A/T基序重复,而 C/G 基序出现频率较低;二核苷酸重复单元有12种,占14.40%,多数重复次数为6~10次,重复次数最多的基序是TG,其次是TA;三核苷酸重复单元有63种,占19.17%,多数重复次数为5~7次,重复次数最多的基序为TGA,其次是ATC;四核苷酸重复单元有48种,占0.83%,重复次数最多的基序为TAAA,其次是TTAT;五、六核苷酸重复单元分别有9、3种,分别占0.11%、0.04%,重复次数最多的基序分别是GGGGA與TTGATA(表2)。
2.4 懷菊SSR基元长度分布及其多态性
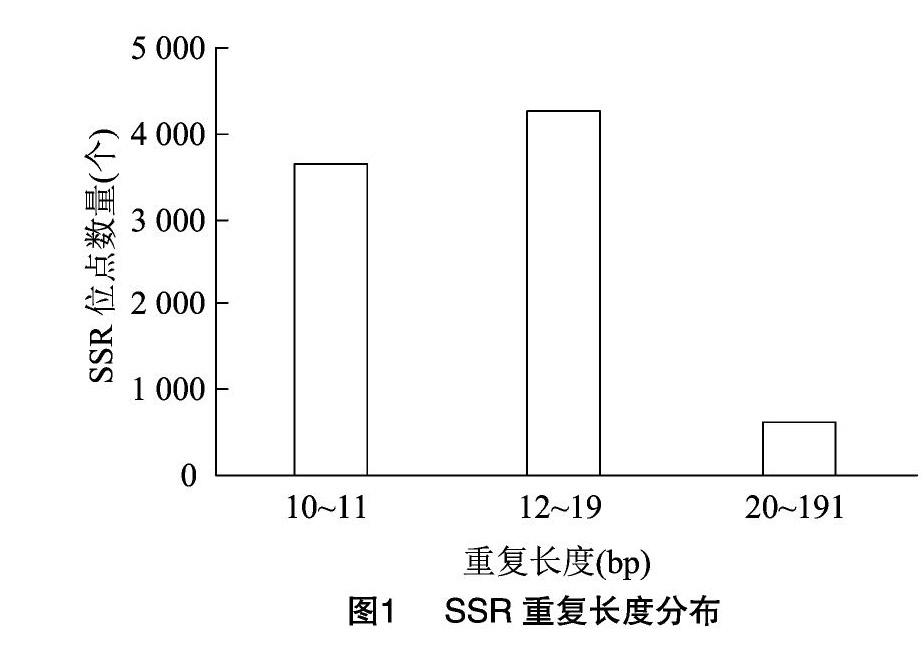
究筛选出的怀菊SSR长度均≥10 bp,其中12~19 bp 的SSR有4 279个(占比为50.03%),具有中等多态性;而≥20 bp的SSR有621个(占比为726%),具有较高的多态性。此外,研究发现,高级基元SSR的多态性普遍比低级基元的低[10]。本研究中,低级基元单核苷酸、二核苷酸和三核苷酸共占总SSR的9434%,而在长度≥20 bp的SSR中共有138个,占长度≥20bp的所有SSR的22.22%,表明大部分怀菊转录组SSR具有高多态性潜能(图1)。
2.5 怀菊SSR引物设计
为了筛选出可在试验中应用的怀菊SSR,使用Primer 3.0软件对含有SSR位点且SSR上下游序列
均不小于150 bp的unigene进行引物设计。结果根据SSR位点信息,批量设计了25 662对引物(部分引物见表3)。
3 讨论与结论
近年来,通过转录组测序技术开发分子标记已成为一种主要的方式。Han等基于转录组测序结果对野菊花SSR分子标记进行开发,并对其遗传分化等方面开展系统研究[11]。Kobeissi等使用SSR标记评估菊花遗传多样性,以利于种质资源保护和遗传育种[12]。张运兴等利用MISA软件对SSR位点进行搜索,并开发系列引物,为菊花种质资源和遗传多样性分析提供依据[13]。从本研究的结果来看,首先进行全基因组测序,再分析SSR信息,不仅可以得到更多的信息,准确性也大大提高。然而,由于不同品种的菊花之间基因组差异巨大,仅参考菊花基因组序列,并不能系统地对怀菊进行分析。本研究针对怀菊基因组进行初步组装,并进行SSR分析及引物设计,这有利于怀菊的种质鉴定,同时也对怀菊的遗传分析具有重要意义。
怀菊转录组测序后共获得302 379条Unigene,利用MISA软件进行搜索,共发现8 553个SSR位点,其中以单核苷酸和三核苷酸重复为主,占SSR总数的79.94%。张运兴等的研究表明,菊花中以三核苷酸重复类型出现频率最高[13],而本研究发现,怀菊中的单核苷酸最多,可能是由于不同植物SSR的主导重复基元类型有所不同[14-15],范三红等认为,可能是由于这种重复基元编码相应蛋白质的出现率较高[16]。同时,样品、测序技术的不同,研究中检测及评价方法的不同,也可能会造成同类型物种的SSR信息出现一定的差异。本研究发现,A/T、TGA/ATC分别是怀菊中单核苷酸和三核苷酸SSR类型的优势重复基元。有研究表明,单核苷酸中A/T重复的数量居多,而双子叶植物中三核苷酸主要重复类型是AAG/CTT[17]。张华丽等的研究表明,在万寿菊三核苷酸SSR类型中出现次数最多的重复基元是ATC/ATG[18]。初步分析这一差异可能与怀菊的SSR特性和物种的差异有关。SSR长度是影响其多态性高低的重要因素[19],本研究发现,怀菊中长度大于12 bp的SSR共有4 900个,占总数的57.29%,具有中等以上的多态性,可以重点利用这类SSR进行怀菊分子标记的开发及遗传多样性等方面的研究。
综上所述,通过检测怀菊转录组序列中SSR信息,得到数量多、可用性强的SSR位点, 对于加速怀菊SSR标记的开发、种质鉴定及遗传性状分析等研究具有重要意义。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:化学工业出版社,2005:310-311.
[2]刘晓薇,张 飞,陈随清,等. 不同商品规格怀菊花的质量特征分析[J]. 中华中医药杂志,2018,33(6):2650-2655.
[3]张红瑞,黄 勇,周 艳,等. 河南6个栽培类型药菊内在质量的研究[J]. 中药材,2017,40(7):1507-1510.
[4]张红瑞,周 艳,黄 勇,等. 采收时间对6个栽培类型药菊产量品质的影响[J]. 山东农业科学,2016,48(7):82-85.
[5]周 洲,陈双臣,陈迪新,等. 怀菊组织培养与快速繁殖[J]. 时珍国医国药,2011,22(6):1452-1453.
[6]田 硕,苗明三. 菊花的研究及应用现状[J]. 中医学报,2014,29(3):378-380.
[7]Senan S,Kizhakayil D,Sasikumar B,et al. Methods for development of microsatellite markers:an overview[J]. Notulae Scientia Biologicae,2014,6(1):1-13.
[8]Sharma R,Maloo S R,Choudhary S,et al. Microsatellite markers:an important DNA fingerprinting tool for characterization of crop plants[J]. Journal of Plant Science Research,2015,31(1):83.
[9]张 震,许彦明,陈永忠,等. 油茶转录组测序与SSR特征分析[J]. 西南林业大学学报,2018,38(6):63-68.
[10]Zhang P,Dreisigacker S,Melchinger A E,et al. Quantifying novel sequence variation in CIMMYT synthetic hexaploid wheats and their backcross-derived lines using SSR markers[J]. Molecular Breeding,2005,15(1):1-10.
[11]Han Z Z,Ma X Y,Min W,et al. SSR marker development and intraspecific genetic divergence exploration of Chrysanthemum indicum based on transcriptome analysis[J]. BMC Genomics,2018,19(12):291.
[12]Kobeissi B,Saidi A,Kobeissi A,et al. Applicability of scot and SSR molecular markers for genetic diversity analysis in Chrysanthemum morifolium genotypes[J]. Biological Sciences,2018,89(3):1-11.
[13]張运兴,李卫国,申亚琳,等. 菊花EST-SSR标记的开发与应用[J]. 武汉大学学报(理学版),2013,59(4):357-362.
[14]刘 越,岳春江,王 翊,等. 藏茵陈川西獐牙菜转录组SSR信息分析[J]. 中国中药杂志,2015,40(11):2068-2076.
[15]陈 茵,李翠婷,姜倪皓,等. 灯盏花转录组中SSR位点信息分析及其多态性研究[J]. 中国中药杂志,2014,39(7):1220-1224.
[16]范三红,郭蔼光,单丽伟,等. 拟南芥基因密码子偏爱性分析[J]. 生物化学与生物物理进展,2003,30(2):221-225.
[17]Morgante M,Hanafey M,Powell W. Microsatellites are preferentially associated with nonrepetitive DNA in plant genomes[J]. Nature Genetics,2002,30(2):194-200.
[18]张华丽,丛日晨,王茂良,等. 基于万寿菊转录组测序的SSR标记开发[J]. 园艺学报,2018,45(1):159-167.
[19]王 森,张 震,姜倪皓,等. 半夏转录组中的SSR位点信息分析[J]. 中药材,2014,37(9):1566-1569.罗宇婷,黄艺清,黄 琪,等. 优选盆栽小菊高效再生及转化体系的建立[J]. 江苏农业科学,2020,48(11):61-66.

