不同肥料对马铃薯黑痣病的控制作用和对土壤微生物群落的影响
郭成瑾 张丽荣 王喜刚

摘要:为探明肥料的种类对马铃薯黑痣病的影响,采用田间调查、平板计数、Biolog-ECO微平板培养等方法,研究不同肥料对马铃薯黑痣病的控制作用和对土壤微生物群落的影响。结果表明,与不施肥对照(CK)相比,碳酸氢铵处理(AB)、生化黄腐酸钾处理(BFAP)、羊粪处理(SM)能有效保证马铃薯出苗,降低马铃薯黑痣病的发生率,其中BFAP处理对马铃薯黑痣病控制作用最明显,处理后地上茎病情指数为9.95,比CK减少30.85%,薯块病情指数为31.23,比CK减少49.87%。平板计数分析结果表明,U处理马铃薯根际土壤真菌數量相对其他处理多,BFAP处理马铃薯根际土壤细菌数量增多且变化明显。Biolog-ECO微平板测定结果表明,BFAP处理的平均颜色变化率(AWCD)增长率高于CK,并且它的丰富度(S)、多样性指数(H′)和均匀度(J)均最高,分别为20.00、2.70、0.91。由主成分分析(principal component analysis,简称PCA)结果可知,BFAP处理土壤微生物对碳源的利用率相对最高。施用BFAP后,土壤微生物数量明显增加,土壤微生物多样性明显提高,土壤微环境得到了改善,在生态水平上降低了马铃薯黑痣病的发生情况。
关键词:马铃薯黑痣病;肥料;病害控制;土壤微生态;Biolog-ECO
中图分类号: S435.32;S154.3 文献标志码: A 文章编号:1002-1302(2020)11-0082-07
收稿日期:2019-07-09
基金项目:国家公益性行业(农业)科研专项(编号:201503112+7);全产业链创新示范项目(编号:NKYZ16-0104);宁夏自然科学基金(编号:NZ16104)。
作者简介:郭成瑾(1978—),女,陕西宝鸡人,硕士,副研究员,主要从事马铃薯病害防治研究。Tel:(0951)6882370;E-mail:chj.guo@163.com。
通信作者:沈瑞清,博士,研究员,主要从事农作物病害防治及植物病原研究。Tel:(0951)6886817;E-mail:srqzh@sina.com。 马铃薯黑痣病(Rhizoctonia solani Kühn)别称立枯丝核菌病,是以带病种薯和土壤为主要传播途径的真菌性病害,主要危害马铃薯幼芽、茎基部、薯块,引起芽腐、茎溃疡、块茎黑痣,严重影响马铃薯出苗、品质及产量[1-2]。在宁夏南部干旱半干旱区,随着马铃薯种植面积的扩大,重茬现象日益严重,这一病害由零星发生发展成普遍发生,已成为宁夏马铃薯病虫害防治的瓶颈,严重制约了宁夏马铃薯产业的发展[3]。目前,马铃薯黑痣病的防治通常采用农艺措施[4-5]、化学药剂[6-7]、生物防治[8]等。但马铃薯黑痣病作为一种土传病害很难控制,缺乏有效的方法去控制病害的传播和发展[9]。
肥料是作物生长发育的重要影响因素,不仅影响作物病害的发生[10-11],还能改变土壤的理化性质和生物性状[12],影响地上植被的生长,间接影响土壤微生物群落结构[13]。有关肥料对马铃薯病害的研究表明,腐殖质的施用可有效提高马铃薯的抗病能力[14],施用有机肥对马铃薯早疫病有显著的防治作用[15],通过控制施氮水平能减轻马铃薯晚疫病的发生程度[16],单施硫酸铵可抑制马铃薯疮痂病的发生[17],含硫肥料能降低马铃薯立枯丝核菌的侵染率[18]。这些研究主要依据马铃薯病害调查指标,对于肥料是否对马铃薯黑痣病发生具有影响,以及是否对马铃薯土壤微生物群落结构有所影响尚未见报道。宁夏马铃薯种植区施用肥料主要包括化肥和有机肥,其中化肥施用较多的是磷酸二铵、碳酸氢铵、尿素,有机肥以羊粪、牛粪、猪粪等为主[19]。在长期的调查研究中,笔者发现不同肥料的施用会对马铃薯黑痣病的发病程度产生影响。因此,本研究通过施入常见肥料作为基肥后种植马铃薯,探究肥料对马铃薯黑痣病发生控制作用,以及对马铃薯根际土壤微生物种类、数量和功能多样性的影响,探明肥料的种类对马铃薯黑痣病发生程度的影响,以期为合理施肥减缓马铃薯黑痣病病害的发生,提高马铃薯产量,科学有效指导生产提供理论依据。
1 材料与方法
1.1 供试材料与试验设计
试验设在宁夏同心县下马关镇马铃薯试验基地,在连续多年种植马铃薯的田块进行,该地马铃薯黑痣病发生严重。土壤理化性质:有机质含量为 4.75 g/kg,全氮(N)含量为0.59 g/kg,全磷(P)含量为 0.51 g/kg,全钾(K)含量为18.4 g/kg,速效氮含量为 38 mg/kg,速效磷含量为6.4 mg/kg,速效钾含量为156 mg/kg,pH值为8.56。供试马铃薯品种为克新1号。供试肥料选用当地马铃薯种植常用肥,分别为尿素(urea,简称U)(N有效含量为46%)、碳酸氢铵(ammonium bicarbonate简称AB)(N有效含量为17%)、生化黄腐酸钾(BFAP)(N、P、K含量≥5%;生化黄腐酸含量≥12%;有机质含量≥46%)、羊粪(SM)(N有效含量为0.8%;P有效含量为0.3%;K有效含量为0.55%;有机质有效含量为30.56%)等。
1.2 试验设计
试验设置375 kg/hm2尿素,750 kg/hm2碳酸氢铵,1 800 kg/hm2生化黄腐酸钾,2 250 kg/hm2羊粪和不施肥对照(CK)5个处理,每个处理3次重复,随机区组排列,共15个小区,小区面积为4.5 m×25 m。供试肥料于播种马铃薯前作为基肥施入,并于封垄前追肥1次。试验从播种到收获整个生育期栽培措施与大田一致。试验开始于2014年,连续实施3年,在2017年,即试验第4年分别在马铃薯苗期(播后42 d)、成株期(播后71 d)、盛花期(播后100 d)以及收获期(播后133 d)取根际土壤。采用5点取样法,每点取10株,采集马铃薯根系及根系周围5 cm处土壤的混合物,将土样混匀,用无菌的封口袋包扎密封,置于冰盒中带回实验室,于4 ℃冰箱中保藏备用。
1.3 测定内容
1.3.1 马铃薯黑痣病病情调查 出苗期调查出苗率。播种时调查每个小区播种数,播种后42 d调查每个小区出苗数,计算出苗率。出苗率=出苗数/播种数×100%。
成株期调查病茎的病情指数。每个小区随机取3点,每点取3 m调查植株,记录总茎数、各级病茎数,计算病情指数。收获期调查薯块黑痣病发病情况。每个小区随机取3点,每点取50块茎,共计150块,记录薯块病级数,计算病情指数。马铃薯黑痣病地上茎分级标准为0级:无病;1级:病斑小于茎围的10%;2级:病斑为茎围的10%~25%;3级:病斑为茎围的26%~50%;4级:病斑为茎围的50%以上至环剥脱皮。马铃薯黑痣病病薯分级标准为0级:薯块上无病斑;1级:病斑小,病部面积占整个薯块面积5%以下;3级:病斑较小,病部面积占整个薯块面积5%~10%;5级:病斑较小或个别较大,病部面积占整个薯块面积11%~25%;7级:病斑大小均有分布,病部面积占整个薯块面积26%~50%;9级:病斑大小均有分布,病部相连面积占整个薯块面积的50%以上。
病情指数=∑[各级病株数(病薯数)×相对级数值]×100/[调查总株数(总薯数)×最高级数值]。
1.3.2 马铃薯根际土壤微生物数量测定 采用稀释平板法[20]测定土壤中真菌、细菌、放线菌的数量。真菌用孟加拉红培养基(5 g蛋白胨,10 g葡萄糖,1 g KH2PO4,0.5 g MgSO4·7H2O,3 mL孟加拉红,10 g琼脂粉,1 000 mL蒸馏水)培养。使用时待培养基不烫手加入0.3 mL 1%链霉素;细菌用牛肉膏蛋白胨培养基(3 g牛肉膏,5 g蛋白胨,10 g琼脂粉,1 000 mL 蒸餾水)培养;放线菌用高氏1号培养基(20 g可溶性淀粉,0.01 g FeSO4·7H2O,0.5 g MgSO4·7H2O,0.5 g NaCl,1.0 g KNO3,0.5 g K2HPO4·3H2O,10 g琼脂粉,1 000 mL蒸馏水)培养。结果以1 g鲜土所含微生物菌落形成单位数量(CFU/g)表示。
1.3.3 马铃薯根际土壤微生物多样性测定 利用Biolog-ECO微平板方法[21-22]测定土壤中微生物的多样性。收获期采集马铃薯根际土样,称取10 g鲜土(称量前测量含水量),加入90 mL无菌生理盐水中稀释,在摇床里振摇30 min,静止沉淀3~5 min,然后进行100倍稀释,以每孔150 μL稀释液加入微孔板中,将制备好的菌悬液倒入无菌移液槽中,使用8孔移液器将其接种于微平板的96孔中。接种好的微平板放到铺有6层纱布的塑料饭盒中,为防止微平板鉴定孔中的菌悬液挥发,纱布要保持一定的湿度。塑料饭盒用保鲜膜包裹,保鲜膜上用注射针头扎若干个小眼,以保证微生物的培养所需要的氧气进入,将微平板避光培养。将Biolog-ECO微孔板置于30 ℃恒温培养,分别于0、24、48、72、96、120、144、168 h在Biolog微孔板读数仪上读取数据(测定波长为590 nm)。
孔的平均颜色变化率(AWCD)计算公式如下:
AWCD=∑(Ci-R)/n。
式中:Ci为处理碳源孔的光密度;R为对照孔的光密度;n为培养基碳源种类数。
土壤微生物种群的多样性水平通过丰富度、Shannon多样性指数(H′)、Pielou均匀度指数(J)进行分析[22]。
丰富度指被利用的碳源总数目,为每孔中Ci-R的值大于0.25的孔数,以S表示。
Shannon多样性指数:H′=-∑PilnPi(i=1,2,3,…,n)。
Pielou均匀度指数:J=H′/lnS。
式中,Pi为有培养基的孔和对照孔的光密度差与整板总差的比值,即Pi=(Ci-R)/∑(Ci-R),S为丰富度。
1.4 数据处理
利用Microsoft Excel 2003软件对数据进行处理和绘图,采用DPSv 3.11、CANOCO等软件对数据进行统计分析。
2 结果与分析
2.1 施用不同肥料对马铃薯黑痣病发生情况的影响
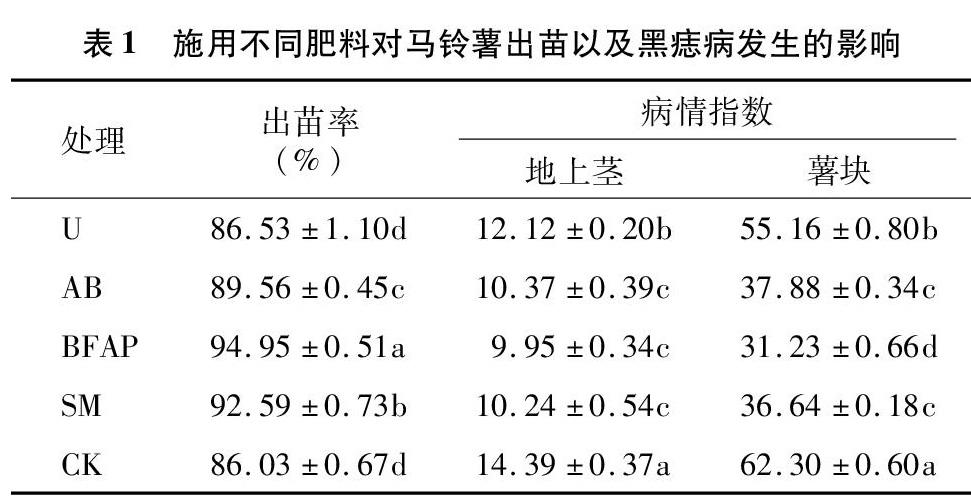
由表1可知,在马铃薯播种后42 d调查出苗率,不同肥料对马铃薯出苗有一定的影响。生化黄腐酸钾处理和羊粪处理的出苗率较高,分别为9495%、92.59%,而其他处理的出苗率均在90%以下;方差分析结果表明,各处理间差异显著。开花后期调查地上茎发病情况,总体发病较轻,其中生化黄腐酸钾处理地上茎病情指数最低,为9.95,比CK(不施肥对照)减少30.85%,其次为羊粪处理和碳酸氢铵处理,分别为10.24、10.37,分别比CK(不施肥对照)减少 28.84%、27.94%,而尿素处理地上茎病情指数为12.12,仅比CK(不施肥对照)减少15.77%;方差分析结果表明,碳酸氢铵处理、生化黄腐酸钾处理和羊粪处理之间差异不显著,而三者与尿素处理和CK(不施肥对照)之间差异显著。收获期调查马铃薯薯块上黑痣病发生情况,其中生化黄腐酸钾处理薯块病情指数最低,为31.23,比CK(不施肥对照)减少 49.87%,其次为羊粪处理和碳酸氢铵处理,分别为36.64、37.88,比CK(不施肥对照)分别减少 41.19%、39.20%,而尿素处理薯块病情指数为 55.16,仅比CK(不施肥对照)减少1146%;方差分析结果表明,生化黄腐酸钾处理与其他处理之间差异显著,羊粪处理和碳酸氢铵处理之间差异不显著,而与尿素处理和CK(不施肥对照)之间差异显著。综合结果表明,碳酸氢铵、生化黄腐酸钾、羊粪处理能保证马铃薯出苗,有效减轻马铃薯黑痣病的发生,其中生化黄腐酸钾处理对马铃薯黑痣病的控制作用最明显;尿素处理对马铃薯黑痣病的控制作用不明显。
2.2 施用不同肥料对马铃薯根际土壤微生物数量的影响
2.2.1 施用不同肥料对马铃薯根际真菌数量的影响 由表2可知,随着马铃薯的生长发育,5个处理马铃薯根际真菌数量均呈先上升后下降趋势。从苗期开始,马铃薯根际土壤真菌数量逐渐增加,在成株期均达到最高值,然后缓慢下降。各处理中,尿素处理土壤真菌数量增长最快,在成株期真菌数量达到最高值,比CK(不施肥对照)增加262.23%,其次为羊粪处理、生化黄腐酸钾处理和碳酸氢铵处理,分别比CK(不施肥对照)增加129.04%、10244%、7.94%。方差分析结果表明,在苗期,尿素处理与羊粪处理、CK(不施肥对照)之间差异显著,与碳酸氢铵处理和生化黄腐酸钾处理差异不显著;在成株期,尿素处理与其他处理之间差异显著,而生化黄腐酸钾处理与羊粪处理之间差异不显著,但两者与碳酸氢铵处理和CK(不施肥对照)差异显著;在盛花期,尿素处理与其他处理差异显著,碳酸氢铵处理、生化黄腐酸钾处理和CK(不施肥对照)之间差异不显著,但三者与羊粪处理差异显著;在收获期,尿素处理与碳酸氢铵处理之间差异不显著,与其他处理差异显著,而生化黄腐酸钾处理、羊粪处理尿素处理和CK(不施肥对照)之间差异不显著。总体来看,在整个马铃薯生育期里,尿素处理土壤真菌数量相对其他处理多。
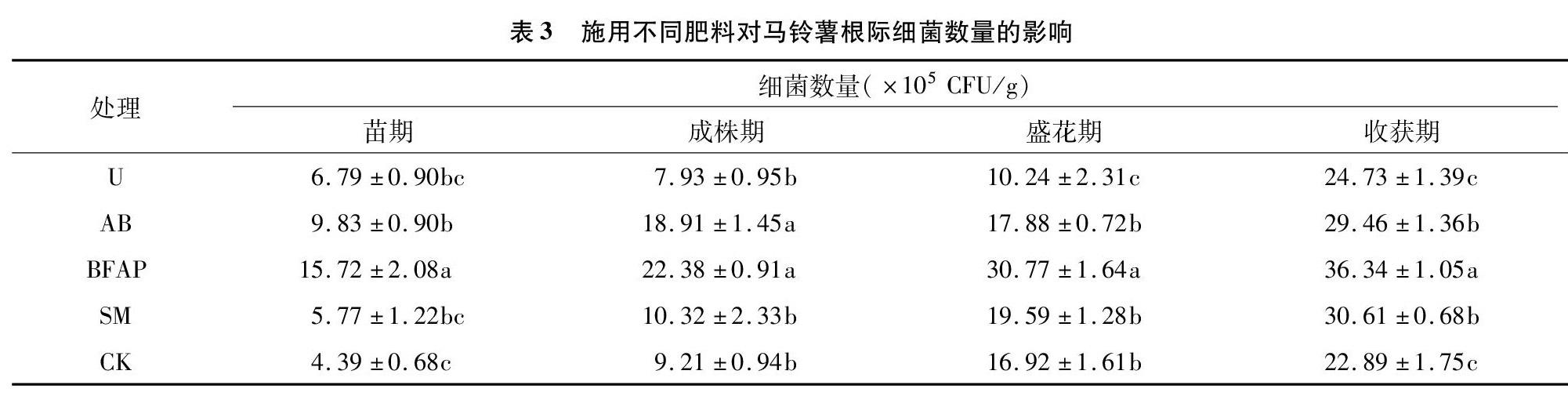
2.2.2 施用不同肥料对马铃薯根际细菌数量的影响 由表3可知,随着马铃薯的生长发育,5个处理土壤细菌数量均呈现逐渐上升趋势。从苗期开始,马铃薯根际土壤细菌数量逐渐增加,在收获期均达到最高值。其中,生化黄腐酸钾处理土壤细菌数量增长最快,在收获期细菌数量达到最高值,比CK(不施肥对照)增加58.76%,其次为羊粪处理和碳酸氢铵处理,分别比CK(不施肥对照)增加3373%、28.70%,而尿素处理土壤细菌数量增加幅度小,仅比CK(不施肥对照)增加8.04%。方差分析结果表明,在苗期,生化黄腐酸钾处理与其他处理之间差异显著,碳酸氢铵处理与尿素处理和羊粪处理之间差异不显著,但与CK(不施肥对照)之间差异显著;在成株期,生化黄腐酸钾处理与碳酸氢铵处理之间差异不显著,两者与其他处理之间差异显著;在盛花期,生化黄腐酸钾处理与其他处理之间差异显著,碳酸氢铵处理与羊粪处理和CK(不施肥对照)之间差异不显著,单着与尿素处理之间差异显著;在收获期,生化黄腐酸钾处理与其他处理之间差异显著,碳酸氢铵处理与羊粪处理之间差异不显著,两者与尿素处理和CK(不施肥对照)之间差异显著。总体来看,在整个马铃薯生育期里,生化黄腐酸钾处理、羊粪处理和碳酸氢铵处理土壤细菌数量相对其他处理多。
2.2.3 施用不同肥料对马铃薯根际放线菌数量的影响 由表4可知,随着马铃薯的生长发育,5个处理土壤放线菌数量均呈现先上升后下降的趋势。从苗期开始,各处理马铃薯根际土壤放线菌数量逐渐增加,在成株期达到最高值,之后缓慢下降。在成株期时,生化黄腐酸钾处理土壤放线菌数量增长相对较快,比CK增加62.04%,其次为碳酸氢铵处理和羊粪处理,分别比CK增加32.97%、19.52%,而尿素处理土壤放线菌数量比CK(不施肥对照)低,减少21.04%。方差分析结果表明,从苗期到收获期,各处理之间差异均不显著。总体来看,在整个马铃薯生育期里,5个处理马铃薯根际土壤放线菌数量均较少,变化不明显。
2.3 施用不同肥料对马铃薯根际土壤微生物群落功能多样性的影响
2.3.1 施用不同肥料对土壤微生物群落碳源利用模式的影响 由图1可知,4种肥料处理后,马铃薯根际土壤微生物利用全部碳源的平均颜色变化率(average well color development,简称AWCD)随着培养时间的延长呈明显的“S”形变化。在0~48 h之间,各处理的AWCD在0~0.25之间,变化不大。从48 h开始,各处理的AWCD不断增加。生化黄腐酸钾处理的AWCD从48 h开始上升最快,在72 h之后始终高于其他处理,其次为碳酸氢铵處理,即生化黄腐酸钾处理和碳酸氢铵处理的AWCD增长率高于CK(不施肥对照),说明这2种肥料处理的
土壤微生物活性较强,对各类碳源的利用能力相对较高。羊粪处理和CK(不施肥对照)的AWCD较接近,增长趋势一致。而尿素处理的AWCD最低,且明显小于其他处理,说明尿素处理降低了土壤微生物的活性,影响了土壤微生物对各类碳源的利用能力。结合表1马铃薯黑痣病发病情况分析,AWCD高的生化黄腐酸钾和碳酸氢铵处理马铃薯黑痣病病情指数相对低;而AWCD低的尿素肥料处理马铃薯黑痣病病情指数相对较高。
2.3.2 施用不同肥料对土壤微生物群落功能多样性影响 由图1可知,各处理土壤微生物培养72 h后AWCD增长趋势已稳定,因此采用培养72 h的马铃薯根际土壤微生物碳源利用能力进行多样性分析。由表5可知,不同肥料处理土壤微生物群落多样性水平存在差异。丰富度反映的是土壤微生物群落种类,生化黄腐酸钾处理最多,为20种,表明生化黄腐酸钾处理的土壤微生物种类丰富,而尿素处理的最少,仅为8.7种,表明尿素处理的土壤微生物种类少,其他处理丰富度在16.6~18.4种之间;方差分析结果表明,生化黄腐酸钾处理与尿素处理之间差异显著,与其他处理差异不显著。Shannon多样性指数反映的是群落物种丰富度,生化黄腐酸钾处理的最高,为2.70,其次为碳酸氢铵处理,为250,其他处理多样性指数在2.04~2.32之间;方差分析结果表明,生化黄腐酸钾处理与碳酸氢铵处理之间差异不显著,与其他处理差异显著。均匀度反映的是群落中全部物种个体数目的分配状况,反映了土壤微生物中各物种个体数目的均匀程度,生化黄腐酸钾处理和碳酸氢铵处理均匀度较高,分别为0.91、0.89,表明两者土壤微生物中各物种数量分布均匀,而CK(不施肥对照)均匀度最低,为074;方差分析结果表明,生化黄腐酸钾处理与碳酸氢铵处理之间差异不显著,与羊粪处理和CK(不施肥对照)之间差异显著。总体来看,生化黄腐酸钾处理在丰富度、多样性指数、均匀度均高于其他处理。
根据培养72 h马铃薯根际土壤微生物碳源利用能力,应用Canoco for Windows 4.5进行主成分(PCA)分析,由图2可知,第1主成分为56.5%,第2主成分为23.0%,共占79.5%。样方间距离的大小表示样方间的相似程度,距离越近相似程度越高。不同肥料处理(黑点)代表样方,碳酸氢铵处理与生化黄腐酸钾处理距离较近,尿素处理与CK(不施肥对照)距离较近,表明碳源利用能力相似,碳源利用能力差异性小。不同肥料处理(黑点)在不同碳源投影点的相对位置(箭头)代表该碳源在该肥料处理,即顺着箭头方向表示重要程度越大,反之越小[23]。由图2可知,除碳源C26(α-丁酮酸)外,其他30种碳源投影点均指向碳酸氢铵处理、生化黄腐酸钾处理和羊粪处理,其中9种碳源指向羊粪处理,21种碳源指向碳酸氢铵处理和生化黄腐酸钾处理,说明这2个处理的马铃薯根际土壤微生物碳源利用能力强且相关性高。可知碳酸氢铵处理和生化黄腐酸钾处理土壤微生物种类和数量相对最多,其次为羊粪处理。而尿素处理和CK对碳源利用很低,这2个处理土壤微生物种类和数量都较少。
3 结论与讨论
马铃薯土传病害因土壤环境条件复杂,病原菌存在于土壤中难以控制,造成了防治上的困难[24]。采用化学药剂虽在短期内能降低病害的发病情况,但也会无选择地杀死许多土壤里的有益微生物,导致病害反弹并加重,很难控制病害的蔓延[25]。采用农业措施,虽不能彻底解决病害的发生,但可以有效地降低病原菌数量和减缓病害发生[26-27]。本研究表明,施用肥料后,可不同程度地减轻马铃薯黑痣病的发生,其控制效果与肥料种类相关。生化黄腐酸钾处理对马铃薯黑痣病病害发生具有一定的控制作用,并且马铃薯根际土壤细菌的数量增多且变化明显。结合Biolog-ECO微平板测定结果,生化黄腐酸钾处理的马铃薯根际土壤微生物利用全部碳源能力最强,土壤微生物种类和数量相对较多,这与对马铃薯黑痣病的控制效果具有一致性。而尿素处理对马铃薯黑痣病病害发生控制率低,土壤中真菌数量增加明显,处理后的马铃薯根际土壤微生物利用全部碳源能力较弱,土壤微生物种类和数量相对较少。
氮素是影响马铃薯生长发育的三大要素之一,氮素缺乏可导致马铃薯群体叶面积下降、减产,但过量施用氮素,也会导致马铃薯茎叶徒长、组织柔嫩,降低纤维素、木质素等细胞壁材料的含量,从而降低马铃薯的抗病性[28-29],发病率增加,病害程度加重[30]。王德江研究表明,施用纯氮量提高后,马铃薯黄萎病发病程度显著增加,发病率升高[31]。本研究发现,随着施入肥料中氮含量的增加,对马铃薯黑痣病的控制作用下降明显,以尿素处理控制效果最差。施肥也是影响土壤微生物生态特征的重要农业措施。Lovell等研究表明,长期施用氮肥会降低土壤中细菌的数量和土壤微生物活性[32]。本研究表明,尿素处理的土壤中真菌数量增加,细菌数量相对较少,土壤微生物群落功能多样性下降,从而影响土壤微生物的活性。因此,无机肥的施用,尤其是氮肥应控制施用剂量。
生化黄腐酸钾是一种作物秸稈经生物发酵技术生产的腐殖酸类肥料[33]。据报道,腐殖酸类肥料能显著促进植物根系生长,提高根系活力[34],且与无机肥料合理配施可以显著提高肥料利用率[35]。Mosa等的研究表明,施入腐殖酸类肥料能够提高灌溉效率,增加营养吸收,增强马铃薯的抗病能力[14]。本研究表明,施用生化黄腐酸钾减轻了马铃薯黑痣病的发生。毕军等研究发现,腐殖酸类肥料能够直接为土壤微生物提供有机能源,又能够通过改善根际土壤环境促进微生物繁衍并延缓土壤微生物的衰减,从而促进作物的生长发育[36]。而且丰富的土壤微生物区系可以保持土壤健康状况,控制植物病害发生[37]。本研究表明,施用生化黄腐酸钾后,增加了土壤微生物的数量,尤其以土壤细菌的数量增加较明显,提高了土壤微生物多样性,与控制马铃薯黑痣病发生具有一致性,在生态水平上降低了马铃薯黑痣病的发生情况。这与毕军等的研究结果[36]一致。
马铃薯现为宁夏第一种植作物,但种植区域多位于干旱缺水的坡地和山地,由于不易种植其他作物,因此马铃薯田多数连年种植,这增加了病原菌在土壤中的积累,使得马铃薯黑痣病这一土传病害连年加重。有研究表明,常规肥料(N、P、K)平衡配施有机肥可提高土壤微生物数量、活性以及多样性,并且能增强作物生长及产量[38]。根据本研究的结果,在农业防治马铃薯黑痣病方面,根据宁夏山区种植马铃薯施肥实际情况,可适当提高农家肥的施入,同时增加生物有机肥的比例。合理的肥料配比也将是接下来研究的重点。
参考文献:
[1]Abdessamad M B,Martín M P. Black scurf of potato[J]. Mycologist,2006,20(4):130-132.
[2]Sneh B,Jabaji-Hare S,Neate S,et al. Rhizoctonia species:taxonomy,molecular biology,ecology,pathology and disease control[M]. Berlin:Springer Netherlands,1996.
[3]郭成瑾,张华普,张丽荣,等. 宁夏中南部地区马铃薯病虫害调查[J]. 中国蔬菜,2012(13):30-32.
[4]Robert P L,Honeycutt C W,Timothy S G,et al. Effects of different potato cropping system approaches and water management on soilborne diseases and soil microbial communities[J]. Phytopathology,2011,101(1):58-67.
[5]Larkin R P,Griffin T S. Control of soilborne potato diseases using Brassica green manures[J]. Crop Protection,2007,26(7):1067-1077.
[6]Errampalli D,Johnston H W. Control of tuber-borne black scurf (Rhizoctonia solani) and common scab (Streptomyces scabies) of potatoes with a combination of sodium hypochlorite and thiophanate-methyl preplanting seed tuber treatment[J]. Canadian Journal of Plant Pathology,2001,23(1):68-77.
[7]Kumar A,Raj K. Evaluation of different fungicides against black scurf of potato caused by Rhizoctonia solani[J]. Indian Journal of Plant Protection,2016,44(1):110-115.
[8]Ikeda S,Shimizu A,Shimizu M,et al. Biocontrol of black scurf on potato by seed tuber treatment with Pythium oligandrum[J]. Biological Control,2012,60(3):297-304.
[9]Wilson P S,Ahvenniemi P M,Lehtonen M J,et al. Biological and chemical control and their combined use to control different stages of the Rhizoctonia disease complex on potato through the growing season[J]. Annals of Applied Biology,2008,153(3):307-320.
[10]杨卫星,袁虹霞,孙炳剑,等. 不同施肥种类及施用量对小麦禾谷胞囊线虫病发生的影响[J]. 植物病理学报,2008,38(6):613-618.
[11]熊桂林,陈怀谷,李 伟,等. 不同施肥处理对小麦纹枯病发生及根际微生物的影响[J]. 江苏农业学报,2008,24(4):414-418.
[12]Pankhurst C,Doube B M,Gupta V R. Biological indicators of soil health[J]. Quarterly Review of Biology,1997,17(2):368-369.
[13]徐永刚,宇万太,马 强,等. 不同施肥制度對土壤微生物生态影响的评价[J]. 土壤通报,2010,41(5):1262-1269.
[14]Mosa A A. Effect of the spplication of humic substances on yield,quality,and nutrient content of potato tubers in egypt[M]. Berlin:Springer Netherlands,2012.
[15]张建平,程玉臣,哈 斯. 有机肥防治马铃薯早疫病试验[J]. 中国马铃薯,2012,26(5):291-294.
[16]杨 瑒. 施氮量对马铃薯根际土壤生物活性及晚疫病发生程度的影响[D]. 大庆:黑龙江八一农垦大学,2014.
[17]Mizuno N,Yoshida H,Toshiaki T. Efficacy of single application ammonium sulfate in suppressing potato common scab[J]. Soil Science and Plant Nutrition,2000,46(3):611-616.
[18]Klikocka H,Haneklaus S,Bloem E,et al. Influence of sulfur fertilization on infection of potato tubers with Rhizoctonia solani and Streptomyces scabies[J]. Journal of Plant Nutrition,2005,28(5):819-833.
[19]赵 营,郭鑫年,赵护兵,等. 宁夏南部山区马铃薯施肥现状与评价[J]. 中国马铃薯,2013,27(5):281-287.
[20]李阜棣,喻子牛,何绍江. 农业微生物学实验技术[M]. 北京:中国农业出版社,1996:178-181.
[21]郑 华,欧阳志云,方治国,等. BIOLOG在土壤微生物群落功能多样性研究中的应用[J]. 土壤学报,2004,41(3):456-461.
[22]胡 可,王利宾. BIOLOG微平板技术在土壤微生态研究中的应用[J]. 土壤通报,2007,38(4):819-821.
[23]董立国,蒋 齐,蔡进军,等. 基于Biolog-ECO技术不同退耕年限苜蓿地土壤微生物功能多样性分析[J]. 干旱区研究,2011,28(4):630-637.
[24]Jeger M J,Hide G A,Boogert P D,et al. Pathology and control of soil-borne fungal pathogens of potato[J]. Potato Research,1996,39(3):437-469.
[25]Gamliel A,Austerweil M,Kritzman G. Non-chemical approach to soilborne pest management - organic amendments[J]. Crop Protection,2000,19(8/9/10):847-853.
[26]Edward B,Robert P L,Stellos T,et al. Rapeseed rotation,compost and biocontrol amendments reduce soilborne diseases and increase tuber yield in organic and conventional potato production systems[J]. Plant and Soil,2014,374(1/2):611-627.
[27]张智芳,杨海鹰,云 庭,等. 播期、芽长和覆土厚度对马铃薯黑痣病的规避效应及产量的影响[J]. 中国马铃薯,2014,28(1):43-48.
[28]韦冬萍,韦剑锋,熊建文,等. 马铃薯氮素营养研究进展[J]. 广东农业科学,2011,38(22):56-60.
[29]郭衍银,徐 坤,王秀峰,等. 矿质营养与植物病害机理研究进展[J]. 甘肃农业大学学报,2003,38(4):385-393.
[30]慕康国,赵秀琴,李健强,等. 矿质营养与植物病害关系研究进展[J]. 中国农业大学学报,2000,5(1):84-90.
[31]王德江. 不同施氮水平对马铃薯生长、产量及黄萎病发病率的影响[D]. 哈尔滨:东北农业大学,2016.
[32]Lovell R D,Jarvis S C,Bardgett R D. Soil microbial biomass and activity in long-term grassland:effects of management changes[J]. Soil Biology and Biochemistry,1995,27(7):969-975.
[33]黨祝庆,王娜娜,张亚飞,等. 不同施肥模式对桃幼树根系生长与氮素吸收分配的影响[J]. 水土保持学报,2015,29(4):171-176.
[34]Zandonadi D B,Canellas L P,Faξanha A R. Indolacetic and humic acids induce lateral root development through a concerted plasmalemma and tonoplast H+ pumps activation[J]. Planta,2007,225(6):1583-1595.
[35]梁太波,王振林,王汝娟,等. 腐殖酸钾对生姜根系生长发育及活性氧代谢的影响[J]. 应用生态学报,2007,18(4):813-817.
[36]毕 军,夏光利,毕研文,等. 腐殖酸生物活性肥料对冬小麦生长及土壤微生物活性的影响[J]. 植物营养与肥料学报,2005,11(1):99-103.
[37]王书锦,胡江春,张宪武. 新世纪中国土壤微生物学的展望[J]. 微生物学杂志,2002,22(1):36-39.
[38]Zhong W H,Gu T,Wang W,et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil,2010,326(1/2):511-522.鲁海菊,李丽莎,谢欣悦,等. 木霉P3.9菌株对枇杷根际土著细菌数量的影响[J]. 江苏农业科学,2020,48(11):89-92.

