甜菊β-葡萄糖苷酶活性与甜菊糖苷含量变化的研究
杨永恒 侯孟兰 张婷


摘要:为了研究甜菊β-葡萄糖苷酶在甜菊糖苷降解代谢中的作用,分别采用高效液相色谱法(high performance liquid chromatography,简称HPLC)和分光光度计法对甜菊糖苷含量和β-葡萄糖苷酶活性进行同步检测分析。结果表明,不同甜菊品种中具有高甜菊苷(stevioside,简称St)含量的中山5号、大叶1号具有较高的β-葡萄糖苷酶活性;在中山5号开花期植株的不同器官中,β-葡萄糖苷酶活性与甜菊糖苷含量的变化趋势较一致,其中叶片中的β-葡萄糖苷酶活性、甜菊糖苷含量均最高,花中次之,茎中较低,根中均最低;中山5号3个主要生长时期叶片中的β-葡萄糖苷酶活性随生长发育的推进而逐渐升高,其甜菊糖苷含量则随生长发育的推进先升后降,现蕾期最高。研究结果可为后续甜菊β-葡萄糖苷酶及其基因的研究奠定基础。
关键词:甜菊;甜菊糖苷;β-葡萄糖苷酶;分解代谢
中图分类号: S566.901;Q556+.2 文献标志码: A 文章编号:1002-1302(2020)11-0187-05
收稿日期:2019-06-19
基金项目:江苏省自然科学基金青年基金(编号:BK20160600)。
作者简介:杨永恒(1985—),女,陕西洋县人,博士,助理研究员,主要从事甜菊遗传育种研究。Tel:(025)84347086;E-mail:yyh8576@126.com。
通信作者:徐晓洋,博士,助理研究员,主要从事甜菊遗传育种研究。Tel:(025)84347086;E-mail:intergoogle@126.com。 甜菊(Stevia rebaudiana Bertoni)别称甜叶菊,是原产于南美洲的菊科(Asteraceae)甜菊属(Stevia)宿根性多年生草本植物[1],因其叶片含有高甜度(高达蔗糖的250~450倍)、低热量(低至蔗糖的1/300)的甜菊糖苷(steviol glycosides)而得名[2]。甜菊糖苷俗称甜菊糖,目前已经作为天然低热量甜味剂广泛应用于食品、饮料、医药、化工等领域,并且有越来越多的研究发现,甜菊糖苷具有预防和辅助治疗肥胖症、糖尿病、高血压、高血糖以及消炎、抗氧化、抗菌、抗癌和增强免疫力等药用价值[3]。
甜菊糖苷是以甜菊醇(steviol)为苷元的四环二萜类糖苷,目前已经发现50多种甜菊糖苷组分,主要包括甜菊单糖苷(steviolmonoside)、甜菊双糖苷(steviolbioside)、甜菊苷(stevioside,简称St)、莱鲍迪苷A(rebaudioside A,简称RA)、莱鲍迪苷B(rebaudioside B)、莱鲍迪苷C(rebaudioside C)、莱鲍迪苷D(rebaudioside D)、杜尔克苷A(dulcoside A)等[4],各种甜菊糖苷组分因其苷元甜菊醇C13和C19位发生糖基化的糖基种类和数量不同而性质迥异[5]。有研究发现,甜菊叶片内甜菊糖苷的积累随生长发育的推进而变化[6]。由于糖苷积累是合成与分解、糖基化与去糖基化的动态平衡,因此催化糖苷分解的酶[糖苷酶(glycosidases)],尤其是β-葡萄糖苷酶(β-glucosidases,EC 3.2.1.21)在甜菊糖苷分解代谢和组分转化中起着相当重要的作用,然而目前在甜菊中尚未见相关报道。β-葡萄糖苷酶又称 β-D-葡萄糖苷水解酶,可以水解结合于苷元末端非还原性的β-D-糖苷键,同时释放β-D-葡萄糖苷和相应配基[7]。β-葡萄糖苷酶广泛存在于自然界中,在不同的生物体中,β-葡萄糖苷酶的生物学功能也各不相同。植物来源的β-葡萄糖苷酶被认为具有较为广泛的生理功能,包括参与植物细胞壁的降解、木质化作用、植物激素的共价激活、宿主防御、香味前体的水解等[8]。尽管目前已有大量关于β-葡萄糖苷酶作为植物醇系香味物质产生的关键酶的研究,在人参皂苷[9]、大豆异黄酮苷[10]、茶树香叶醇苷[11]等萜类糖苷降解中的关键作用也有很多报道,然而在以其萜类糖苷而闻名的甜菊中的相关研究很少,目前仅有一些利用微生物来源的β-葡萄糖苷酶进行甜菊糖苷组分转化[12]的报道。
为了明确甜菊β-葡萄糖苷酶在甜菊糖苷降解代谢中的作用,本研究对不同品种、不同器官、不同生长时期甜菊的β-葡萄糖苷酶活性和甜菊糖苷含量进行同步测定分析,以期为后续甜菊β-葡萄糖苷酶及其基因的研究,以及通过抑制甜菊糖苷的降解从而提高其含量的育种工作等奠定基础。
1 材料与方法
1.1 材料与仪器
本试验选择甜菊糖苷总含量和组分种类有差异的6个甜菊品种进行试验,供试品种均种植于江苏省中国科学院植物研究所的甜菊资源圃内,各品种的来源及特征见表1。
本试验所用主要仪器为LC-100高效液相色谱仪(上海伍丰科学仪器有限公司)、Sapphire C18反相色谱柱(苏州赛分科技有限公司,250 mm×4.6 mm,5 μm)。
1.2 研究方法
1.2.1 取样方法 2016年8月于甜菊现蕾期分别采集6个甜菊品种植株顶部的10对叶片,每对叶片分为2份,1份用液氮速冻,用于β-葡萄糖苷酶的提取和酶活性的测定,另1份于105 ℃杀青后于 70 ℃ 烘干,用于甜菊糖苷含量的测定。在品种比较的基础上,选择糖苷酶活性最高的品种中山5号,分别采集其开花期的根、茎、叶、花序4个器官样品,每份样品至少选择5株混匀后一分为二,分别用液氮速冻、105 ℃杀青后烘干,用于酶活性和糖苷含量的测定。2017年5—10月分别采集中山5号快速生长期、现蕾期、开花期的叶片,进行不同生长时期酶活性和糖苷含量的测定,取样方法同上。
1.2.2 甜菊β-葡萄糖苷酶的提取 参考宋晓青的方法[13]并略加改进。取1.0 g甜菊样品,置于预冷的研钵中,加入约5 mL pH值为7.0的 50 mmol/L 磷酸缓冲液、适量石英砂和等量聚乙烯吡咯烷酮(polyvinyl pyrrolidone,简称PVP),在冰上研磨至匀浆后全部转移至50 mL离心管中,并用少量pH值为7.0的50 mmol/L磷酸緩冲液冲洗研钵、研锤3~4次,合并洗液至同一50 mL离心管中,定容至20 mL,混匀后于4 ℃、10 000 g离心10 min,取上清液作为粗酶液。粗酶液用20%~40%饱和度的硫酸铵盐析初步纯化后于4 ℃保存备用。
1.2.3 甜菊β-葡萄糖苷酶活性的测定 (1)对硝基苯酚(p-nitrophenol,简称pNP)标准曲线的绘制。准确称量139.0 mg pNP,用蒸馏水溶解并定容至 1 000 mL。分别吸取1、2、3、4、5、6 mL pNP溶液至100 mL容量瓶中,用1 mol/L Na2CO3溶液定容并将其混匀,使pNP的终浓度分别为0.01、0.02、0.03、0.04、0.05、0.06 μmol/L。以蒸馏水为空白对照,在410 nm波长处测定吸光度,以吸光度为纵坐标、pNP浓度为横坐标,绘制pNP标准曲线。β-葡萄糖苷酶活性(U/g)的计算公式如下:
酶活性=Y×V2×VK×V1×m×T。
式中:Y为酶促反应的吸光度;V2为总反应液体积(mL);V为酶液的总提取量(mL);K为对硝基苯酚标准曲线的斜率;V1为反应体系中的酶液体积(mL);m为试样质量(g);T为反应时间(min)。
(2)甜菊β-葡萄糖苷酶活性的测定。参考金璐等的研究方法[14],在同一试管中分别加入600 μL “1.2.2”节的酶液、200 μL pH值7.0的磷酸缓冲液和200 μL 10 mmol/L 对硝基苯酚-β-D-葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,简称pNPG),混匀后置于37 ℃的恒温水浴锅内反应1 h。反应结束后,加入2 mL 1 mol/L Na2CO3终止反应。反应液于4 000 r/min离心10 min后,取上清液,于410 nm波长处进行比色,对加热失活的酶液进行同样处理作为空白对照。根据标准曲线计算各样品β-葡萄糖苷酶的活性。
1.2.4 甜菊糖苷含量的测定 分别取各烘干样品,于研钵中磨成均匀的细粉,准确称取0.200 g粉末置于15 mL離心管中,再加入10 mL蒸馏水,于沸水浴中提取2 h,然后于4 000 r/min离心10 min,吸取上清液,使用孔径为0.22 μm的滤膜过滤后,按照GB 8270—2014《食品安全国家标准 食品添加剂 甜菊糖苷》中的高效液相色谱法(high performance liquid chromatography,简称HPLC)测定和计算各样品中甜菊苷、莱鲍迪苷A和以9种组分计的总甜菊糖苷含量。流动相中V乙腈 ∶ V磷酸钠缓冲液=32 ∶ 68;流速为1.0 mL/min,检测波长为210 nm,进样量为 20 μL,柱温为40 ℃。
1.2.5 数据处理 本研究中所有试验均设3次重复,用SPSS 17.0和Excel 2007进行数据分析和图表绘制。
2 结果与分析
2.1 不同甜菊品种叶片中的β-葡萄糖苷酶活性和甜菊糖苷含量
如图1所示,在相同生长条件下,不同品种甜菊植株现蕾期叶片中的β-葡萄糖苷酶活性存在显著差异,其中中山5号、大叶1号的酶活性较高,分别为0.42、0.43 U/g,中山8号的酶活性也较高,为 0.37 U/g,中山6号的酶活性较低,为0.31 U/g,而守田3号、江甜2号的酶活性较其他品种偏低,分别为 0.25、0.24 U/g。
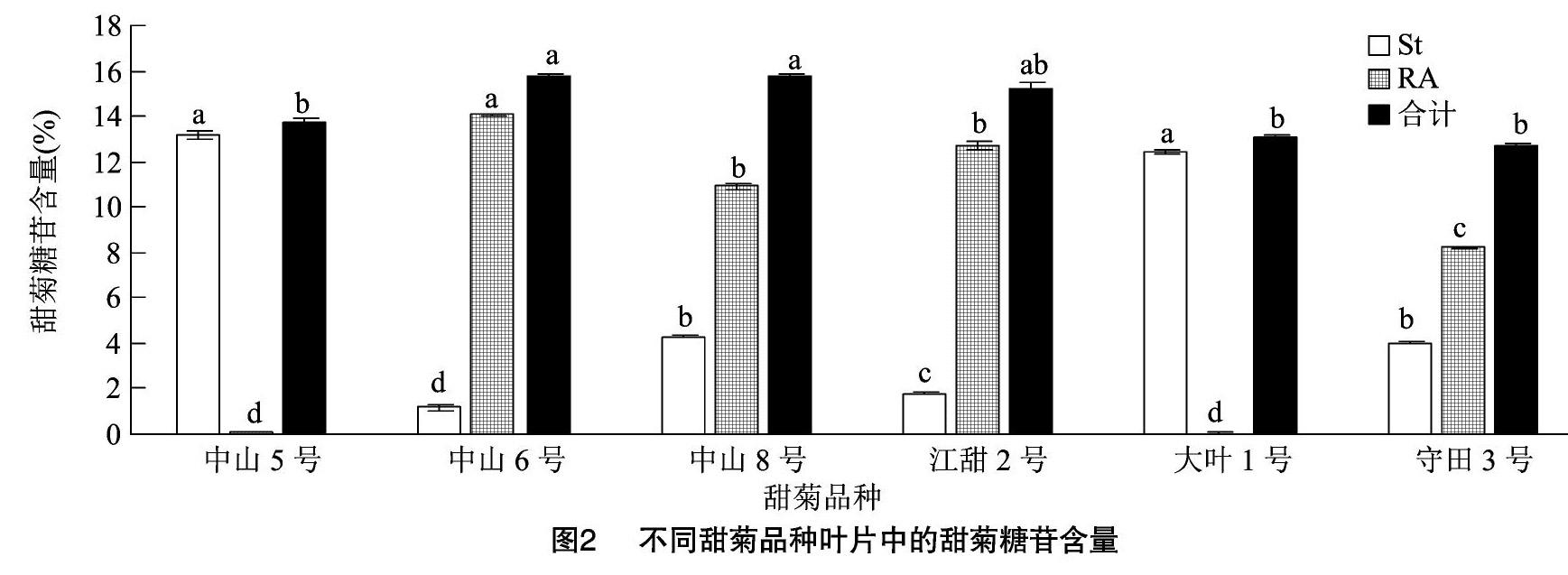
如图2所示,中山5号、大叶1号甜菊均为高甜菊苷品种,其甜菊苷含量占总苷含量的比例大于90%;中山6号、江甜2号为高莱鲍迪苷A品种,莱鲍迪苷A含量占总苷含量的比例均大于80%;中山6号、中山8号的总苷含量较高,占干叶质量的比例均大于15%。
同步分析各品种甜菊叶片的β-葡萄糖苷酶活性、甜菊糖苷含量发现,高甜菊苷品种中山5号、大叶1号均具有较高的β-葡萄糖苷酶活性。由于目前关于甜菊糖苷生物合成途径的研究已经明确,甜菊苷作为前体经糖基转移酶的催化进一步合成莱鲍迪苷A及其他糖苷组分,而莱鲍迪苷A水解掉1个糖基即生成甜菊苷,因此不同甜菊品种的甜菊糖苷组分种类与含量差异可能与其β-葡萄糖苷酶活性的差异有关。
2.2 中山5号甜菊不同器官中的β-葡萄糖苷酶活性、甜菊糖苷含量
如图3所示,中山5号甜菊叶片、花中的β-葡萄糖苷酶活性较高,分别为0.56、0.55 U/g;茎中次之,为0.48 U/g;根中最低,仅为0.33 U/g。
由图4看出,中山5号甜菊叶片中甜菊糖苷含量最高,约占叶干质量的13.45%;花中较低,占花干质量的 4.24%;茎中含少量糖苷,约占茎干质量的0.59%;根中甜菊糖苷含量最低,仅占根干质量的0.12%。
同步分析可知,中山5号甜菊的不同器官中β-葡萄糖苷酶活性、甜菊糖苷含量具有相似趋势,其花序中较高的β-葡萄糖苷酶活性可能与花中有较多β-葡萄糖苷酶参与香气成分的释放有关。
2.3 不同生长时期中山5号甜菊叶片中的β-葡萄糖苷酶活性和甜菊糖苷含量
对中山5号甜菊快速生长期、现蕾期、开花期叶片中的β-葡萄糖苷酶活性进行测定,如图5所示,快速生长期甜菊叶片中的β-葡萄糖苷酶活性为015 U/g,现蕾期甜菊叶片中的β-葡萄糖苷酶活
性为0.42 U/g,开花期甜菊叶片中的β-葡萄糖苷酶活性为0.55 U/g。可见随着甜菊的生长,其叶片中的β-葡萄糖苷酶活性逐渐增强。
由图6可以看出,3个生长时期甜菊叶片中的糖苷含量同样存在差异,其中快速生长期总苷含量约占干质量的10.21%;现蕾期糖苷含量最高,约占干质量的13.26%;开花期的糖苷含量略有下降,占干质量的12.21%。开花期甜菊叶片中的甜菊糖苷含量下降、β-葡萄糖苷酶活性升高,表明两者之间存在负相关,而快速生长期甜菊叶片中的糖苷含量和酶活性都较低的原因可能是植株处于旺盛生长时期,次生代谢产物刚刚开始积累,参与分解代谢的β-葡萄糖苷酶在该时期的活动较少。
3 讨论与结论
3.1 不同品种甜菊叶片中β-葡萄糖苷酶活性和甜菊糖苷含量的差异
本研究选用的6个甜菊品种分别为2个高甜菊苷含量品种、2个高莱鲍迪苷A含量品种和2个中间类型品种。甜菊苷通常是较原始甜菊品种中的主要组分,因其具有后苦味而被淘汰,莱鲍迪苷A等组分因具有更高的甜度和更佳的味质而倍受人们欢迎。在甜菊糖苷生物合成途径中甜菊苷是莱鲍迪苷A及其他糖苷组分的前体物质,莱鲍迪苷A水解掉1个葡萄糖基即生成甜菊苷。Nakano等早在1998年就研究发现,微生物来源的β-葡萄糖苷酶可参与甜菊糖苷的水解,可使甜菊苷水解成甜菊双糖苷,同时还能将莱鲍迪苷A水解成莱鲍迪苷B[15-16]。本研究结果表明,不同糖苷含量类型的甜菊植株现蕾期叶片中的β-葡萄糖苷酶活性存在显著差异,其中高甜菊糖苷品种中山5号、大叶1号均具有较高的β-葡萄糖苷酶活性。因此,不同品种的甜菊糖苷组分种类和含量差异可能与其β-葡萄糖苷酶的功能差异有关,这为后续筛选甜菊糖苷特异的β-葡萄糖苷酶活性低的种质用于选育高糖苷积累的新品种奠定了理论基础。
3.2 甜菊不同器官中β-葡萄糖苷酶活性和甜菊糖苷含量的分析
在甜菊中山5号开花期植株的不同器官中,β-葡萄糖苷酶活性与甜菊糖苷含量的变化趋势较一致,其中叶片中的β-葡萄糖苷酶活性和甜菊糖苷含量均最高,花中次之,茎中较低,根中均为最低。花中的β-葡萄糖苷酶活性与叶片中的β-葡萄糖苷酶活性非常接近,可能与花中有较多β-葡萄糖苷酶参与香气成分的释放有关。植物的香味物质通常以糖苷形式储存,在水解酶作用下逐步释放[17],因此β-葡萄糖苷酶在花[13,18-20]、果[21-23]、茶[11,24-26]增香中的应用多有报道。
3.3 甜菊不同生长时期叶片中β-葡萄糖苷酶活性和甜菊糖苷含量的分析
对甜菊中山5号3个主要生长时期叶片中β-葡萄糖苷酶活性的检测结果表明,β-葡萄糖苷酶活性随生长发育的推进逐渐升高,这与钟娴发现的平潭水仙中β-葡萄糖苷酶的活性随水仙花的生长逐渐升高的结果一致[27]。甜菊糖苷含量隨生长发育的推进先升后降,在现蕾期达到最高值,这可能因为快速生长期植株处于旺盛生长阶段,次生代谢产物刚刚开始积累,同时参与分解代谢的β-葡萄糖苷酶在该时期活动较少;而开花期甜菊叶片开始衰老,分解代谢较为旺盛,使其甜菊糖苷含量逐渐降低。
综上所述,在甜菊不同品种间,以及相同品种的不同器官和不同生长发育时期,β-葡萄糖苷酶活性都存在显著差异,并且与甜菊糖苷含量有一定相关性。作为甜菊β-葡萄糖苷酶的初步研究结果,本研究得出,β-葡萄糖苷酶参与甜菊糖苷分解代谢,可为今后甜菊中β-葡萄糖苷酶及其基因的研究奠定基础。
参考文献:
[1]Madan S,Ahmad S,Singh G N,et al. Stevia rebaudiana (Bert.) Bertoni- a review[J]. Indian Journal of Natural Products & Resources,2010,1(3):267-286.
[2]舒世珍. 甜菊引种三十年[J]. 中国种业,2010(6):21-23.
[3]Lemus-Mondaca R,Vega-Gálvez A,Zura-Bravo L,et al. Stevia rebaudiana Bertoni,source of a high-potency natural sweetener:a comprehensive review on the biochemical,nutritional and functional aspects[J]. Food Chemistry,2012,132(3):1121-1132.
[4]Chaturvedula P V S,Upreti M,Prakash I. Diterpene glycosides from Stevia rebaudiana[J]. Molecules,2011,16(5):3552-3562.
[5]Richman A,Swanson A,Humphrey T,et al. Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides of Stevia rebaudiana[J]. The Plant Journal,2005,41(1):56-67.
[6]Yang Y,Huang S Z,Han Y L,et al. Environmental cues induce changes of steviol glycosides contents and transcription of corresponding biosynthetic genes in Stevia rebaudiana[J]. Plant Physiology and Biochemistry,2015,86:174-180.
[7]Cairns J R K,Esen A. β-glucosidases[J]. Cell Mol Life Sci,2010,67(20):3389-3405.
[8]Cairns J R K,Mahong B,Baiya S,et al. β-glucosidases:multitasking,moonlighting or simply misunderstood?[J]. Plant Science,2015,241:S0168945215300984.
[9]Xie J C,Zhao D X,Zhao L G,et al. Overexpression and characterization of a Ca2+ activated thermostable β-glucosidase with high ginsenoside Rb1 to ginsenoside 20(S)-Rg3 bioconversion productivity[J]. Journal of Industrial Microbiology & Biotechnology,2015,42(6):839-850.
[10]Falco G H,Handa C L,Silva M B R,et al. Soybean ultrasound pre-treatment prior to soaking affects,β-glucosidase activity,isoflavone profile and soaking time[J]. Food Chemistry,2018,269:404-412.
[11]林郑和,钟秋生,陈常颂,等. 不同香型茶树鲜叶挥发性组分与β-葡萄糖苷酶的相关性分析[J]. 植物学报,2015,50(6):713-720.
[12]万会达. 甜菊苷的酶促糖基化和水解反应研究[D]. 无锡:江南大学,2012.
[13]宋晓青. 蜡梅花β-葡萄糖苷酶的活性分析、分离纯化与性质的初步研究[D]. 武汉:华中农业大学,2005.
[14]金 璐,王 彦,薛 芸,等. 植物源β-葡萄糖苷酶活性检测方法学研究[J]. 现代生物医学进展,2016,16(26):5032-5037.
[15]Okamoto K,Nakano H,Yatake T,et al. Purification and some properties of a β-glucosidase from Flavobacterium johnsonae[J]. Journal of the Agricultural Chemical Society of Japan,2000,64(2):333-340.
[16]Nakano H,Okamoto K,Yatake T,et al. Purification and characterization of a novel β-glucosidase from Clavibacter michiganense that hydrolyzes glucosyl ester linkage in steviol glycosides[J]. Journal of Fermentation and Bioengineering,1998,85(2):162-168.
[17]李遠华. β-葡萄糖苷酶的研究进展[J]. 安徽农业大学学报,2002,29(4):421-425.
[18]董尚胜,钱利生,童启庆. 窨茶用栀子花中糖苷酶活性与醇类香气的研究[J]. 茶叶科学,2002,22(1):25-29.
[19]左亚锋,张 伟,吴德玲,等. 亳菊花中β-葡萄糖苷酶的提取和酶学性质研究[J]. 安徽中医药大学学报,2015,34(5):83-86.
[20]董尚胜,童启庆,渡边修治,等. 茉莉花粗酶液提取条件对β-D- 葡萄糖苷酶活性的影响[J]. 中国茶叶加工,1997(2):32-33.
[21]何芒芒. 柑橘中糖苷香气前体物质及β-葡萄糖苷酶活性变化相关性研究[D]. 武汉:华中农业大学,2013.
[22]段朝瑞,陈 佩,张国军,等. 葡萄成熟过程中生理特征与β-葡萄糖苷酶基因的表达分析[J]. 中国农业大学学报,2013,18(2):50-55.
[23]詹 萍,田洪磊,杜 娟. 库尔勒香梨中β-葡萄糖苷酶活的测定及不同贮藏条件下活性变化的研究[J]. 现代食品科技,2008,24(11):1104-1107.
[24]吴 乔. 乌龙茶做青对β-葡萄糖苷酶活性及酶学性质的影响[D]. 福州:福建农林大学,2013.
[25]骆耀平,董尚胜,童启庆,等. 7个茶树品种新梢生育过程中β-葡萄糖苷酶活性变化[J]. 茶叶科学,1997(增刊1):25-28.
[26]周汉琛,雷攀登,丁 勇. 茶树β-葡萄糖苷酶研究进展[J]. 茶叶科学,2016,36(2):111-118.
[27]钟 娴. ‘平潭水仙β-葡萄糖苷酶与挥发性芳香物质形成关系的研究[D]. 福州:福建农林大学,2014.郝婧玮,张 蕾,秦金玲,等. 川牛膝多糖联合维生素C体外抑制HepG-2肿瘤细胞活性的作用[J]. 江苏农业科学,2020,48(11):192-196.

