强壮硬毛藻粗多糖的组成、理化性质和抗氧化活性
孙瑞彬 高梦舒 王茜

摘要:为了探究强壮硬毛藻(Chaetomorpha valida)的开发利用价值,采用糖腈乙酸酯衍生物气相色谱法测定强壮硬毛藻粗多糖的组成,分别用硫酸-咔唑法、硫化钡-明胶比浊法测定糖醛酸、硫酸基含量,同时通过强壮硬毛藻粗多糖对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,简称DPPH)自由基、超氧阴离子自由基和羟自由基的清除作用来评价其抗氧化活性。结果表明,强壮硬毛藻粗多糖中主要的单糖鼠李糖、岩藻糖、葡萄糖的物质的量之比为 1.00 ∶ 0.11 ∶ 0.21;多糖中糖醛酸、硫酸基含量分别为5.27%、3.77%;当多糖质量浓度为1.0 mg/mL时,对DPPH·和超氧阴离子自由基的清除率最高,分别为84.5%、83.61%;当多糖质量浓度为0.2 mg/mL时,对羟自由基的清除率最高,为19.9%。由研究结果看出,强壮硬毛藻粗多糖能用于食品、医药及化妆品等领域。
关键词:强壮硬毛藻;多糖;组成;理化性质;抗氧化活性
中图分类号: S184 文献标志码: A 文章编号:1002-1302(2020)11-0206-06
收稿日期:2019-06-03
基金项目:国家自然科学基金(编号:31572622);山东省级重点实验室专项建设计划开放课题(编号:SDKL2017009-03);国家海洋局海洋生物活性物质与现代分析技术重点实验室开放课题(编号:MBSMAT-2018-04);烟台大学大学生创新创业训练计划(编号:201811066145)。
作者简介:孙瑞彬(1998—),女,山东烟台人,主要从事海洋生物活性物质研究。E-mail:15192344844@163.com。
通信作者:邢荣莲,博士,副教授,主要从事海洋生物工程研究。E-mail:xingronglian@163.com。 海洋藻类生物的生存环境异于陆生植物,其代谢产物具有独特的理化性质和生物活性[1]。海藻多糖具有抗氧化、抗病毒、抗细菌、抗凝血、免疫调节等功效,被广泛应用于药品、保健品、化妆品等领域[2]。随着人们对抗氧化剂的认识加深以及对藻类多糖功能研究的发展,寻找天然无毒、价廉易得的抗氧化剂已经成为食品保藏技术和现代保健中不可或缺的一部分[3]。从丰富的海藻资源中寻找能开发成为天然抗氧化剂的物质已经受到国内外研究者的广泛关注[4]。藻类多糖的研究及应用以常见种类的微藻和大型藻类为主[5]。研究发现,藻类多糖的结构组成、理化性质和活性因种类而异。马尾藻中的多糖主要有褐藻糖胶、藻酸盐和褐藻淀粉3类,并且从不同种马尾藻中提取的褐藻糖胶、藻酸盐的质量均有显著差异[6];海带硫酸多糖清除1,1- 二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,简称DPPH)的效果比紫菜硫酸多糖好[7];用碳酸钠提取的羊栖菜多糖对自由基的清除效率比较高[7]。研究不同藻类多糖的组成、理化性质和活性对于认识该藻多糖的性质及其开发利用具有十分重要的意义。
强壮硬毛藻(Chaetomorpha valida)是一种生长速度快、易采收、不易分解的可再生资源,因不能被生物直接摄食而成为相对静止水体(池塘、湖泊)中的杂藻[8-9],在每年5—9月大量繁殖甚至暴发[10]。养殖水体中发现的强壮硬毛藻通常采用人工捞取后丢弃的方式处理,不仅对环境造成污染[11],对资源也造成极大的浪费[10]。研究强壮硬毛藻的应用价值,对于提升经济效益具有重要意义,但目前的相关研究甚少。笔者在前期研究中发现,强壮硬毛藻含有大量多糖,而对其多糖的相关研究还未见报道。因此,本文研究了强壮硬毛藻粗多糖的组成、理化性质和抗氧化活性,并探讨其利用价值,旨在为强壮硬毛藻资源的开发和利用提供参考。
1 材料与方法
1.1 试验材料
强壮硬毛藻采自山东东方海洋科技股份有限公司乳山分公司海参养殖区,带回实验室后去除附着于其上的贝类、藻类等,用过滤海水洗净,晾干,粉碎,备用。试验中所用标样为天津市致远化学试剂有限公司生产的分析纯无水葡萄糖。
1.2 多糖的提取
称取10 g强壮硬毛藻粉,加入200 mL蒸馏水,沸水浴提取2 h,重复操作3次,合并提取液。于 3 000 r/min 离心 20 min 以去除不溶性杂质,将上清液冷却后,加入4倍体积的95%乙醇沉淀后离心,得强壮硬毛藻粗多糖。再将强壮硬毛藻粗糖用Sevage法[12]去除其中的蛋白质。
1.3 理化性质的测定
总糖含量的测定采用苯酚-硫酸法[13],糖醛酸含量的测定采用硫酸-咔唑法[14-15],硫酸基含量的测定采用氯化钡-明胶比浊法[14-15]。单糖组分的分析采用糖腈乙酸酯衍生物气相色谱法[16]。准确称取15 mg硬毛藻粗多糖样品,加入10 mL浓度为 2 mol/L 的三氟乙酸于磨口试管中溶解,严格密封,在沸水浴条件下水解4 h,将水解液真空蒸干待用。称取10 mg标准糖和上述处理好的糖样10 mg,分别加入10 mg盐酸羟胺、0.5 mL吡啶、1 mg肌醇,充分溶解振摇后于90 ℃水浴中加热反应30 min,取出混合液并冷却至室温,再加入0.5 mL乙酸酐,在90 ℃水浴条件下继续反应30 min进行乙酰化,将反应产物直接进行氣相色谱分析。
1.4 抗氧化活性的测定
1.4.1 多糖对超氧阴离子自由基( O-2 · )的清除作用 取1 mL质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖溶液,加入4.6 mL浓度为 0.05 mol/L 的Tris-HCl(pH值为8.2),在25 ℃水浴中恒温10 min,立即加入0.3 mL浓度为 0.06 mol/L 的邻苯三酚溶液,摇匀,10 min后在 420 nm 波长处测得吸光度D420 nm(1)。保持其他条件不变,以等体积的去离子水代替多糖样品溶液作为空白对照,测得吸光度D420 nm(0)[17]。以不同浓度维生素C替代多糖样品作为阳性对照。超氧阴离子清除率的计算公式如下:
1.4.2 多糖对羟自由基(·OH)的清除作用 取 2 mL 质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL 的多糖溶液,分别加入2 mL 6 mmol/L FeSO4溶液、2 mL 0.06 mol/mL H2O2溶液,摇匀后静置10 min,再加入2 mL 6 mmol/L水杨酸溶液静置30 min,在510 nm处测得吸光度D510 nm(i)。其他条件不变,对照用去离子水代替多糖样品溶液,测得吸光度D510 nm(x);样品对照用2 mL去离子水代替H2O2,测得吸光度D510 nm(j)[18]。用不同浓度的维生素C替代多糖样品作为阳性对照。对羟自由基(·OH)清除率的计算公式如下:
式中:D510 nm(j)为2 mL各浓度多糖溶液、2 mL FeSO4溶液(6 mmol/L)、2 mL去离子水和2 mL水杨酸溶液(6 mmol/L)的吸光度;D510 nm(i)为待测组吸光度。
1.4.3 多糖对DPPH·的清除作用 取2 mL质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖溶液,加入2 mL 0.2 mol/L DPPH溶液和2 mL H2O2溶液,摇匀,室温避光静置20 min,用95%乙醇对分光光度计调零,在517 nm处测得吸光度D517 nm(a)[18]。用不同浓度维生素C替代多糖样品作为阳性对照。对DPPH·清除率的计算公式如下:
式中:D517 nm(c)为2 mL DPPH溶液+2 mL去离子水的吸光度;D517 nm(b)为2 mL 95%乙醇+2 mL多糖样品溶液的吸光度;D517 nm(a)为待测组吸光度。
1.5 数据分析
数据采用Excel 2007和Origin 8.5软件进行处理和分析,结果以“x±s”形式表示。用统计学方差分析来检验有无显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 理化性质的测定
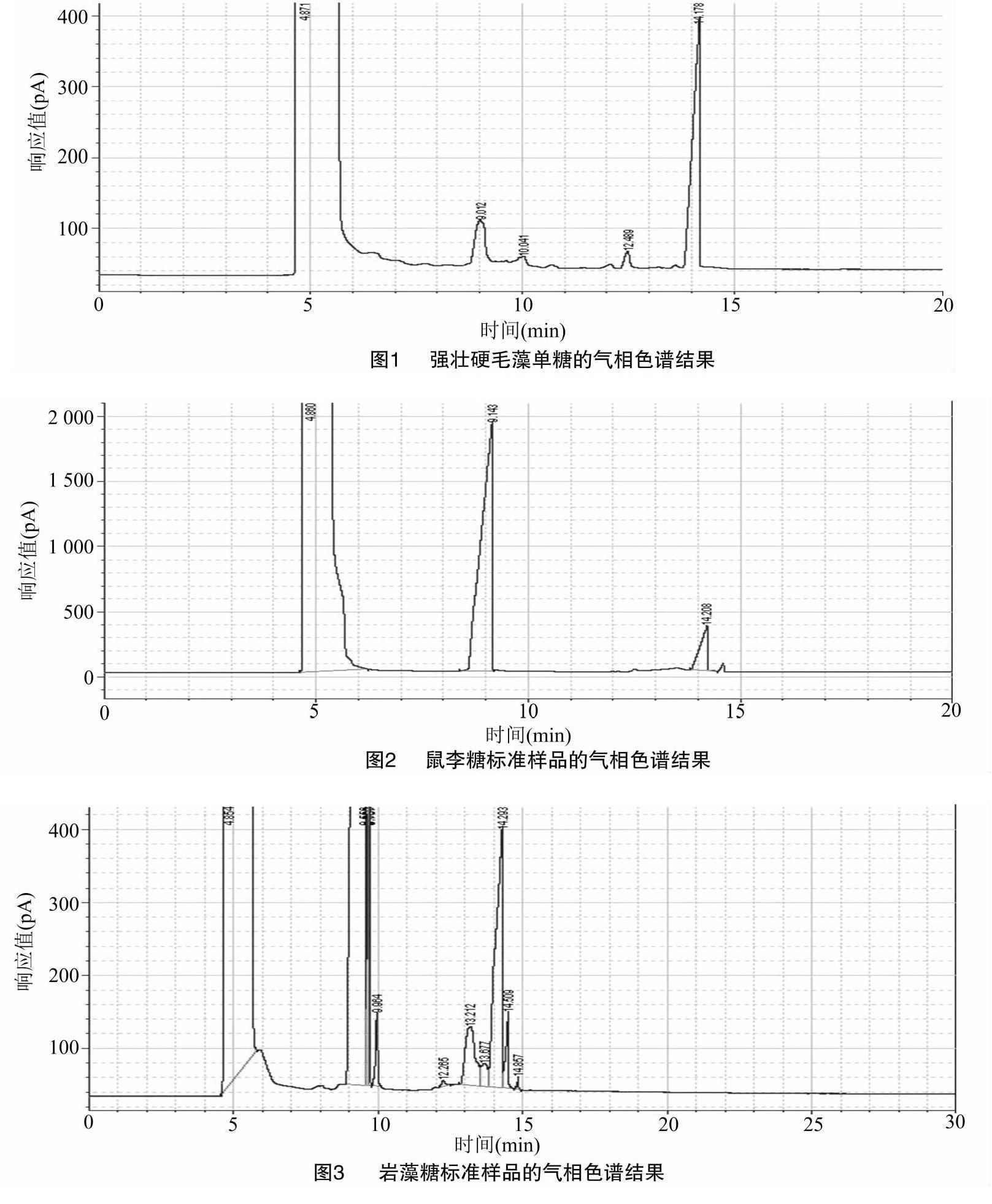
结果表明,强壮硬毛藻粗多糖总糖含量为 26.77%,糖醛酸含量为5.27%,硫酸基含量为 3.77%。用气相色谱法测得强壮硬毛藻单糖的色谱结果和3种标准样的色谱结果,详见图1至图4。图3中的峰对应岩藻糖和本试验中所加参照物。由图1至图4还可看出,强壮硬毛藻粗多糖的主要成分为鼠李糖、葡萄糖和岩藻糖,鼠李糖、岩藻糖、葡萄
糖物质的量之比为1.00 ∶ 0.11 ∶ 0.21,鼠李糖占比最高,约为葡萄糖的5倍,远高于其他单糖。
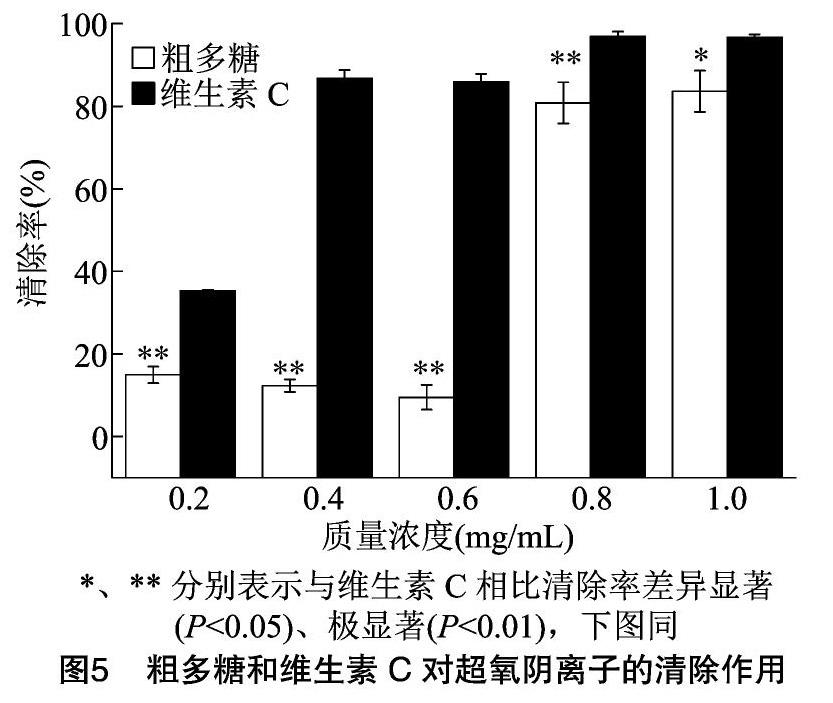
2.2 粗多糖对超氧阴离子自由基的清除作用
由图5可以看出,不同质量浓度粗多糖对超氧阴离子自由基的清除作用与维生素C相比差异极显著(P<0.01)。当粗多糖质量浓度为0.8~1.0 mg/mL时,清除率较高,当粗多糖质量浓度为1.0 mg/mL时,有最大清除率,达83.61%;当粗多糖、维生素C质量浓度为0.2~0.8 mg/mL 时,相同质量浓度的粗多糖、维生素C间对超氧阴离子的清除作用差异极显著(P<0.01);当粗多糖质量浓度为 1.0 mg/mL时,差异显著(P<0.05)。
2.3 粗多糖对羟自由基的清除作用
经方差分析,不同质量浓度粗多糖对羟自由基的清除作用差异显著(P<0.05)。由图6可以看出,当质量浓度为0.2~1.0 mg/mL时,粗多糖对羟自由基的清除率差异不明显且均不超过50%;当质量浓度为0.4~1.0 mg/mL时,相同质量浓度的粗多糖和维生素C对羟自由基的清除作用差异极显著(P<0.01);当质量浓度为0.2 mg/mL时,粗多糖、维生素C对羟自由基的清除作用差异显著(P<0.05)。
2.4 粗多糖对DPPH·的清除作用
经方差分析表明,不同质量浓度粗多糖对DPPH·的清除作用差异极显著(P<0.01)。由图7可知,强壮硬毛藻粗多糖对DPPH·有较好的清除作用。强壮硬毛藻粗多糖对DPPH·的清除率随粗多糖质量浓度的升高而增大,1.0 mg/mL质量浓度的粗多糖对DPPH·的清除率最高,达84.5%;当质量浓度为0.2~0.8 mg/mL时,相同质量浓度的粗多糖和维生素C对DPPH·的清除作用差异极显著(P<0.01);當粗多糖、维生素C质量浓度为 1.0 mg/mL 时,清除率间差异显著(P<0.05)。
3 讨论与结论
糖腈乙酸酯衍生物气相色谱法试验结果显示,强壮硬毛藻粗多糖的组成成分非常简单,以鼠李糖为主,其中鼠李糖具有提高免疫力、保护肝脏器官、减轻疲劳感等功能[19]。强壮硬毛藻粗多糖中鼠李糖含量较高,预示该粗多糖在药品、食品、保健品、化妆品等方面具有应用潜能。超氧阴离子是一种活性氧,对机体中的蛋白质、酶和DNA有一定的损害作用,超氧阴离子过多时,会损伤细胞或造成机体衰老、患癌等,而多糖可与超氧阴离子发生氧化反应,清除超氧阴离子,保护机体免受氧化损伤,起到抗氧化的作用[20-22]。研究发现,强壮硬毛藻粗多糖具有一定的去除超氧阴离子的能力,而且高浓度的强壮硬毛藻粗多糖对超氧阴离子的清除作用较强,能够起到良好的抗氧化作用。当粗多糖质量浓度在0.6~0.8 mg/mL间增加时,粗多糖清除超氧阴离子的能力随羟基数量的增加而增强,当粗多糖质量浓度较低时,羟基数量减少,而且由于羟基包裹在内部,与超氧阴离子结合的能力较弱,可能导致清除能力较低[23]。当粗多糖的质量浓度达到08 mg/mL时,粗多糖溶液提供的羟基数量迅速增多,使超氧阴离子自由基转变为稳定的化合物,因此对超氧阴离子的清除率升高。红藻如江蒿多糖对超氧阴离子的清除率达56.2%,蜈蚣藻多糖对超氧阴离子的清除率也达59.0%[24]。绿藻中南方团山藻多糖对超氧阴离子的清除率最高可达90%以上,石莼可达40%以上[25]。当质量浓度为 0.02 mg/mL 时,7种不同分子量的褐藻岩藻多糖对超氧阴离子的清除率均高于50%[26],表明强壮硬毛藻与其他绿藻、红藻和褐藻对超氧阴离子都具有一定的清除能力,可以代替红藻、褐藻或其他绿藻应用于食品制造工艺等多个领域。
羟自由基是一种活性氧,属于强氧化剂,可与多种成分发生化学反应,过量的羟自由基会对机体造成一定的氧化损伤[27-28]。与超氧阴离子相比,羟自由基对生物体的毒性更强,危害更大[29-30]。金属离子可以和硫酸基发生螯合反应,使羟自由基的生成受到抑制[31]。强壮硬毛藻粗多糖中的硫酸基含量较少,与金属离子的螯合作用较弱,影响了羟自由基的清除作用。当反应达到一定程度时,硫酸基的减少,可能导致羟自由基清除率在粗多糖质量浓度较低时(0.2~0.4 mg/mL)迅速下降。本试验采用强壮硬毛藻粗多糖为样品,由于分子量对多糖的生物活性有一定影响,分子量大的多糖的抗氧化活性可能略低于分子量小的多糖[21],可能导致强壮硬毛藻粗多糖对羟自由基的清除能力较弱,硫酸根含量较低也可能是影响强壮硬毛藻粗多糖对羟自由基的清除能力的原因之一,可见在清除羟自由基方面,强壮硬毛藻粗多糖效果较弱。绿藻中的南方团扇藻和石莼对羟自由基的清除率分别为50%、40%以上[25]。红藻中的红蒿对羟自由基表现出了较高的清除能力[24]。褐藻岩藻多糖对羟自由基的清除作用也较强,当清除率达到90%时,其所需多糖的质量浓度相对较低,分子量为64.3 ku的多糖仅需0.89 mg/mL[26]。由此可以看出,强壮硬毛藻与其他绿藻对羟自由基的清除能力相当,且强壮硬毛藻原料来源丰富、易大量繁殖,且价廉,也可以作为其他绿藻、红藻及褐藻的替代品或在不同领域使用。
DPPH是一种具有单电子、稳定的、以氮为中心的化合物[32]。试验结果表明,强壮硬毛藻粗多糖对DPPH·的清除效果明显,清除率较高,抗氧化活性较高。由于多糖浓度升高时,硫酸基、糖醛酸含量增多,多糖的电负性增强,抗氧化活性随之增强,清除能力也有所提高[21]。绿藻中南方团扇藻、石莼对DPPH·的清除率分别为70%、20%[25]。红藻江蒿、仙菜对DPPH·也具有一定的清除能力,清除率分别可达57.4%、60%[24]。褐藻泡叶藻多糖对 DPPH· 的清除能力较弱,在质量浓度为0~0.8 mg/mL 的范围内对DPPH·的清除率均不超过30%。强壮硬毛藻粗多糖在质量浓度为0.6 mg/mL时对DPPH·的清除率已超过30%[33]。以上结果表明,强壮硬毛藻相较于其他绿藻、红藻及褐藻对DPPH·具有更好的清除能力,可用作食品添加剂或应用到生物制药等多个领域。
由此可见,强壮硬毛藻粗多糖对羟自由基的清除能力小于对DPPH·和超氧阴离子自由基的清除能力,但仍具有良好的抗氧化活性。过量的自由基对多种生物具有极大的危害,会加速机体老化甚至引起多种严重疾病,如肿瘤、癌症[34]。红藻多糖的突出抗氧化活性在清除自由基、防止自由基损伤方面具有较好效果[24],现已被应用于功能性食品添加剂和营养保健品技术等领域。研究证明,马尾藻、石莼、羊栖菜等海藻多糖已成为涂膜保鲜原材料中的新焦点[35]。褐藻岩藻多糖在食品、保健品和制药等领域有着广泛的应用[26]。由上述结果看出,强壮硬毛藻粗多糖与部分红藻、褐藻和绿藻等都具有相当的抗氧化能力,且强壮硬毛藻也有丰富价廉等优点,因此强壮硬毛藻同样可以应用于功能性食品添加剂生产、保健品技术、食品涂膜保鲜及制药等多个领域。
本研究结果表明,强壮硬毛藻粗多糖提取率较高,抗氧化活性较强。因此将强壮硬毛藻粗多糖应用到食品、保健品、化妆品以及生物制药等领域具有良好的发展前景。
参考文献:
[1]闫忠辉,李小平,刘 煜. 海洋植物来源的天然产物的研究进展[J]. 药物生物技术,2017,24(3):269-274.
[2]Ali Ahmed A B,Adel M,Talati A,et al. Seaweed polysaccharides and their production and applications[M]//Venkatesan J,Anil S,Kim S K. Seaweed polysaccharides: isolation,biological and biomedical applications,2017:369-382.
[3]刘 欢,陈胜军,杨贤庆. 海藻多糖的提取、分离纯化与应用研究進展[J]. 食品工业科技,2018,39(12):341-346.
[4]刘 楠,孙 永,曾 帅,等. 海藻主要活性物质及其生物功能研究进展[J]. 食品安全质量检测学报,2015,6(8):2875-2880.
[5]路海霞,吴靖娜,刘智禹,等. 大型海藻多糖的制备及应用研究[J]. 渔业研究,2017,39(1):79-84.
[6]Liu L,Heinrich M,Myers S P,et al.Towards a better understanding of medicinal uses of the brown seaweed Sargassum in traditional Chinese medicine:a phytochemical and pharmacological review[J]. Journal of Ethnopharmacology,2012,142(3):591-619.
[7]韩 华,周海燕,刘承初,等. 三种藻类硫酸多糖的提取及其清除自由基活性研究[J]. 中国海洋药物,2006,25(3):33-36.
[8]Tsutsui I,Miyoshi T,Aue-umneoy D,et al. High tolerance of Chaetomorpha sp. to salinity and water temperature enables survival and growth in stagnant waters of central Thailand[J]. International Aquatic Research,2015,7:47-62.
[9]Zhang X M,Zhou Y,Liu P,et al. Temporal pattern in the bloom-forming macroalgae Chaetomorpha linum and Ulva pertusa in seagrass beds,Swan Lake lagoon,North China[J]. Marine Pollution Bulletin,2014,89(1/2):229-238.
[10]迟永雪,王丽梅,栾日孝,等. 中国硬毛藻属新记录种——强壮硬毛藻[J]. 水产科学,2009,28(3):162-163.
[11]Yacobi Y Z,Ostrovsky I. Sedimentation of phytoplankton:role of ambient conditions and life strategies of algae[J]. Hydrobiologia,2012,698(1):111-120.
[12]Zheng R J,Shi Y,Zheng J,et al. Effects of polysaccharides from abalone viscera (Haliotis discus hannai Ino) on MGC 803 cells proliferation[J]. International Journal of Biological Macromolecules,2018,106:587-595.
[13]陈 新,孙维矿,赵 玲,等. 米糠多糖理化性质的研究[J]. 食品研究与开发,2015,36(9):16-19.
[14]张媛媛,张 彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶多糖的比较研究[J]. 食品科学,2016,37(4):158-163.
[15]刘志超. 褐藻多糖硫酸酯对小鼠肝癌Hca-F细胞淋巴道转移的抑制作用[D]. 大连:大连医科大学,2015.
[16]郑梅霞,朱育菁,刘 波,等. 微生物多糖胶质高产菌株的筛选与鉴定[J]. 食品科学,2016,37(15):171-178.
[17]奚光兴. 苦瓜藤多糖的分离纯化及理化性质和单糖组成研究[D]. 南昌:南昌大学,2013.
[18]Wang J H,Xu J L,Zheng J C,et al. Physicochemical properties and antioxidant activities of polysaccharide from floral mushroom cultivated in Huangshan Mountain[J]. Carbohydrate Polymers,2015,131:240-247.
[19]浦跃武,刘卫斌,陈志明. 鼠李糖的研究现状及其应用[J]. 食品工业科技,2002(2):84-85.
[20]席 波,宋东辉,孙 晶,等. 十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性[J]. 天津科技大学学报,2015,30(5):20-25.
[21]吴雅清,冷小鹏. 多糖体外抗氧化作用及其影响因素[J]. 广州化工,2018,46(4):4-9,16.
[22]胡月芳. 淮山多糖超声辅助提取及清除超氧阴离子自由基的作用[J]. 江苏农业科学,2017,45(4):144-146.
[23]王金玺,顾 林,孔凡伟,等. 鸡腿菇粗多糖的体外抗氧化性[J]. 食品科学,2012,33(13):79-82.
[24]聂 磊,谢子强,廖宝林,等. 深圳海滨潮间带常见海藻活性研究[J]. 现代食品,2017,9(17):81-84.
[25]马 军,侯 萍,陈 燕,等. 几种海藻多糖抗氧化活性及体外抗脂质过氧化作用的研究[J]. 南方水产科学.2017,13(6):98-103.
[26]王 鸿,张甲生,严银春,等. 褐藻岩藻多糖生物活性研究进展[J]. 浙江工业大学学报,2018,46(2):209-215.
[27]鄭 捷,孙凯华,高 芯,等. 海参斑软骨多糖的提取及其体外抗氧化活性分析[J]. 中国食品添加剂,2018(7):114-121.
[28]曹学彬,王建波,邢荣莲,等. 北极海参不同酶解多肽的抗氧化活性与高效液相色谱分析[J]. 江苏农业科学,2018,46(20):211-214.
[29]元美花,姜成哲,崔明勋,等. 蓝莓粗多糖对自由基的清除作用及其抗溶血性[J]. 延边大学学报(自然科学版),2013,39(4):260-263.
[30]吕佳妮. 铁皮石斛根中石斛多糖提取优化及抗氧化活性研究[D]. 杭州:浙江大学,2014.
[31]王 贺,方学智,杜孟浩,等. 茶粕多糖纯化及其理化特性、抗氧化和抑菌活性[J]. 食品工业科技,2019,40(3):48-53.
[32]王婉愉,李 姣,王霄凯,等. 沙葱水提液体外抗氧化及α-葡萄糖苷酶与胰脂肪酶抑制作用的研究[J]. 食品研究与开发,2019,40(3):1-6.
[33]虞 娟,林 航,高 炎,等. 泡叶藻多糖的提取及其抗氧化活性研究[J]. 广东化工,2016,43(14):18-20.
[34]李晓萌,汲晨锋,季宇彬. 硫酸化海藻多糖及其生物活性研究[J]. 哈尔滨商业大学学报(自然科学版),2017,33(1):11-14.
[35]侯 萍,马 军,李 铭,等. 海藻多糖用于食品涂膜保鲜的研究现状[J]. 热带农林科学,2016,36(4):82-85.贾然然,邢国珍,安丽沛,等. 河南不同品种葡萄营养成分及抗氧化物质分析[J]. 江苏农业科学,2020,48(11):212-216.

