当归挥发油对自发性高血压大鼠NO、vWF、EMPs表达水平影响*
毛玉娟,何亚丽,江 华,谢 青,王 莉,杨 锐,申进增,伊 琳
(甘肃中医药大学中西医结合学院 兰州 30000)
高血压是我国逐年递增的慢性疾病之一,随着人口老龄化增加,高血压患病率在逐年提高。随着社会经济的不均衡发展,人们对高血压病认识逐渐提高,但是高血压控制率仍然较低,因此积极有效控制血压,才能够有效预防并发症的发生,提高人们的生活质量,是目前刻不容缓的重要公共卫生问题。而中药在治疗高血压方面效果显著,我国中药材种类多、品种齐全、质量好,研究中药的降压机理显得尤为重要。因为我国人口主要以农村居多,长期西药降压治疗,会造成家庭以及社会的经济负担,以及西药带来的副作用,所以我们应该发挥中医药优势。随着人们对中医药认识的不断提高,以及我国大力扶持中医药事业发展,中药被越来越多的病人所接受。目前,高血压的有关治疗主要以西药为主中药为辅,从而能够更好的控制血压,这样既能够缓解西药的副作用,同时可以改善患者的症状。赵君等[1]运用中药治疗原发性高血压患者,通过随机对照试验的Meta 分析发现,中药联合西药组能提高降压疗效、中医证候疗效,说明中药治疗原发性高血压有一定的优势,能够起到补充治疗的作用。
当归是祖国医学的传统中药,始载于《神龙本草经》,是历代医家常用之药。当归也是甘肃的道地药材,以岷县产量多、质量好,是伞形科当归属的一种多年生草本植物[2]。当归的药理作用非常广泛,具有增强免疫力、抑制血小板聚集、抗溶血、抑制心率、改善心肌缺血、保护肝脏、改善缺氧等作用[3],及当归的一般化学成分对心血管有积极调控作用。当归药性,属甘、辛,温。归肝、心、脾经。功效为补血调经,活血止痛,润肠通便。其中有机酸类、当归挥发油等是当归的化学成分,也是有效成分之一。当归挥发油主要分类为3 种油性物质,分别为酚性油、中性油和酸性油,油性比例最高为中性油,占当归挥发油的总比例88%以上,其中藁本内酯、当归酮、丁烯基酞内酯、亚丁基苯酞、洋川芎内酯等为其主要化学成分[4]。有研究证实,当归挥发油可以降压,主要降压作用当归挥发油各组分(5-羟甲基糠醛、鞣酸、腺苷和牛磺酸)共同作用的结果,降压机制通过多种因素综合作用结果,其中包括Ca2+通道被抑制、中枢M、β 受体和外周M 胆碱受体被激活、血管扩张、血流加速、血液黏稠度以及肾素-血管紧张素活性降低[5]。刘倍吟等[6]通过实验研究发现,当归挥发油能够降低SHR 的血压,降低SHR血清中内皮素-1(Endothelin-1,ET-1)、C反应蛋白(Creactive protein,CRP)、血管细胞黏附分子-1(Vascular cell adhesion molecule-1,VCAM-1)的表达,进一步证实当归挥发油的降压机制可能与血管的炎性反应有关。
本课题组前期的实验研究表明,当归挥发油具有降压作用,对胸主动脉内皮、心肌组织具有保护作用,其降压作用可能与抑制血清中内皮素-1(Endothelin-1,ET-1)、血 管 内 皮 生 长 因 子(Vascular endothelial growth factor,VEGF)、前列环素I2(Prostaglandin I2,PGI2)、肾素和血管紧张素Ⅱ受体拮抗剂(AngiotensinⅡ,Ang Ⅱ)水平有关,其降压机制可能与保护血管内皮、改善动脉血管内皮结构、影响血清中血管活性物质水平有关。为进一步探讨其可能的降压机制,本实验以自发性高血压大鼠作为研究对象,观察当归挥发油对其血压及血管假血友病因子(vWF)、一氧化氮(NO)、内皮细胞膜微粒(EMPs)水平等血管活性物质的影响,来探讨其可能的降压机制。
1 材料与方法
1.1 动物选择与分组
6 只8 周龄雄性Wistar 大鼠(体重180-220 g)为正常组,购于甘肃中医药大学动物实验中心,无特定病原体动物(Specific Pathogen Free,SPF)级,动物许可证号[SCXK(甘)2015-0002]。30只同周龄同体重(180-220 g)雄性SHR,购于北京维通利华实验动物有限公司,SPF级,动物许可证号[SCXK(京)2016-0006]。
1.2 实验药物与试剂
当归挥发油购西安四季生物科技有限公司(批号:SJDY180207),缬沙坦(北京诺华制药有限公司,国药准字:H20040217),NO、vWF 的ELISA 试剂盒(江苏菲亚生物科技有限公司生产,批号:180614050R),EMPs的ELISA试剂盒(江苏菲亚生物科技有限公司生产,批号:1812R),多功能酶标仪(Tecan Infinite,瑞士),MS60无创尾动脉血压测定分析系统(MS60,上海玉研科学仪器有限公司)。
1.3 方法
1.3.1 大鼠分组及给药
将30 只SHR 随机分为模型组、缬沙坦组及当归低、中、高剂量组,取同周龄Wistar 大鼠作为正常组(6只)。其中,缬沙坦组为8 mg·(kg·d)-1,当归挥发油低、中、高剂量组分别予以当归挥发油0.1 mL、0.2 mL、0.4 mL,相 当 于 含1%、3%、9% 当 归 挥 发 油 乳 剂2.0 mL·(kg·d)-1。其中正常组和模型组大鼠给予等量蒸馏水,给药方式为灌胃,1 次/d,7 天/w,给药4 周。实验室环境温度(23.0± 2.0)℃,相对湿度(35± 5)%,换气量10~20 次/h,日光灯采光,明暗交替,常规充足饲料喂养,自由饮水,环境安静。
1.3.2 血压检测
在大鼠清醒状态下采用套尾法测量尾动脉收缩压,测量前用恒温水(40℃)使大鼠尾部松软,皮温升高,从而扩张大鼠尾动脉,于大鼠尾部尾动脉部位安装尾套。使得血压测定系统的脉搏传感器与大鼠尾动脉精密接触,在大鼠安静状态下,待血压界面出现稳定的脉搏开始测量血压。正式实验前测量血压1次,待实验开始后每周测量血压1次,连续测量4周。
1.3.3 标本的采集
连续给药4 周后,给予大鼠10% 水合氯醛(0.03 mL·kg-1)麻醉大鼠,于腹主动脉取血8 mL,精置30 min,以4℃,3 × 103 r·min-1离心10 min,分离出血清,置放于-20℃冰箱备用。
1.3.4 ELISA检测血清中vWF、EMPs、NO水平
本研究严格采用大鼠vWF、EMPs、NO 的ELISA 试剂盒说明书操作。分别设置空白孔、标准孔和待测样品孔,其中每组均设置1个复孔,然后分别进行标准品稀释,以及加样、温育、配液、洗涤、加酶、重复温育、重复洗涤、显色、终止反应。以空白孔调零,450 nm 波长测定各孔吸光度,加终止液后15 min 内测定开始进行。然后根据标准品制作标准曲线,计算各组血清中vWF、EMPs、NO的相应浓度。
表1 当归挥发油对SHR大鼠尾动脉收缩压的影响(±s,n = 6)
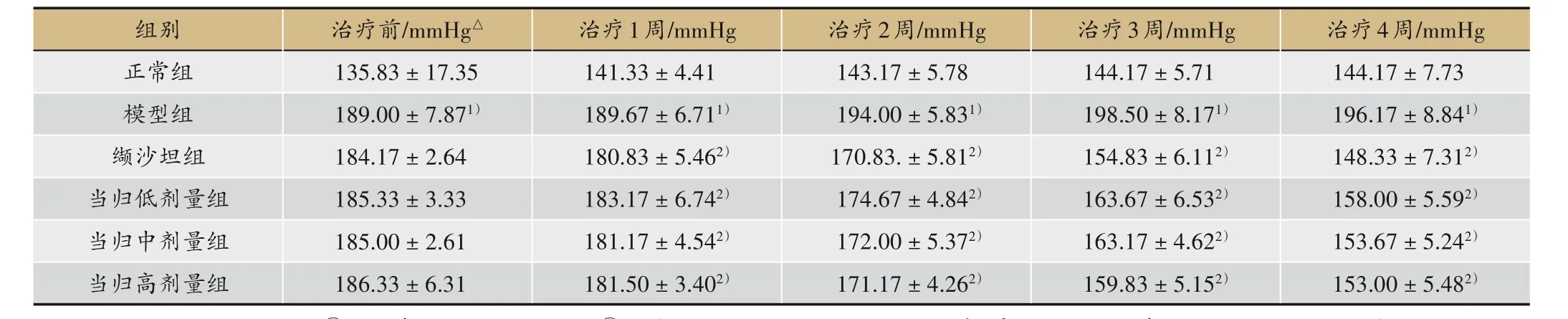
表1 当归挥发油对SHR大鼠尾动脉收缩压的影响(±s,n = 6)
注:△1 mmHg =0.133 kPa。①与正常组比较,P<0.01;②治疗1、2、3 周缬沙坦组、当归低、中、高剂量组与正常组比较,P<0.01;治疗4 周缬沙坦组与正常组比较,P>0.05;治疗4周当归低剂量组与正常组比较,P<0.01;治疗4周当归中、高剂量组与正常组比较,P<0.05;治疗4周缬沙坦组、当归低、中、高剂量组与模型组比较,P<0.01
治疗4周/mmHg 144.17±7.73196.17±8.841)148.33±7.312)158.00±5.592)153.67±5.242)153.00±5.482)组别正常组模型组缬沙坦组当归低剂量组当归中剂量组当归高剂量组治疗前/mmHg△135.83±17.35189.00±7.871)184.17±2.64185.33±3.33185.00±2.61186.33±6.31治疗1周/mmHg 141.33±4.41189.67±6.711)180.83±5.462)183.17±6.742)181.17±4.542)181.50±3.402)治疗2周/mmHg 143.17±5.78194.00±5.831)170.83.±5.812)174.67±4.842)172.00±5.372)171.17±4.262)治疗3周/mmHg 144.17±5.71198.50±8.171)154.83±6.112)163.67±6.532)163.17±4.622)159.83±5.152)
表2 各组自发性高血压大鼠血清EMPs、vWF、NO含量的比较(±s,n = 6)

表2 各组自发性高血压大鼠血清EMPs、vWF、NO含量的比较(±s,n = 6)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较△P<0.05,△△P<0.01
NO/(μmol·L-1)24.08±0.428.63±0.24**21.15±0.16△△19.92±0.17△△18.70±0.23△△21.28±4.70△△组别正常组模型组缬沙坦组当归低剂量组当归中剂量组当归高剂量组只数66 6 6 6 6 EMPs/(pg·L-1)129.93±2.23263.62±13.14**157.24±15.89△△173.31±04.31△△175.72±2.27△△194.06±03.49△△vWF/(ng·L-1)412.90±3.65634.53±1.26**456.72±3.65△△492.12±3.86△△509.39±2.19△△528.35±5.50△△
1.4 统计学处理
采用spss 23.0 软件进行数据分析,数据用均数±标准差(±s)表示,多组间采用重复测量的多因素方差分析;2 组间比较采用独立样本t检验,以P<0.05、P<0.01为差异有统计学意义。
2 结果
2.1 当归挥发油对SHR血压的影响
治疗前缬沙坦组、当归低、中、高剂量组和正常组比较血压明显偏高,差异均有统计学意义(P<0.01),见表1。
治疗1 周缬沙坦组、当归低、中、高剂量组和正常组比较,均有显著差异,差异具有统计学意义(P<0.01)。治疗2 周缬沙坦组、当归低、中、高剂量组和正常组比较,均有显著差异,差异具有统计学意义(P<0.01)。治疗3 周缬沙坦组、当归低、中、高剂量组和正常组比较,均有显著差异,差异具有统计学意义(P<0.01)。治疗4 周缬沙坦组和正常组比较无显著差异(P>0.05),当归低剂量组和正常组比较均有显著差异,差异具有统计学意义(P<0.01),当归中、高剂量组和正常组比较有显著差异,差异有统计学意义(P<0.05),见表1。
治疗4周,缬沙坦组、当归低、中、高剂量组和模型组比较,均有显著差异,差异具有统计学意义(P<0.01),见表1。
2.2 当归挥发油对SHR血清中NO、EMPs、vWF的影响
与正常组比较,模型组血清中EMPs 和vWF 含量显著升高(P<0.01),NO 含量显著降低(P<0.01);与模型组比较各给药组可不同程度地降低血清中EMPs、vWF 水平(P<0.01);与模型组比较各给药组NO含量升高(P<0.01),差异具有统计学意义,见表2。
3 讨论
高血压是最常见的慢性疾病之一,2018年8月,欧洲高血压学会和欧洲心脏病学会联合宣布2018年高血压管理指南,指出在全球范围内患有高血压的人数已经超过10亿,这是一个庞大的患者群体。随着人们生活压力的增加、各种不良的生活方式(高盐饮食、久坐不动、嗜酒、吸烟)以及全球人口的老龄化,预计在2025年全球高血压患病人数将达到15 亿[7]。高血压是中风和心血管等疾病的主要危险因素,是世界范围内死亡的主要原因,因此有效降低血压,以预防中风及心血管疾病等并发症的发生,降低患者死亡率[8]。在研究高血压发病机制时,人们将从血管活性物质以及结构和功能的改变三个方面着手。血管活性物质又称为血管舒缩剂,是由机体脏器、组织产生的一些对血管具有舒张或者收缩作用的生物介质。这些生物介质对许多脏器系统有显著作用,但最明显是对循环系统作用,直接作用于血管平滑肌,使血管产生收缩和舒张作用[9]。高血压的发生主要是因为动脉血管的变化导致的。血压升高导致血管内皮结构和功能受损,进一步使得血液中血管活性物质失去动态平衡,从而加重高血压[10]。
EMPs 是激活或凋亡的血管内皮细胞产生的有生物学活性的微粒,对于其检测能直接反映血管内皮的损伤状态。EMPs 是1999年被法国学者Combes 等[11]在研究体外产生内皮微粒和狼疮抗凝剂患者可能的促血栓形成活性的实验时首次发现并报道的,微粒的体积一般在0.1-1 μm 大小。EMPs 携带源自母细胞表面的不同抗原微粒具有不同的特性,其中可以导致血管内皮细胞损伤的抗原微粒有CD144、CD51/61、CD105、CD31,能够促进血管内皮修复的抗原微粒有CD62E、CD54、CD106[12]。在多项实验研究中发现,EMPs 在血管的炎性反应、血栓的形成、血管内皮细胞的损伤及修复、血管内皮的粥样硬化、缺血性脑卒中等多种血管疾病的发生发展的过程中起到非常重要的作用[13-14]。Jain 等[15]发现,在严重高血压患者血浆中EMPs 水平显著增高,并在高血压引起的靶器官损伤中起重要作用,认为血浆EMPs 是内皮损伤最直接的产物。EMPs 可抑制一氧化氮合酶磷酸化,使NO 的生成减少。EMPs 可激活p38 丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38MAPK)通路,刺激肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)和白介素-6(Interleukin-6,IL-6)的增加,诱导炎症反应造成血管内皮损伤[16]。研究表明,EMPs 促使内皮细胞表达炎性因子、损害内皮功能障碍均通过转录因子核因子-kB(Nuclear-factor κappa B,NF-kB)介导的转导通络进行,从而破坏血管舒张功能,进一步抑制NO合成[17]。
NO 作为舒血管物质,在调节血压方面起着重要作用,NO 实现生物学作用主要是通过启动可溶性鸟苷酸环化酶,进一步生成环鸟苷酸,使得增加环鸟氨酸在细胞内水平[18]。NO 能够调节血压是因为扩张了血管平滑肌,持续性NO 是生成减少或者功能异常,均会损伤血管内皮细胞,从而降低NO 的生物活性[19]。使得血压升高,最终损害血管内皮细胞,抑制NO 的合成,使血压状态持续处于高水平[20]。孙彩红等[21]研究发现在高血压患者中,血清NO 与收缩压升高,可能与交感神经的激活以及副交感神经抑制有关。内皮功能的紊乱源于自主神经功能紊乱造成的,也是其致病因素,同时有可能存在第3 因素。吴国泰等[22]通过高血压大鼠模型研究当归挥发油的降压机制,采用L-硝基-精氨酸(N-nitro-L-arginine,L-NNA)诱导小鼠制造高血压模型,其中L-NNA为非选择性一氧化氮合酶(Nitric oxide synthase,NOS)抑制剂,使小鼠体内NO 合成不足,实验研究发现当归挥发油中、高剂量能够降低SHR的收缩压(Systolic blood pressure,SBP)、舒张压(Diastolic blood pressure,DBP)、平均血压(Mean blood pressure,MBP)水平,通过实验推测当归挥发油可能与拮抗L-NNA 有关,促使体内NO 的合成,从而进一步降低血压,可能的降压机制与受体操作性Ca2+通道(Receptor-operated Ca2+channel,ROCC)和电压操作性Ca2+通道(Voltage-operable Ca2+channel,VOCC)介导的主动脉平滑肌收缩均有抑制作用有关,从而呈现非特异性钙通道阻滞作用。
vWF是一种糖蛋白,这种糖蛋白是由第12号染色体所编码,vWF 可以结合胶原纤维以及血小板,使得血管破裂大量血小板可以贴附在胶原纤维而形成血栓,最终才能够止血。vWF 在正常生理情况下大部分是由内皮细胞合成,小部分是由巨噬细胞合成,合成后分别储存于棒杆状小体(Weibel-palade body,W-P小体)内和血小板颗粒中,其中W-P 小体与动脉粥样硬化关系密切[23]。vWF 是一种特异性标志物,当血管内皮细胞受损,vWF 迅速释放入血使血小板凝聚,进一步形成血栓[24]。在一项实验研究中,以高血压颈动脉硬化患者实验对象,在研究发现,在实验组血清vWF 水平明显高于对照组,并且血清中vWF 水平与颈动脉的硬化程度呈正相关[25]。
本研究结果显示,缬沙坦、当归低、中、高剂量组均能够有效降低SHR 的血压,并能降低血清vWF、EMPs 的表达,升高NO 的表达,说明其降压作用与血清中vWF、EMPs 水平有关。根据表1,可以看出,治疗前后血压比较,治疗1、2、3 周后各治疗组的血压下降程度明显,尤以缬沙坦组血压下降程度突出,治疗4周后缬沙坦组血压下降程度减弱,当归低、中、高剂量组降压趋于稳定。因此,可以推测出,缬沙坦组的降压速率快,但是治疗效果不稳定。当归低、中、高剂量组降压速率慢,但是治疗效果恒定。因此,中药的降压效果仍然存在一定的优势。
综上所述,本研究推测当归降低血清vWF 的水平,可以降低血小板的粘附聚集,从而抑制血栓的形成,防止动脉硬化的发生,对内皮细胞起到保护的作用。通过降低EMPs 的水平,防止炎症损伤,从而更进一步提高NO的水平,舒张血管,维持血压稳定。

