电针后血清干预对多裂肌卫星细胞增殖、Collagen I及MMP2表达的影响*
陈玉佩,李晓红,许 玥,徐 菁,霍则军,张 莉
(1. 北京中医药大学针灸推拿学院 北京 100029;2. 北京市丰台区南苑医院针灸按摩科 北京 100076;3. 北京中医药大学生命科学学院 北京 100029;4. 北京大学第三医院中医科 北京 100191)
腰部多裂肌是稳定腰椎的钢索,多裂肌形态的改变和功能的紊乱是腰痛的重要诱因[1-2]。骨骼肌受损原因不尽相同,但其再生修复过程基本一致[3],是肌纤维再生和细胞外基质(Extracellular Matrix,ECM)重塑协调发挥作用的结果[4]。ECM 既可以减轻炎症反应,又可以调控肌卫星细胞(muscle satellite cell,MSCs)的生长环境,促进骨骼肌的再生修复进程[5]。MSCs 是骨骼肌组织的干细胞,它的激活、增殖是受损骨骼肌再生修复的前提条件[6]。
ECM 是存在于细胞间的结缔组织,是构成细胞物理结构、调节细胞间生物化学和生物力学信号的重要媒介,约占人体骨骼肌组织重量的10%,也是维持骨骼肌生理功能的关键,使骨骼肌能够应对内、外环境的变化[7]。由此可见,ECM 对骨骼肌生理功能的维持和病理变化的改善具有重要作用[8]。针刺治疗腰痛疗效显著,但其机制尚不十分明确。本课题组前期围绕电针“委中”穴促进损伤多裂肌再生修复的机制做了大量动物实验,发现电针“委中”干预后血清中磷酸肌酸激酶和白介素17 发生明显变化[9-10]。因此,本研究以离体培养的腰多裂肌MSCs 为研究对象、以电针“委中”穴后的血清为干预手段,观察MSCs 的增殖情况和ECM组成成分—Collagen I、MMP2蛋白表达的变化,揭示电针治疗腰多裂肌损伤的部分作用机制。
1 材料与方法
1.1 动物及分组
准备25 只SPF 级雄性SD 大鼠,体重120 ± 10g ,购自北京维通利华实验动物技术有限公司。许可证编号:SCXK(京)2016-0001)。于北京中医药大学屏障式实验动物房适应性饲养7 d,室温24℃,相对湿度为40%-50%。实验过程中对动物的处置符合科技部发布的《关于善待实验动物的指导性意见》。
采用随机数字表法将其中24只大鼠分为正常组、模型组、电针组,每组8 只。(注:研究发现生理盐水注射的对照组与正常组之间无统计学差异[10-11],故本研究未设模型对照组。)
1.2 主要试剂及仪器
实验的主要试剂及仪器为:布比卡因盐酸盐(BPVC(B5274-1G),SIGMA);胎牛血清(FBS,杭州四季青公司);DMEM 高糖培养基(Hyclone);兔来源Collagen I 多克隆抗体(ab34710);兔来源MMP2 多克隆抗体(10375-2-AP);鼠单克隆抗体MyoD(ab16148);兔来源Pax7 多克隆抗体(AF7584);鼠多抗GAPDH 抗体、HRP山羊抗兔/鼠二抗、BCA蛋白定量检测试剂盒、DAPI 染色液(北京索莱宝科技有限公司);Bio-Rad®蛋白质电泳及转膜系统(BIO-RAD 公司);华佗牌针灸针(0.30 mm×13mm,苏州医疗用品厂)。
1.3 方法
1.3.1 造模方法
采用单次肌肉注射0.5%的布比卡因建立大鼠腰多裂肌损伤模型。具体制备方法参照已发表文章[12]。如图1所示。
1.3.2 处理方法
各组的具体处理方法如下:
正常组:与模型组同步抓取、固定、取材,但不造模、予电针治疗。
模型组:与电针组同步抓取、固定、取材,但不予电针治疗。
电针组:造模后24 h,以《实验针灸学》[13]实验动物穴位图谱为依据,取双侧“委中”穴(膝关节背面正中)进行电针治疗,造模后第4 d 取材。电针方法:将大鼠置于固定器上,暴露双后肢。华佗牌针灸针(0.30 ×13 mm)直刺进针约0.5~1 cm,连接韩式电针仪(HANS-200 A),2/100 Hz 疏密波,1-2 mA 电流强度,20 min/次,1次/d,共3次。
1.3.3 制备针刺血清
造模后的第4 d,10%水合氯醛腹腔注射(350 mg/kg)麻醉,腹主动脉取血5 ml,室温静置2 h,3500 r/min离心10 min,取上清,56℃灭活30 min,无菌条件下经0.22 μm微孔滤膜过滤,-20℃保存备用。
1.3.4 原代MSCs的分离、培养、纯化
结合Ⅰ型胶原酶消化法和差速贴壁法获取大鼠腰4-5 节段多裂肌MSCs。具体多裂肌MSCs 分离、培养、纯化方法参照已发表文章[14]。
1.3.5 MSCs的鉴定
取第4 代MSCs,以2×104个/孔细胞数接种于6 孔板,待细胞贴壁后,培养24 h 检测Pax7 的表达,培养72 h检测MyoD的表达。细胞经PBS清洗3次×5 min,4%多聚甲醛固定30 min,PBS 清洗3 次× 5 min;0.5%Triton X-100 破膜10min,PBS 清洗3 次× 5 min;5%山羊血清封闭1 h,PBS 清洗3 次× 5 min;加1∶100 稀释的一抗,4℃过夜;吸出一抗,PBS 清洗3 次×5 min,加入1∶100 稀释的FITC 标记的山羊抗兔/小鼠IgG,37℃避光孵育1 h,PBS 清洗3 次×5 min;加入1∶1000 稀释的DAPI 染核5 min;PBS 清洗1 次,荧光显微镜下观察染色情况并拍照。细胞鉴定过程重复3次。
1.3.6 指标检测
CCK-8(Cell Counting kit-8)检 测 各 组 血 清 对MSCs 增殖的影响:将细胞稀释成2×105个/mL,以2×104个/孔细胞悬液接种到96 孔板中。随机分为空白组、正常血清组、模型血清组、电针血清组,每组重复6孔。培养24 h后,空白组加入DMEM培养基,25 μl/孔;其余各组分别加入对应的正常血清、模型血清、电针血清,25 μl/孔。培养24 h后,加入CCK-8溶液,10 μl/孔。培养1 h 后,酶标仪(450 nm 波长)测定各孔平均吸光度(OD)值。CCK-8实验重复3次。
WB 检测Collagen I、MMP2 蛋白表达:①将细胞稀释成2×105个/mL,以1×106/皿接种细胞,随机分为正常血清组、模型血清组、电针血清组,培养24 h;②弃培养基,加入无血清DMEM 培养基同步化处理24 h;③弃培养基,每皿对应加入含相应血清的培养基,培养24 h;④提取总蛋白并测定蛋白浓度,蛋白变性后,以50 μg/孔蛋白上样。
WB 操作步骤同已发表文章所述[15]。以GAPDH作为内参对照,计算每个样本的Collagen I、MMP2 与GAPDH的光密度比值(IDV)。
1.3.7 统计学方法
应用SPSS 20.0统计软件进行分析。数据以均数±标准差(x±s)表示。服从正态分布,方差齐,组间采用单因素方差分析(one-Way ANONA),两两比较用LSD-t 检验,不服从正态分布用非参数检验。P<0.05为差异有统计学意义,P<0.01为有显著性差异。
2 结果与分析
表1 各组血清对MSCs增殖的影响(±s)

表1 各组血清对MSCs增殖的影响(±s)
分组空白组正常血清组模型血清组电针血清组N 6666 OD值0.258±0.0031.659±0.113*1.821±0.074*※2.303±0.201*※※▲
2.1 MSCs形态特征及免疫荧光染色鉴定
由图2 可知,分离培养2d 的细胞呈折光性较强的球形,但贴壁数量少;随着时间培养时间的推移,贴壁细胞的数量明显增多,由圆形转变为梭型或纺锤形。由图3 免疫荧光染色结果可知,Pax7、MyoD 在细胞增殖过程中呈胞核表达阳性。具体见图2、图3。

图3 MSCs不同时期Pax7、MyoD免疫荧光染色观察
2.2 CCK-8检测各组血清对MSCs增殖的影响
与空白组比较,正常血清组模型血清组、电针血清组OD 值明显增加(P<0.01、P<0.01、P<0.01);与正常血清组比较,模型血清组、电针血清组OD 值升高(P<0.05、P<0.01);与模型血清组比较,电针血清组OD值升高(P<0.01)。见表1、图4。
2.3 电针血清对Collagen I、MMP2蛋白的表达的影响
与正常血清组比较,模型血清组Collagen I、MMP2蛋白表达升高(P<0.01、P<0.05),电针血清组Collagen I、MMP2 蛋白表达升高(P<0.01、P<0.01);与模型血清组比较,电针血清组Collagen I蛋白表达降低(P<0.01)、MMP2 蛋白表达升高(P<0.01)。见表2、图5、附图1。
3 讨论
针刺作为腰痛行之有效的治疗方法,在世界范围内被广泛应用和认可[16-17],这可能与针刺改善局部微循环,提高自由基活性,调节相关细胞因子分泌有关。多裂肌与腰痛发生、发展和复发密切相关,但却很少受关注。本课题组前期研究发现,针刺可显著改善腰多裂肌损伤大鼠IGF1R、ERK、PI3K/Akt/mTOR 等多种细胞因子和信号通路的表达[18-20]。由于难以克服在体实验多因素的影响,其具体机制尚不十分明确,因此本实验采用电针血清作为干预手段,观察大鼠腰多裂肌MSCs增殖情况及ECM中Collagen I、MMP2表达量的变化,从血清学角度探究针刺治疗腰痛的部分作用机制。
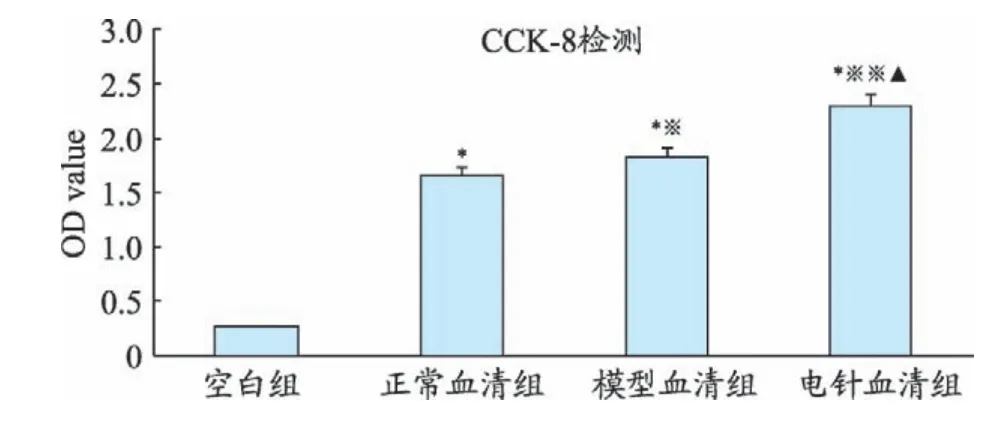
图4 CCK-8检测各组血清对MSCs增殖的影响
表2 各组血清对MSCs中Collagen I、MMP2蛋白表达的影响(±s)(单位:光密度比值)

表2 各组血清对MSCs中Collagen I、MMP2蛋白表达的影响(±s)(单位:光密度比值)
分组正常血清组模型血清组电针血清组Collagen I 0.223±0.0220.356±0.023**0.261±0.007**※MMP20.566±0.0370.613±0.014*0.738±0.043**※

图5 WB检测各组MSCs中Collagen I、MMP2蛋白表达水平

附图1 各组Collagen I、MMP2蛋白表达条带图
MSCs 和邻近其他细胞共同参与完成骨骼肌损伤后的再生修复[21-22],其中ECM 为MSCs提供结构支架和信号传递,通过信号传导系统直接影响MSCs 的激活、增殖、分化,调控骨骼肌重塑功能的正常发挥。由此可见,ECM 可能对损伤多裂肌的再生修复发挥重要作用。目前,针刺治疗骨骼肌损伤的研究集中于观察MSCs的自身变化,而忽视了ECM 对MSCs影响的重要性。因此,本研究着重从血清学角度观察电针后,血清干预对多裂肌MSCs增殖及ECM相关成分的影响。
ECM 是由Collagen、层粘连蛋白和蛋白聚糖等大分子物质组成的动态网状结构,表现为ECM 的沉积、重构和降解等[23-24]。其中Collagen I的沉积是导致骨骼肌纤维化的主要原因[25],也是形成胶原纤维并发挥作用的前提条件[26]。有研究发现,针刺可能通过抑制Collagen I 的含量减轻纤维化程度[27]。通过透射电镜发现,针刺可以减轻损伤骨骼肌中胶原纤维的沉积和增生程度[28-29]。本研究发现由于电针后血清的干预,ECM 中Collagen I 含量下降;CCK-8 结果表明MSCs 增殖能力提高,表明针刺可能通过抑制Collagen I的表达促进MSCs的增殖。
MMPs(Matrix Metalloproteinases,MMPs)可以降解ECM 中胶原的沉积,与骨骼肌再生、肌纤维增殖和ECM 重建关系密切[30-31]。骨骼肌再生修复过程中MMP2 含量增加[32-33]。MMP2 含量的增加、Collagen I 的减少可能是肝纤维化程度减轻的原因[34-35]。本研究发现,电针后血清干预使MMP2 含量增加,Collagen I 表达下降,这可能是腰多裂肌MSCs 增殖的原因。由此可知,电针“委中”穴可能通过调节ECM 中与骨骼肌纤维化有关的Collagen I、MMP2 的蛋白表达,加快MSCs的增殖速度,促进损伤多裂肌的再生修复,但电针“委中”穴是通过血清中的哪些成份发挥对多裂肌再生修复的良性调节作用,仍需进一步的深入研究,这可能是揭示电针促进骨骼肌再生修复机制的关键所在。

