气相色谱-质谱法测定食品和农产品中乙草胺
唐诗 胡江涛 俞凌云


摘要[目的]采用气相色谱-质谱法(gas chromatographymass spectrometry,GC-MS),测定食品和农产品中乙草胺的含量。[方法]采用乙腈提取,固相萃取柱净化,气相色谱-质谱法测定食品和农产品中乙草胺;并进行条件优化,建立乙草胺的高效检测方法。[结果]方法的检出限分别为谷类、豆类、水果、蔬菜、草本植物、茶为5 μg/kg,蜂蜜和动物源食品为10 μg/kg;线性范围为0.010~0.500 mg/L。方法的回收率为700%~112.0%,RSD为4.7%~11.5%。[结论]该研究建立的方法能快速、准确、简便地测定食品和农产品中乙草胺含量。
關键词食品;农产品;乙草胺;气相色谱-质谱法;检测
中图分类号TS207.5文献标识码A 文章编号0517-6611(2020)15-0216-03
doi:10.3969/j.issn.0517-6611.2020.15.061
开放科学(资源服务)标识码(OSID):
Determination of Acetochlor in Food and Agricultural Products by Gas Chromatographymass Spectrometry
TANG Shi1, HU Jiangtao2, YU Lingyun2
(1. University of Glasgow, Glasgow, UK G128QQ; 2. Technical Center of Chengdu Customs, Food Safety Detection Key Laboratory of Sichuan Province, Chengdu,Sichuan 610041)
Abstract[Objective]To determine acetochlor in foods and agricultural products by gas chromatographymass spectrometry (GCMS).[Method]Acetonitrile extraction, solid phase extraction and GCMS were used to determine acetochlor in food and agricultural products. The conditions were optimized to establish an efficient detection method for acetochlor.[Result]The detection limits of the method were 5 μg/kg for cereals, beans, fruits, vegetables, herbs and tea, and 10 μg/kg for honey and animalderived food;the linear range was 0.010-0.500 mg/L. The recovery rate of the method was 70.0%-112.0%, and the RSD was 4.7%-11.5%.[Conclusion]The method is rapid, accurate and simple for the determination of acetochlor in food and agricultural products.
Key wordsFood;Agricultural products;Acetochlor;Gas chromatographymass spectrometry;Detection
基金项目四川省科技项目(2017SZ0091)。
作者简介唐诗(1992—),女,四川成都人,硕士研究生,研究方向:营养学。
*通信作者, 高级工程师, 硕士,从事消费品安全检测研究。
收稿日期2020-01-05
乙草胺(acetochlor)是酰胺类最具代表性的除草剂品种之一,是选择性芽前除草剂,目前主要用于花生、玉米、大豆、棉花、油菜、芝麻、马铃薯、甘蔗、向日葵、果园及豆科、十字花科、茄科、菊科和伞形花科等多种蔬菜田防除一年生禾本科杂草、部分阔叶杂草等。乙草胺也是我国使用最多的3种除草剂(草甘膦、乙草胺和丁草胺)中的一种。据报道,乙草胺原药在我国的使用量已超过1万t。在国外,自1994年美国环保局EPA批准乙草胺有条件注册使用以来,乙草胺在美国的使用量也迅速增加,从1996年以来乙草胺使用量已达到1.3万t以上。
随着乙草胺等除草剂普遍的使用,以及对该类药物药用性能研究的不断深入,使得该类药物在农业生产中开始受到重视。毒理学研究证明,乙草胺对人畜低毒,但在植物、土壤以及河水中具有较长的降解周期,对生态环境、人和动植物都有一定的危(毒)害作用。美国、欧盟、日本等发达国家早已对此类药物进行残留监控。特别是在日本“肯定列表”实施后,先后从我国进口的松茸中查出2例乙草胺残留超标,使我国农产品出口受到一定影响,部分产品出口受阻,市场份额被挤占。目前,国内外文献资料检测乙草胺的方法主要是气相色谱法,有少量液相和液质的方法[1-6]。建立乙草胺的精确检测方法,将为我国食品中乙草胺残留监控和食品安全提供一项重要的技术保障,对促进我国农业生产健康发展、保障人民的健康安全、保护生态环境、积极应对国外技术壁垒、促进国际贸易具有重大的社会效益。
1材料与方法
1.1材料与试剂
大米、玉米、黄豆、花生(仁)、猕猴桃、茶、猪(肌)肉、猪肝、蜂蜜(成都市超市市购);
乙草胺(纯度大于98.5%,德国Dr.Ehrenstorfer公司);
正己烷、乙腈、丙酮(色谱纯,德国MERCK公司);氯化钠、磷酸氢二钠、磷酸二氢钠(分析纯,成都西陇化工有限公司);试验用水为Milli-Q超纯水。
1.2仪器与设备
GCMS-QP2010 气相色谱-质谱联用仪(日本岛津公司);海道夫LR4000型试验型旋转蒸发仪(德国海道夫公司);T25basic粉碎匀浆器(德国IKA公司);MF10 basic样品粉碎机(德国IKA公司);T25组织捣碎机(德国IKA公司);Milli-Q去离子水发生器(美国Millipore公司);B8500S-DTH超聲波清洗器(宁波新芝生物科技股份有限公司);EBA21高速离心机(德国sigma公司)。
1.3试验方法
1.3.1样品前处理。
①大米、玉米、黄豆、花生(仁):样品粉碎后根据需要过样品筛,于常温下保存。
②猕猴桃:样品切碎混匀,高速组织匀浆机匀浆。若不立即测定则需 -18 ℃下冷冻保存。
③茶:样品粉碎后过样品筛,于常温下保存。
④猪(肌)肉、猪肝:样品用组织捣碎机捣碎,充分混匀。取250 g粉碎样用高速组织匀浆机匀浆至糊状,若不立即测定则需 -18 ℃下冷冻保存。
⑤蜂蜜:对于无结晶的蜂蜜样品,将其搅拌均匀。对于有结晶的样品,再密闭的情况下,置于不超过60 ℃的水浴中温热,振荡,待样品全部融化后搅匀,迅速冷却至室温,于常温下保存。
1.3.2样品提取和净化。
样品经乙腈提取后,加入氯化钠和磷酸盐缓冲液洗去部分水溶性杂质,同时水和乙腈分离,然后通过固相萃取柱净化,供气相色谱-质谱测定。
1.3.3气相色谱-质谱(GC-MS)检测条件。
1.3.3.1气相色谱条件。
进样口温度:250 ℃;程序升温:初温70 ℃(保持1 min),以16 ℃/min升至220 ℃(保持5 min),再以50 ℃/min升至280 ℃(保持5 min)。
1.3.3.2质谱条件。
电离方式:电子轰击电离(electron impact ionization,EI);离子源温度:230 ℃;四级杆温度:150 ℃;接口温度:280 ℃;溶剂延迟时间:4 min;扫描方式:选择离子扫描(selected ion monitor,SIM),选择离子为m/z 146(定量)、162、174、223。
2结果与分析
2.1样品提取和净化
2.1.1提取。
以乙腈作为样品提取液。乙腈可以与水任一比混溶,可更有效地与样品组织细胞中待测物接触,当加入盐后又能迅速与水分层,且乙腈本身对样品中的糖、脂肪和蛋白质的溶解性较小,对蛋白有沉淀作用。经验证乙腈是萃取各种极性农药的最合适的试剂之一[7]。
对于茶叶等脱水试样,必需加入适量水将样品浸润后,再加入乙腈提取。乙草胺能溶于水,有助于乙腈充分与动植组织细胞接触,加水浸润试样能够有效提高提取效率。
2.1.2净化。
采用液-液萃取法和固相萃取法相结合,没有增添任何特殊的净化设备。采用C18固相萃取柱、石墨碳/氨基复合型固相萃取柱(graphitizedcarbonblacks/NH2,GCB/NH2)和N-丙基乙二胺(primary secondary amine,PSA)固相萃取柱净化,减少了试剂的用量以及对环境的危害,增强了方法的实用性。
2.1.2.1植物性样品。
C18小柱是一种非极性吸附剂,可以吸附高分子量的非极性干扰物质,特别适用于低脂类水果蔬菜的净化,对样品中的蛋白、脂质物质、部分维生素、色素和甾醇等杂质也有一定的吸附作用[8]。
NH2基和PSA是一类性质相同的固相萃取填料,常用来消除各种有机酸、部分色素以及蛋白质、糖类和脂肪酸。石墨碳(GCB)主要是用来去除类甾体、叶绿素等色素。研究NH2类填料和GCB的实际效果发现,NH2可去除90%以上的脂肪酸和50%左右的色素;GCB可去除90%以上的色素,但对脂肪酸的净化能力仅有10%左右。对于一些含色素高的样品,将两者联合使用,可净化绝大多数的色素和脂肪酸。因此方法选择了石墨碳/氨基复合型小柱对植物性样品进行净化。
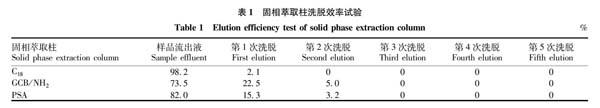
考查了C18小柱、GCB/ NH2复合型小柱和PSA小柱对乙草胺的吸附作用。吸取浓度为1 000 μg/L的乙草胺标准液20 μL,用95%乙腈水溶液稀释至3 mL。分别进行3种固相萃取柱的洗脱效率试验。收集全部流出液,每管3 mL,共收集5管。分别浓缩、定容至1 mL,洗脱试验结果见表1。
由表1可知,乙草胺在3种固相萃取柱中吸留较小,样品提取液过柱后,C18小柱再用3 mL洗脱液即可完全洗脱;GCB/NH2复合型小柱和PSA小柱再用10 mL洗脱液即可完全洗脱。过量的洗脱液会将小柱吸附的杂质洗脱。
2.1.2.2动物性样品。
样品经过乙腈饱和正己烷提取后,加入氯化钠分离乙腈和水相后,肌肉及内脏组织采用乙腈饱和的正己烷去除提取液中的脂肪。试验过程中发现杂质去除不完全,所以采用了过PSA固相萃取小柱进一步除去杂质。PSA固相萃取小柱洗脱效率见表1。
从理论上讲,乙草胺是一种极性化合物,非极性的正己烷对其溶解性很差。试验考查了正己烷对待测物乙草胺的影响,试验方案如下:吸取0.02 μg的乙草胺标准品于20 mL乙腈中(作平行样),加入20 mL乙腈饱和正己烷,涡旋2 min,静置分层,分别将乙腈和正己烷层浓缩至近干,用丙酮-正己烷(1∶1,V/V)溶液定容至1 mL,进样分析。2个平行样试验结果显示,乙腈层分别为19.55、20.40 μg/L,正己烷层均为0,表明提取液经正己烷萃取后,乙草胺仍保留在乙腈层里,正己烷对待测物测定结果没有影响。
2.2仪器条件优化
2.2.1色谱柱的选择。
乙草胺的极性相对较弱,选用弱极性色谱柱较合适。选用填充材料均为5%苯基+95%甲基聚硅氧烷的Rtx-5MS、DB-5MS、HP-5MS 3个品牌毛细管柱进行比较,结果显示,乙草胺均在11~12 min出峰,峰型与响应强度大致相当。这3个品牌色谱柱均是色谱分析实验室常规的气相色谱柱,3种色谱柱均可,该试验选择的是Rtx-5MS(30 m×0.25 mm×0.25 μm)。
2.2.2进样口温度和柱温的选择。
进样口温度为250 ℃,此温度下既能使目标物充分汽化,又不会破坏其结构。柱温的起始温度设为70 ℃,足以将溶剂汽化。该试验中乙草胺大约在11.70 min出峰,通过多种基质试验,目标物在此位置能与杂质峰完全分开,但在具体应用时,仍可根据实际情况对程序升温进行调整。终温设为280 ℃保持5 min以保证清洁色谱柱,特别是作动物组织样品时,可以多保留几分钟。
2.2.3质谱条件。
离子源温度230 ℃,接口温度280 ℃,溶剂延迟时间:4 min。
乙草胺的EI质谱图在NIST标准谱库中检索到,其特征碎片离子主要为m/z 59、132、117、146、162、174、223。由于m/z 59的碎片分子量过小,干扰比较大,所以弃去m/z 59离子。通过乙草胺检测文献[9-10]及对乙草胺的质谱解析,选择m/z 146为定量离子,确定m/z 146、162、174、223为定性离子。质谱采用了SIM采集模式,得到较好的灵敏度。标准质谱图、选择离子图及标准总离子流图见图1~4。
2.3方法学考察
2.3.1标准曲线和线性范围。
吸取标准贮备液,用丙酮+正己烷(1+1)稀释成0.01、0.02、0.05、0.10、0.20、0.50 μg/mL标准溶液,在“1.3.3”色谱条件下检测,用峰面积与浓度进行线性回归来绘制标准曲线,得回归方程和相关系数。结果显示,乙草胺标准溶液线性范围为0.010~0.500 μg/mL,标准曲线回归方程Y=315.415 9X-36.671 9(R2=0.999 7)。
2.3.2检出限。
以10倍信噪比(S/N>10)所对应的待测物浓度为最低定量浓度,根据样品的浓缩倍数,确定该方法检出限。
经分析,该方法的检出限谷类、豆类、水果、蔬菜、草本植物、茶为5 μg/kg,蜂蜜和动物源食品为10 μg/kg;线性范围为0.010~0.500 mg/L。在线性范围以外时,可适当增大样品最终定容体积或减小样品净化体积。
2.3.3准确度和精密度。
样品的准确度用标准添加,测定回收率来评价,精密度用多次平行试验的相对标准偏差来评价。在“1.3.2”和“1.3.3”试验条件下,根据已知各国的限量水平对样品进行3个浓度标准添加,如表2所示。谷类、豆类、水果、蔬菜、草本植物、茶的回收率为72.4%~112.0%,相对标准偏差为4.7%~11.5%;蜂蜜、猪肌肉和猪肝的回收率为72.0%~105.0%,相对标准偏差5.0%~10.7%。
3结论与讨论
该研究建立的GC-MS测定草乙胺的方法经过详细的条件优化,选择出最佳条件,并进行方法性能指标分析。结果表明,该方法的检出限分别为谷类、豆类、水果、蔬菜、草本植物、茶为5 μg/kg,蜂蜜和动物源食品为10 μg/kg;线性范围为0.010~0.500 mg/L。方法的回收率分别为谷类、豆类、水果、蔬菜、草本植物、茶为82.4%~94.3%,RSD为4.7%~115%;蜂蜜、豬肌肉和猪肝为82.8%~90.0%,RSD为5.0%~10.7%。由此可见,该方法稳定、快速、准确,为实验室检测人员及技术研究人员提供了相应技术参考。
参考文献
[1] 中华人民共和国国家进出口商品检验局.出口商品中农药、兽药残留量及生物毒素生物学检验方法标准编写的基本规定:SN/T 0005—1996[S].北京:中国标准出版社,1996.
[2] 日本厚生劳动省.食安发第1003002号 GC/MS 农药等同时检测方法(农产品、畜产品)[A].日本厚生劳动省,2008-01-24.
[3] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.动物肌肉中478种农药及相关化学品残留量的测定 气相色谱-质谱法:GB/T 19650—2006[S].北京:中国标准出版社,2007.
[4] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.水果和蔬菜中 500种农药及相关化学品残留量的测定 气相色谱-质谱法:GB/T 19648—2006[S].北京:中国标准出版社,2007.
[5] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.粮谷中475种农药及相关化学品残留量的测定 气相色谱-质谱法: GB/T 19649—2006[S].北京:中国标准出版社,2007.
[6] 中华人民共和国国家质量监督检验检疫总局.进出口动物源性食品中氟甲喹残留量检测方法 液相色谱-质谱/质谱法:SN/T 1921—2007[S].北京:中国标准出版社,2007.
[7] ANASTASSIADES M,LEHOTAY S J,STAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solidphase extraction" for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[8] MIYAHARA M,SUZUKI T,SAITO Y. Multiresidue method for some pesticides in lanolin by capillary gas chromatography with detection by electron capture, flame photometric, mass spectrometric, and atomic emission techniques[J]. J Agric Food Chem,1992,40:64-69.
[9] YAN Q,WAN M F,ELATY A M A,et al. A "half" coreshell magnetic nanohybrid composed of zeolitic imidazolate framework and graphitic carbon nitride for magnetic solidphase extraction of sulfonylurea herbicides from water samples followed by LCMS/MS detection[J].Mikrochimica acta,2020,187(30):1567-1574.
[10] POZDNYAKOV I P,PARKHATS M V.Direct measurements of the reactivity of singlet oxygen to some persistent herbicides in aqueous solutions [J].Chemospher,2020,247:12587-12589.

