NLRP3炎性小体介导的细胞焦亡在高热量饮食小鼠认知功能障碍中的作用
董 雯,伦永志,刘 奔,孙 杰,潘凌鸿
(莆田学院药学与医学技术学院医学检验系 医学微生态学福建省高校重点实验室,福建 莆田 351100)
近年来,人们的日常膳食结构中,高糖高脂等高热量食物所占比例越来越重。高热量食物的摄入是一种不健康的饮食行为,被报道与轻度认知功能障碍(mild cognitive impairment,MCI)和阿尔茨海默病(Alzheimer's disease,AD)的发生发展密切相关[1-3]。大量研究结果表明,高热量饮食可诱导脑组织炎症相关因子表达,导致神经炎症发生,但其具体机制尚未明确[1,4-5]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体对机体免疫系统具有重要调节作用,在包括认知功能障碍疾病在内的多种疾病的发生发展中起重要作用[6]。NLRP3炎性小体活化,可激活下游一系列炎症反应,进而触发一种特殊的细胞程序性死亡——细胞炎性坏死,即细胞焦亡。高热量饮食是否通过脑内NLRP3 炎性小体介导的细胞焦亡影响认知功能目前尚不清楚。本研究拟探讨脑组织NLRP3 炎性小体介导的细胞焦亡在高热量饮食小鼠认知功能障碍中的作用及可能机制,以期为高热量饮食所致认知功能障碍寻求潜在病因。
1 材料与方法
1.1 实验动物及分组6 周龄雄性C57BL/6 小鼠20 只,体重18~22 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005,饲养环境温度20 ℃~24 ℃,相对湿度约40%~60%,昼夜比12 h∶12 h。适应性喂养1 周后,利用随机数字表将其随机分为正常饮食组(CON 组)和高热量饮食组(HCD 组),每组10 只。喂养期6 个月,自由饮食、饮水。实验过程严格执行国家实验动物管理与使用的相关法律法规。
1.2 主要试剂与仪器吖啶橙/溴乙锭(AO/EB)双荧光染色试剂盒购自北京雷根生物技术有限公司,白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)ELISA 试剂盒购自上海晶抗生物工程有限公司,RNA 提取试剂盒、cDNA 合成试剂盒和PCR 试剂盒购自美国invitrogen 公司,PCR 引物由上海生工生物工程有限公司设计并合成,Gemini EM 荧光读板机购自美国Molecular Devices 公司,实时荧光定量PCR 仪购自美国Bio-Rad 公司,新物体识别实验装置购自上海欣软信息科技有限公司,Morris 水迷宫购自中国医学科学院药物研究所。
1.3 实验方法
1.3.1 动物认知功能检测喂养6个月后,各组小鼠进行新物体识别实验和Morris 水迷宫实验,在上午9∶00-12∶00进行。
新物体识别实验:3 d 训练期和1 d 测试期。训练期,在实验装置底板放入2 个大小形状完全相同的物体(A 和B),然后将小鼠以背对物体的方向放入实验装置中,自由探索5 min。测试期,将物体A更换为完全不同的新物体C,测试5 min,分别记录小鼠对每个物体B 和C 的探索时间,并计算识别系数,即测试期小鼠对新奇物体的探索时间与测试时间的比值。
Morris 水迷宫实验:5 d 定位航行试验和1 d 空间探索实验。定位航行试验,将平台固定于水下1.5~2 cm 处,小鼠面向池壁放入水中,时间限制为60 s,记录其到达平台的时间(逃避潜伏期)。空间探索实验,将水下平台撤除,小鼠面向池壁放入水中,记录小鼠首次到达原平台所在位置所用时间(视为d6 的逃避潜伏期)及60 s 内穿越原平台位置次数。
1.3.2 标本收集各组小鼠认知功能检测完成后,水合氯醛腹腔注射(3 mL·kg-1)处死后立即置冰盘断头取脑,快速剥离海马组织,于液氮速冻,-80 ℃冰箱保存备用。
1.3.3 AO/EB 荧光比色法将海马组织剪碎并用0.25% 胰酶消化,混匀,4℃1000 r·min-1离 心5 min,取沉淀,加入50 μL AO/EB 染液,混匀,反应1 min 后,用人工脑积液稀释至200 μL,应用荧光读板机进行测定并记录样本管和空白对照管的OD值。每个样品重复测3次。
1.3.4 RT-PCR 法检测将海马组织匀浆后,用Trizol 试剂提取总RNA。按照cDNA 合成试剂盒说明书,逆转录合成cDNA。应用实时荧光定量PCR仪进行PCR 扩增,引物信息见表1。以GAPDH 为内参,每个样本设置3 个复孔,得平均Ct,采用2-ΔΔCt法计算目的基因的相对表达量。
1.3.5 ELISA 法检测在海马组织中,加入裂解液匀浆,4 ℃离心后取上清,使用ELISA 试剂盒测定IL-1β和IL-18蛋白含量。
1.3.6 统计学处理采用SPSS 19.0 软件进行数据分析。计量资料用均值±标准差(-)表示。除了逃避潜伏期组间比较采用重复测量方差分析,其余数据采用t检验。P<0.05为差异有统计学意义。
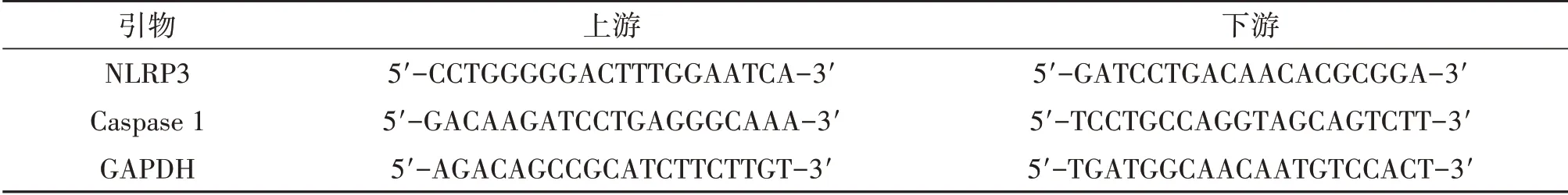
表1 PCR引物序列
2 结 果
2.1 高热量饮食小鼠认知功能新物体识别实验结果如图1A 所示,HCD 组较CON 组对新物体C 的识别系数显著降低(t=1.43,P<0.05)。
Morris 水迷宫逃避潜伏期变化如图1B 所示,两组小鼠逃避潜伏期时间差异有统计学意义(F组间=5.64,P组间<0.05),且第3 天开始,HCD 组逃避潜伏路程显著长于CON组(t3=-9.19,P<0.05;t4=-12.40,P<0.05;t5=-8.67,P<0.05 和t6=-8.97,P<0.05);CON 组与HCD 组小鼠逃避潜伏期时间均有随时间缩短的趋势(F时间=4.24,P时间<0.05);组间与时间无交互作用(F交互=1.02,P交互>0.05)。穿越原平台位置次数结果如图1C 所示,HCD组较CON组次数显著减少(t=4.39,P<0.05)。
上述行为学结果提示,长期高热量饮食导致小鼠认知功能明显下降,发生障碍。
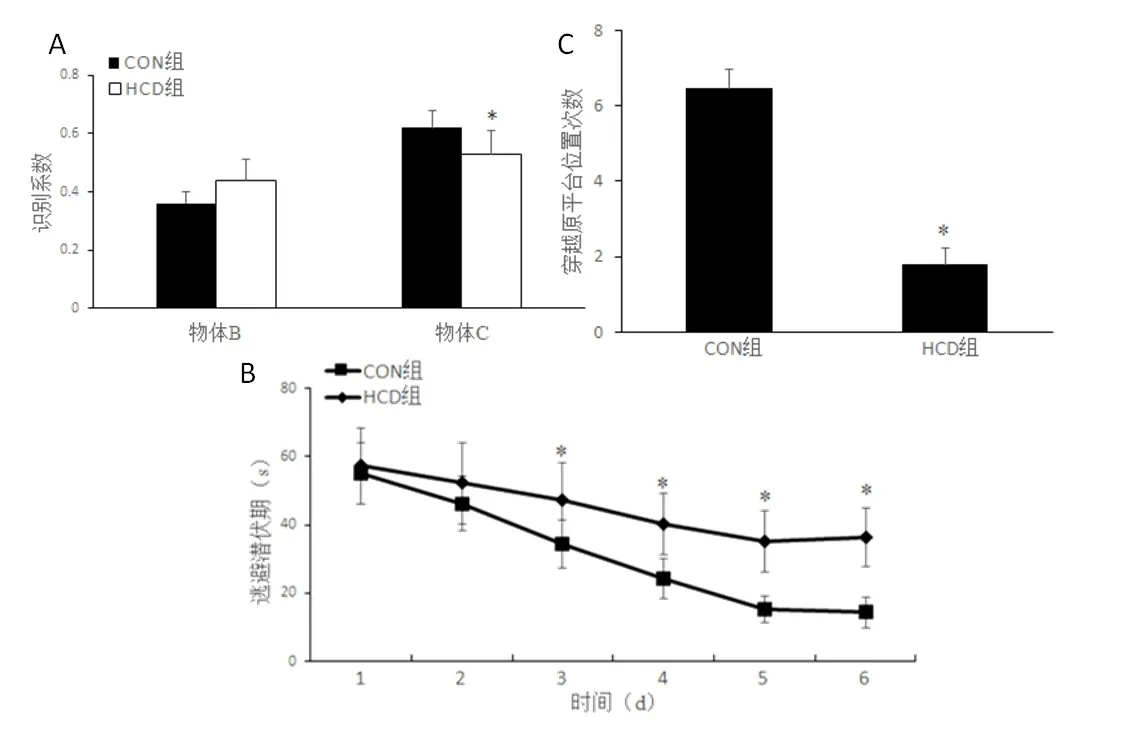
图1 两组小鼠新物体识别系数(A)、水迷宫逃避潜伏期(B)和穿越原平台位置次数(C)的比较
2.2 高热量饮食小鼠海马组织细胞焦亡水平AO/EB 荧光比色法结果如图2 所示,HCD 组较CON组OD 值显著升高(t=-85.30,P<0.05)。结果提示,长期高热量饮食导致小鼠海马组织细胞焦亡水平升高。
2.3 高热量饮食小鼠海马组织NLRP3和Caspase 1 mRNA 表达水平RT-PCR 检测结果如图3 所示,HCD 组较CON 组海马组织NLRP3 和Caspase 1 mRNA 表 达 均 显 著 升 高(t=-4.82,P<0.05 和t=-3.95,P<0.05)。

图2 两组小鼠AO/EB染色OD 值的比较

图3 两组小鼠海马组织NLRP3和Caspase 1 mRNA表达水平的比较
2.4 高热量饮食小鼠海马组织IL-1β和IL-18蛋白表达水平ELISA 检测结果如图4 所示,HCD 组较CON 组海马组织IL-1β 和IL-18 蛋白表达均显著升高(t=-17.58,P<0.05和t=-23.12,P<0.05)。

图4 两组小鼠海马组织IL-1β和IL-18蛋白表达水平的比较
3 讨 论
本研究采用高热量饮食6个月诱发认知功能障碍小鼠模型,结果显示经过相应处理的小鼠对新物体的识别记忆能力显著降低,水迷宫逃避潜伏期显著延长,穿越原平台位置次数显著减少,海马依赖性学习记忆能力受损,提示模型构建成功,这与国内外相关研究结果一致[7-8]。长期高能量饮食可引起中枢神经系统病变,如产生MCI 和AD 等神经退行性疾病,且在中枢神经系统病变常伴随神经炎症的发生发展[4-5,9]。中枢神经系统炎症水平的升高致神经细胞死亡增加,与认知功能下降和痴呆风险增加有密切相关性[10]。高能量饮食可诱导脑组织炎症反应的发生。而有关神经炎症如何通过介导细胞死亡参与高热量饮食致认知功能障碍疾病的发生和发展进程鲜见报道。
细胞焦亡,又称细胞炎性坏死,是一种伴随着炎症反应的细胞程序性死亡方式,近年来,其在神经系统疾病的发病及防治研究备受关注。多数学者认为,细胞焦亡在AD 等神经系统疾病的发生发展中起关键作用[11]。细胞焦亡,不同于凋亡和坏死引起的细胞死亡方式,是在内源性或外源性刺激下,核苷酸结合寡聚化结构域样受体家族(NLRs)蛋白激活,并与Caspase 1结合,形成炎性小体,进而促进关键促炎因子IL-1β 和IL-18 产生和释放,启动并扩大炎症级联反应,导致神经细胞死亡。研究发现,细胞焦亡发生必须满足两个条件,即炎症小体形成和促炎因子IL-1β和IL-18释放[12]。
NLRP3 是NLRs 家族的重要成员之一,是一种主要的模式识别受体,不仅能识别病原微生物,还能识别内源危险信号和某些代谢产物。识别活化后的NLRP3 将与Caspase 1 组成炎性小体,即NLRP3 炎性小体,是中枢神经系统最主要的炎性小体之一,中枢神经系统病理生理中起关键作用。适度的NLRP3 炎性小体激活有助于快速而有效地清除病原微生物及其他各种危险信号;持续过度的激活将导致神经组织损伤并参与AD、帕金森病等神经退行性疾病的进展[13]。研究表明[14],抑制NLRP3炎症小体的激活可以改善AD 模型动物的行为学和病理损害。到目前为止,中枢神经系统NLRP3 炎性小体的激活机制尚不明确,可能与胞内钾离子外流、溶酶体破坏、线粒体功能障碍及活性氧过量产生有关。研究发现[15],高糖高脂等高热量饮食所引起的体内代谢异常,导致高血糖、高血脂,使神经细胞线粒体功能障碍及大量活性氧累积。本研究应用RT-PCR 法检测HCD 组小鼠海马组织NLRP3 和Caspase 1的mRNA 表达,发现两者表达较CON 组显著升高;AO/EB 双荧光染色表明,HCD 组小鼠海马组织细胞死亡数量较CON 组显著升高,提示NLRP3炎性小体的形成与高热量饮食小鼠海马神经细胞的死亡密切相关,是认知功能障碍发生发展的重要机制之一。
NLRP3 炎症小体是介导神经炎症反应的关键信号途径之一。Caspase 1 又称为IL-1β 转化酶,可对无生物活性的IL-1β 前体和IL-18 前体进行剪切,形成有生物活性的IL-1β 和IL-18,促进炎症反应的发生发展,导致组织损伤,引起致炎性细胞死亡—细胞焦亡。研究发现[16],敲除Caspase 1,脑组织神经炎症减轻和神经元死亡减少。本研究应用ELISA法检测HCD 组小鼠海马组织IL-1β 和IL-18 的蛋白表达,发现两者表达较CON 组显著升高,提示高热量饮食引起NLRP3炎性小体形成后,促炎因子IL-1β和IL-18 表达增加,导致细胞焦亡发生发展,是认知功能障碍形成的重要机制之一。
综上所述,细胞焦亡与高热量饮食小鼠认知功能障碍的发生发展有着密切相关性,高热量饮食通过激活海马组织NLRP3 炎性小体,促进关键促炎因子IL-1β 和IL-18 生成,进而引起细胞焦亡,导致认知功能损伤。细胞焦亡信号通路中任何一种物质的生成或激活均可影响神经退行性疾病的进展。需进一步深入对高热量饮食所致细胞焦亡相关信号通路的研究,以期为饮食相关神经损伤及认知功能障碍的发生发展及防治提供重要的生物学依据。

