培养液和体外保存方法对辽宁绒山羊胚胎活力的影响
豆兴堂,王占红,张晓鹰,朱延旭
(辽宁省现代农业生产基地建设工程中心,辽宁辽阳 111000)
辽宁绒山羊是我国优良的地方品种,因具有产绒量高、绒质好、适应性强、遗传性能稳定、改良各地土种绒山羊产绒效果显著等优点,被国内绒山羊产区引入以培育新品系或改良当地低产羊。胚胎移植是优良绒山羊扩繁的重要技术手段。在胚胎移植技术应用过程中,胚胎体外培养保存技术对胚胎活力有较大影响。胚胎活力即胚胎的死活,鉴定方法主要为形态学鉴定、染色检查、培养鉴定和移植检验[1]。对胚胎体外培养效果影响较大的主要因素包括氨基酸、抗氧化剂、pH、温度及气相环境等,目前较为常用的胚胎体外培养液有TCM199、Ham's F-10 营养混合物(Ham's F-10 Nutrient Mixture)、合成输卵管液(Synthetic Oviduct Fluid,SOF)、CR1、CZB 等[2]。一般在化学成分明确的培养液中适当减除、替代或添加某些组分培养胚胎,通过评定培养后的胚胎活力和发育效果,以观察分析处理因素对胚胎发育的影响和改进培养液。有研究发现,高浓度的必需氨基酸代谢和自由降解中会产生对胚胎有毒性的铵[3],培养系统中添加β-巯基乙醇(β-Mercaptoethanol,β-ME)可有效支持8-细胞期山羊胚胎克服发育阻滞而提高桑葚胚发育率[4]。目前,胚胎保存技术在超低温(-196 ℃)[4]、低温(4~6 ℃)[5]和常温(22~25 ℃)[6]方面的研究已有报道,未见正常体温(37~38.5℃)条件下相关研究报道。本实验尝试通过优化SOF 液,比较杜氏磷酸缓冲盐溶液(Dulbecco's Phosphate Buffer Saline,DPBS)、SOF、调整合成输卵管液(Modify Synthetic Oviduct Fluid,m-SOF)对胚胎活力的影响,筛选最佳胚胎培养液;以筛选出的培养液作为胚胎保存液,比较胚胎体外保存方法对胚胎活力的影响,以期对绒山羊鲜胚保存、异地移植技术应用有所借鉴。
1 材料与方法
1.1 实验试剂与器材
1.1.1 药品 卵泡刺激素(Follicle-Stimulating Hormone,FSH)(加拿大,400 mg,批号:R9D19A),促黄体生成素(Luteinizing Hormone,LH)(中国科学院),阴道孕酮栓(EAZI-BREED CIDR)(新西兰),碘酊,酒精(75%,95%)等。
1.1.2 设备 CO2培养箱(Heracell 150),立体显微镜(Minitube),倒置显微镜(Leica,带摄录软件),便携式恒温箱(Labotect),数控恒温板(Leica),电子天平(精度0.000 1 g),自制手术车,移液器(1000 μL 可调,200 μL 可调,20 μL 可调)等。
1.1.3 器械 手术刀柄、刀片、手术剪、止血钳、持针钳、缝合针等手术器械。
1.1.4 耗材 冲胚管,集卵杯,冲胚针,敷料,缝合线,脱脂棉,巴氏玻管,0.22 μm 滤器,35 mm 培养皿,离心管(1.5 mL),锡纸,封口膜等。
1.1.5 试剂 实验试剂包括DPBS(Gibco)、FBS(澳洲)、谷丙二肽(Alanyl-L-glutamine,Ala-Gln)(A8185,≥98%)、β-ME(M3148,≥99.0%)、青链霉素液、BSA、HEPES、Na-Lactate、Na-Pryuvate、L-谷 氨 酰胺(L-Glutamine,L-Gln)、NaCl、MgCl2、CaCl2、KCl、NaH2PO4、KH2PO4、NaHCO3、必需氨基酸(Essential Amino Acids,EAA)、非必需氨基酸(Non-Essential Amino Acids,NEAA)、Mineral Oil 等,以上试剂除注明外,均为Sigma 试剂。
1.2 实验方法
1.2.1 胚胎获取 于2018 年4 月28 日—5 月17 日、9月12 日—9 月28 日选取3~6 岁辽宁绒山羊母羊,进行超数排卵处理[7]。在母羊情期任意一天生殖道放置CIDR,并计为第0 天,第11 天下午开始肌肉注射FSH 1 mL,直到第15 天上午肌肉注射FSH 1 mL,期间每天上、下午各注射FSH 1 次,间隔12 h,第13 天下午同时肌肉注射PG 1 mL,第14 d 上午同时撤栓,第15 天公羊试情,若母羊发情,公羊本交配种同时肌肉注射LH 100 IU。配种后第6 天,手术法子宫角冲取桑椹期-早囊期胚胎。获取的胚胎洗涤1~3 次,经胚胎形态学鉴定[8]发育阶段与质量,备用。
1.2.2 胚胎活力评定 本实验应用染色法和体外培养法评定胚胎活力。培养和保存前胚胎应用形态鉴别法鉴定胚胎发育阶段,0.5% 台盼蓝溶液[1]染色鉴定胚胎活力,鉴定为活胚胎的进行培养和保存实验;培养后的胚胎再经形态鉴别法和染色法评定胚胎活力,即经体外培养后胚胎向下一阶段发育即为活胚胎,形态变化不大的经染色法评定活力。胚胎体外培养保存液是以PBS[7]液和SOF[9]液为基础液,添加EAA、NEAA、BSA、FBS 等分别配制成胚胎保存液。
1.2.3 胚胎体外培养保存方法 从供体母羊冲取的胚胎,经形态学鉴定发育阶段和质量合格后,用2 种方法进行保存,24 h 后经形态学鉴定胚胎发育阶段与质量。方法Ⅰ:同一只母羊的相同发育阶段的胚胎,置入200 μL保存液液滴中(在35 mm 培养皿中做4 个200 μL 液滴),2 枚/液滴,上覆矿物油,做好胚胎发育阶段、数量标记。35 mm 培养皿用封口膜密封皿盖与皿体间隙,外包裹锡纸,置于38.5℃恒温板。方法Ⅱ:同一只母羊的相同发育阶段的胚胎,置入500 μL 保存液上覆矿物油的1.5 mL 离心管中,2 枚/管,做好胚胎发育阶段、数量标记。离心管口与盖用封口膜密封,外包裹锡纸,置于37℃便携式恒温箱中。
1.2.4 实验设计 实验从优化调整SOF[9]胚胎保存液、SOF 液与DPBS 液对胚胎活力的影响和胚胎保存方法对胚胎活力的影响方面进行研究。实验Ⅰ:以1 mmol/mL Ala-Gln[10-11]替换1 mmol/mL L-Gln、添加0.5 g/Lβ-ME的SOF 液为实验组,于38.5 ℃、5% CO2、5% O2、95% N2饱和湿度培养条件下培养24 h,对比实验组与对照组(SOF 液)对胚胎活力的影响;实验Ⅱ:以1 mmol/mL Ala-Gln 替换1 mmol/mL L-Gln、10 mmol/L HEPES[11]和4 mmol/L NaHCO3替 换25 mmol/L NaHCO3、添加0.5 g/Lβ-ME 的m-SOF 液为实验组,于38.5℃、5%CO2、5% O2、95% N2饱和湿度培养条件下培养24 h,比较与SOF 液组、DPBS 液组对胚胎活力的影响;实验Ⅲ:以实验Ⅱ筛选的培养液为保存液,采用保存方法Ⅰ和方法Ⅱ保存胚胎,于24、36 h 评价胚胎发育情况,比较胚胎体外保存方法对胚胎活力的影响。
1.3 统计分析 利用SPSS 15.0 软件Independent-Samples T Test 和One-Way ANOVA 模块进行数据差异显著性检验。P>0.05 表示差异不显著,P<0.05 表示差异显著;P<0.01 表示差异极显著。
2 结果
2.1 Ala-Gln、β-ME 对绒山羊胚胎活力的影响 由表1 可知,添加1 mmol/mL Ala-Gln、5 g/Lβ-ME 的 SOF 胚胎培养液组胚胎发育率高于对照组(P>0.05)。表明添加Ala-Gln 和β-ME 能够维持绒山羊胚胎体外正常发育环境,促进胚胎体外发育。

表1 添加Ala-Gln、β-ME 对绒山羊胚胎活力的影响
2.2 m-SOF、SOF 和DPBS 液对绒山羊胚胎活力的影响由表2 可知,m-SOF 组的胚胎发育率显著高于SOF 组,极显著高于DPBS 组;SOF 组的胚胎发育率极显著高于DPBS 组。这表明添加Ala-Gln、β-ME、HEPES 和调整NaHCO3含量的m-SOF 液更适合于胚胎体外发育,HEPES 对胚胎体外发育没有不良影响。
2.3 体外保存方法对绒山羊胚胎活力的影响 由表3 可知,胚胎保存方法Ⅱ于体外保存24 h 时胚胎发育率低于保存方法Ⅰ(P>0.05),但36 h 时胚胎发育率高于保存方法Ⅰ(P<0.01)。实验结果表明,随着胚胎体外保存时间延长,保存方法Ⅱ更适于胚胎体外发育。图3-A为胚胎体外保存方法Ⅱ保存后部分发育的胚胎,图3-B为使用便携式恒温箱的胚胎体外保存方法Ⅱ,图3-C 为胚胎体外保存方法Ⅱ保存后部分脱带囊胚,可见脱带囊胚和游离的透明带。

表2 m-SOF、SOF 和PBS 液对绒山羊胚胎活力的影响
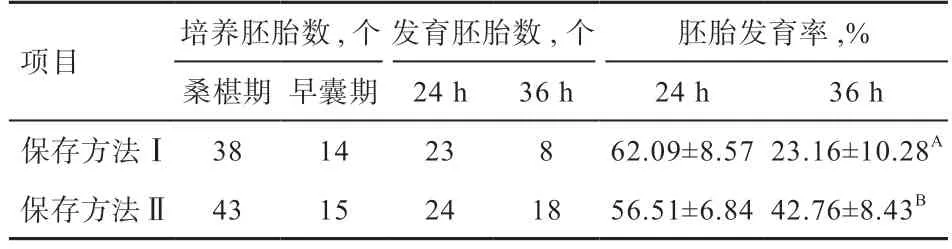
表3 体外保存方法对绒山羊胚胎活力的影响
3 讨 论
羊胚胎体外培养一般用添加氨基酸、血清等成分的SOF 液,体外保存时胚胎易受到保存液pH、氧化、代谢产物副作用及温度波动等因素影响而导致发育失败。本实验中,与对照组相比,添加1 mmol/mL Ala-Gln、5 g/Lβ-ME 的 SOF 液提高了体外培养24 h 的胚胎活力,可能与Ala-Gln 和β-ME 的特性与作用有关。Ala-Gln 是丙氨酸与谷氨酰胺形成的二肽,对热消毒具有稳定性,形成的氨损害效果比Gln 小,可能对胚胎有保护作用,促进胚胎增殖发育。赵敬湘等[12]研究表明,Ala-Gln 对细胞缺氧缺糖损伤有明显的保护作用;刘志青[13]研究发现,Ala-Gln、Gln 和Ala 补充都能促进受损C2C12成肌细胞的分化能力,而只有补充Ala-Gln 可提高受损细胞的增殖能力。β-ME 可以减少二硫键,并且能通过清除羟基自由基等,具有抗氧化作用。舒建洪等[14]研究发现β-ME 对牛卵母细胞核成熟无促进作用,但可提高牛孤雌胚胎的卵裂率并促使囊胚发育。相关研究结果印证了Ala-Gln、β-ME 对胚胎发育的促进作用。
进一步优化的m-SOF 液胚胎体外培养24 h 的胚胎活力极显著高于DPBS 液,显著高于SOF 液,表明HCO3-1与HEPES-1酸碱缓冲适于胚胎发育所需酸碱环境。m-SOF 液相比SOF 降低了HCO3-1浓度,增加了HEPES、Ala-Gln、β-ME 等成分,HCO3-1与HEPES-1协同增强了酸碱缓冲能力,pH 保持在7.1~7.5,为胚胎发育提供了稳定的酸碱环境[10]。DPBS 液成分简单,优点是在低温中能够较长时间保持pH 稳定[8]。本试验中DPBS 液体外培养24 h 胚胎活力为43.93%。

图3 胚胎体外保存方法和保存后胚胎
羊胚胎移植技术实际应用中,若开展胚胎异地运输、移植等种羊扩繁工作,胚胎体外保存技术将成为胚胎移植效率的重要影响因素,一般有超低温、低温、常温等保存形式。本实验结果显示,保存方法Ⅱ保存胚胎36 h 时胚胎活力为42.76%,极显著高于保存方法Ⅰ,可能与方法Ⅱ温度为37℃低于方法Ⅰ38.5℃有关,胚胎在体外38.5℃环境下可能发育较快,2 次观察时已发育到扩张囊胚期的胚胎形态变化不大,但37℃下胚胎体外保存时间更长些、活力高。保存24 h 时保存方法Ⅰ的胚胎活力高于保存方法Ⅱ,可能与温度有关。
4 结 论
本实验结果表明,在38.5 ℃、5% CO2、5% O2、95% N2饱和湿度条件下,用m-SOF 液培养绒山羊胚胎可以获得较高的发育率;以m-SOF 液、保存方法Ⅱ(胚胎置入上覆矿物油的500 μL 保存液的1.5 mL 离心管中,2 枚/管,离心管口与盖用封口膜密封,外包裹锡纸,置于37℃便携式恒温箱中保存)保存胚胎36 h 时发育率为42.76%。还需要进一步开展保存胚胎的移植实验,依据胚胎移植妊娠率来验证胚胎体外保存方法的有效性。

