方解石与硅灰石可浮性差异的机理研究
赵晨, 印万忠, 朱一民, 王中明, 肖巧斌
1. 矿冶科技集团有限公司 选矿研究设计所,北京 100160;
2. 东北大学 资源与土木工程学院,辽宁 沈阳 110819
方解石的主要成分是CaCO3,为冶金、玻璃、水泥、橡胶等多种工业生产的重要原料。硅灰石的主要成分是CaSiO3,其主要用途是作为陶瓷工业的配料。此外,硅灰石在塑料、橡胶、电焊和绝缘产品等领域也有着广泛的应用[1, 2]。自然界中,方解石常与硅灰石及其他硅酸盐矿物共生[3]。方解石与硅灰石同属于含钙矿物,因矿物晶格中都含有相同的Ca2+而具有一些相似的表面特性及溶解特性[4];同时,由于所含阴离子基团的不同,又使两种矿物在浮选中表现出一定的差异性[5]。国内,毛钜凡、程卫泉[3]研究了油酸钠作捕收剂时,溶液中游离的金属阳离子对硅灰石浮选的影响,发现Ca2+的存在使硅灰石的可浮性发生了显著提高,且在pH 11.0~12.0时,硅灰石上浮量达到最大值。袁继祖[4]就阴离子捕收剂浮选分离方解石、硅灰石、长石、石英进行了探讨,发现在弱酸性和弱碱性矿浆中,十二胺烷硫酸钠和氧化石蜡皂均能捕收方解石,而在上述条件下,硅灰石、石英、长石均不浮。国外,Huang Fugen和R Sivamohan[6]针对粒度对方解石和硅灰石浮选分离的影响进行了研究。目前,国内外专门研究方解石和硅灰石浮选分离的文献较少,对于方解石和硅灰石可浮性差异产生的机理,也缺乏较为系统的研究。
本文以十二胺与油酸钠作为捕收剂,研究了方解石与硅灰石的可浮性差异,并通过Zeta电位分析和两种矿物饱和溶液中各溶解组分的logC-pH分析,研究了方解石与硅灰石在矿浆中的表面荷电情况;通过X射线光电子能谱(XPS)分析和MS模拟,分析了两种矿物表面Ca质点密度和Ca不饱和键密度的差异,解释了两种矿物可浮性差异产生的晶体化学根源。
1 试验
1.1 矿样
单矿物浮选试验所用方解石和硅灰石均为外购矿石,经破碎、手选后得到纯度较高的矿样,其中有用矿物成分的含量均大于95%。两种单矿物的X射线衍射能谱(XRD)如图1所示。由图1可见,所制得方解石和硅灰石均为纯度较高的矿样,符合单矿物浮选的要求。
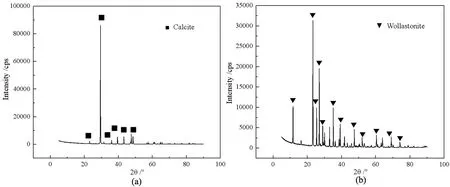
图1 方解石与硅灰石的XRD能谱图
1.2 试验方法
1.2.1 单矿物浮选试验
浮选采用吉林探矿机械厂生产的XFGII型机械搅拌式挂槽浮选机,主机转速为1 800 r/min。每次试验取2 g矿样于30 mL浮选槽中,加25 mL去离子水,搅拌3 min后使用NaOH和HCl调节矿浆pH值,加入捕收剂浮选6 min。浮选结束后,将泡沫产品和槽内产物分别烘干称重,计算矿物的浮选回收率。
1.2.2 X射线衍射能谱分析(XRD)
X射线衍射分析采用荷兰PANalytical公司的X’Pert HighScore Plus分析仪于室温25 ℃下进行。扫描范围为5-9 °,扫描速度为10 °/min。制样时用玛瑙研钵将矿样研磨至5 μm以下,压片后进行测试得到矿物X射线衍射能谱。
1.2.3 Zeta电位测试
Zeta电位测试采用英国Malvern公司的Nano-ZS90电位仪在室温25 ℃下进行。测试时先将0.02 g矿样磨细至-5 μm,加去离子水置于50 mL烧杯中,再加入浮选药剂搅拌3 min后,静置5-10 min,抽取上清液进行测试。须测3次取算术平均值。
1.2.4 X射线光电子能谱(XPS)分析
X射线光电子能谱测试在美国Thermo Scientific公司的ESCALAB 250XI型光电子能谱仪上进行。激发光源为MgKα,全谱扫描射线能量步长为0.5 eV,元素精细扫描能量步长为0.2 eV。测试时将样品在去离子水介质中调节pH值,按浮选顺序加药后搅拌过滤,自然风干后送检。
1.2.5 MS模拟
使用Materials Studio 8.0软件中基于密度泛函理论的CASTEP模块,在交换相关泛函为GGA-PBE[7],截断能按计算精度选取为300.0 eV,布里渊区积分采用Monkhorst-Pack形式按精度取k点的方法[8],赝势选取Ultrasoft,计算精度均设置为Medium,其他参数为默认参数,对方解石和硅灰石的晶体结构进行结构优化与能量计算,建立超晶胞和进行切表面计算,计算两种矿物主要解离面上的Ca质点密度和Ca不饱和键密度。
2 结果与分析
2.1 单矿物浮选试验
2.1.1 方解石和硅灰石的可浮性试验
十二胺与油酸钠用量分别为80 mg/L,且不添加其他任何调整剂的条件下,方解石与硅灰石的浮选回收率随pH值变化的情况分别如图2、图3所示。
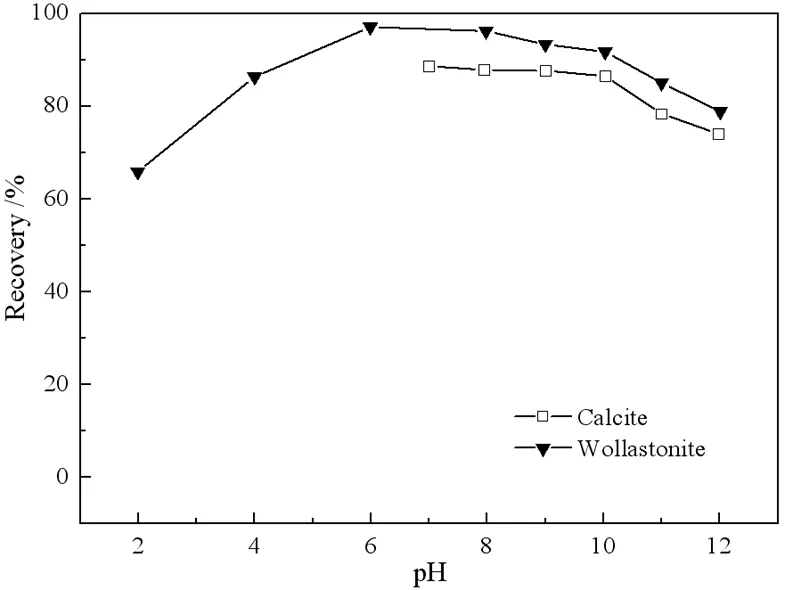
图2 十二胺作捕收剂时pH值对方解石与硅灰石浮选回收率的影响
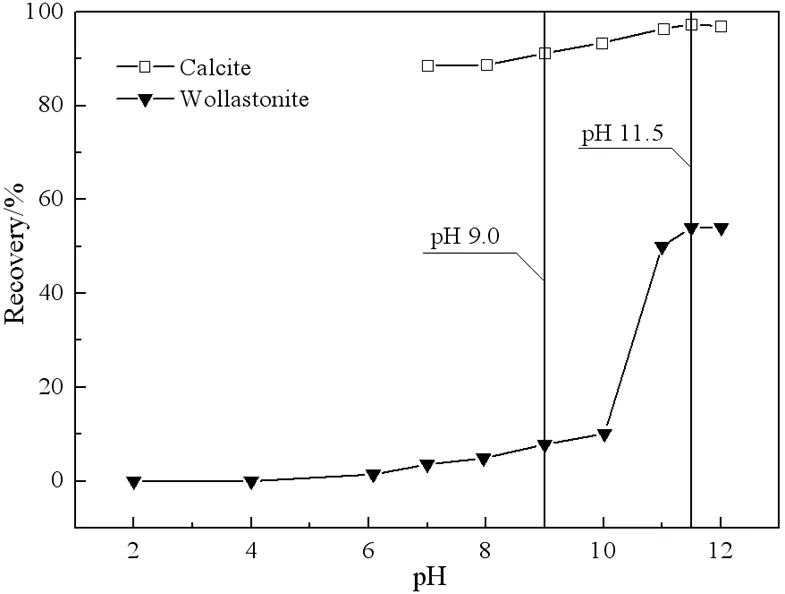
图3 油酸钠作捕收剂时pH值对方解石与硅灰石浮选回收率的影响
为避免方解石在酸性条件下发生溶解,故选择pH 7.0~12.0的pH值范围对方解石进行可浮性研究。图2中,方解石在pH 7.0~12.0,硅灰石在pH 2.0~12.0的pH值范围内均具有较好的可浮性,且在碱性条件下,两者的可浮性接近。pH 7.0时,方解石获得最大浮选回收率为88.63%。此后,方解石的浮选回收率随着pH值的升高而略有下降。pH<6.0时,硅灰石的浮选回收率先随着pH值的增加而上升,而后,当pH>6.0时,又随着pH值的升高而下降。硅灰石的浮选回收率在pH 7.0时达到最大值97.05%。
由图3可见,在油酸钠作用下,方解石与硅灰石的浮选回收率均随着pH值的增加而上升。在pH 7.0-12.0的pH值范围内,方解石的可浮性均大于90%,其最大浮选回收率为97.39%(pH 11.5)。硅灰石在pH<10.0时,浮选回收率随pH值的增加略有增加,但都低于10%,但当处于较高pH值(pH 10.0~12.0)时,硅灰石的浮选回收率有了显著上升。硅灰石的最大浮选回收率发生在pH 11.5(54.03%)。pH 9.0时,方解石与硅灰石的浮选回收率分别为91.20%和7.78%,此时回收率差值最大,为83.42%。
2.2 方解石与硅灰石可浮性差异的机理分析
2.2.1 Zeta电位分析
纯水中方解石与硅灰石的Zeta电位如图4所示。图4中方解石的零电点为pH 9.2,即当pH<9.2时,方解石表面净剩电荷为正;而当pH>9.2时,方解石表面净剩电荷为负,但此时方解石的Zeta电位仍远高于硅灰石的Zeta电位。图4中硅灰石的零电点为pH 1.3。在pH 1.3~12.0的pH值范围内,硅灰石表面净剩电荷为负。
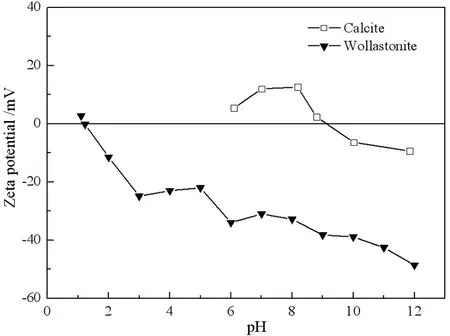
图4 方解石与硅灰石的Zeta电位
为了更好地说明矿物的Zeta电位对于浮选的意义,以下结合不同pH值条件下浮选药剂的有效成分进行分析。长链脂肪胺、长链脂肪酸、磺酸盐和硫酸盐等长链表面活性浮选剂,由于药剂烃链较长,链间范氏力作用较强,可以发生疏水缔合作用,一定浓度下,会形成二聚物、离子-分子缔合物;较高的浓度下,则形成半胶束或胶束[9]。根据十二胺和油酸钠在纯水溶液中的溶解平衡和疏水缔合平衡,绘制出80 mg/L十二胺与80 mg/L油酸钠溶液中各组分的logC-pH图分别如图4、图5所示。
由图5可见,十二胺在pH<10.0时,主要以RNH3+、RNH2·RNH3+等阳离子形式存在;pH≥10.0时,主要以RNH2分子的形式存在,但仍有RNH3+存在。由图6可见,当pH<8.7时,油酸钠以HOl分子和Ol-、(Ol)22-等阴离子形式存在;pH≥8.7时,以Ol-、H(Ol)2-等阴离子形式存在。由于十二胺主要以阳离子的形式作用于矿物表面的负电区域[9, 10],所以当十二胺与硅灰石发生作用时,硅灰石在pH 2.0~12.0的pH值范围内都具有较好的可浮性。反之,当油酸钠与硅灰石发生作用时,由于油酸钠主要是以化学吸附的形式作用于盐类矿物表面的阳离子区域[11],故而油酸钠作捕收剂时方解石的可浮性较好,而硅灰石的可浮性在较大的pH值范围内均较差。
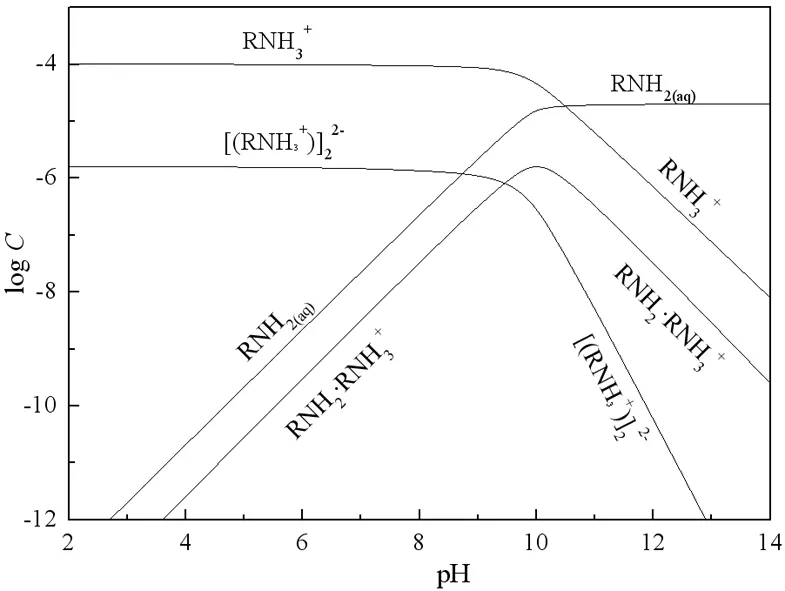
图5 十二胺各组分的logC-pH图
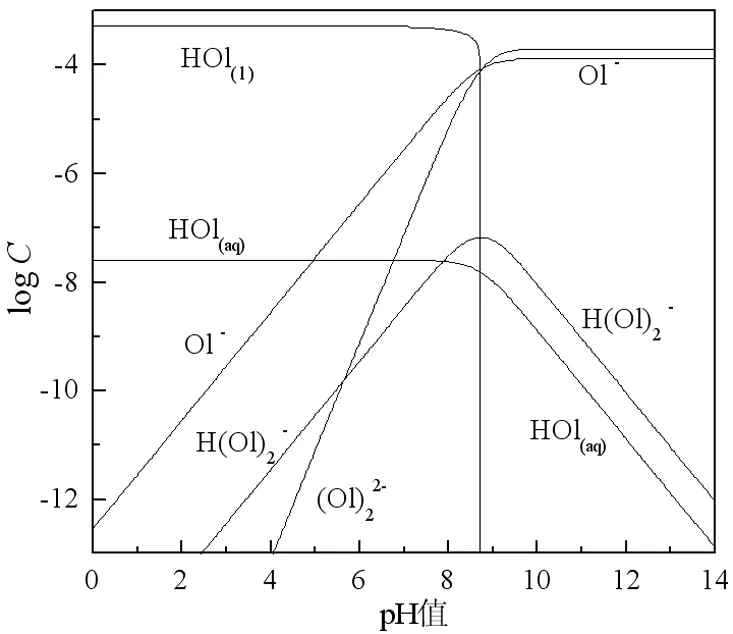
图6 油酸钠各组分的logC-pH图
2.2.2 矿物溶解组分的logC-pH分析
在矿物的饱和溶液中,存在有较多的矿物溶解离子,对浮选过程产生较大的影响[9]。根据热力学数据,由矿物的化学计量式和各种平衡关系,可以计算矿物在水中各溶解组分的浓度,并由此绘出logC-pH图,研究矿物各溶解组分随溶液pH值变化的关系。方解石、硅灰石各溶解组分的logC-pH图分别如图7、图8所示。
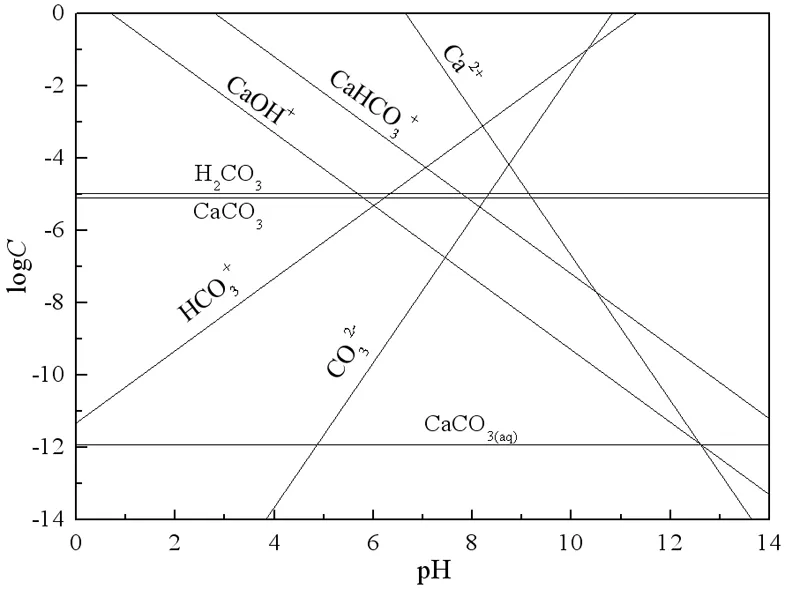
图7 方解石溶解组分的logC-pH图
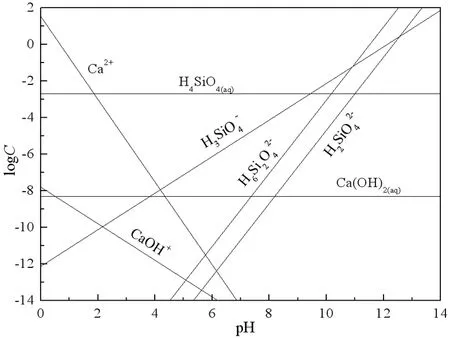
图8 硅灰石溶解组分的logC-pH图
由图7方解石在纯水中各溶解组分的logC-pH曲线可见,在低pH值下,方解石的饱和溶液中以Ca的各种水解阳离子为主,而在高pH值下,溶液中以CO32-和HCO3-离子为主。在图7中,根据“等当点(EP)”法[9]找出方解石的零电点,对应为方解石溶解组分中阳离子的正一价组分与阴离子的负一价组分浓度相等的pH值,即[CaHCO3+]=[HCO3-]时的pH值,图7中方解石的零电点为pH 7.2。在pH<7.2时,方解石表面的定位离子是CaHCO3+和CaOH+,而在方解石零电点pH 7.2附近,CaOH+、Ca2+和HCO3-是定位离子,高pH值下,CO32-和HCO3-是可能的定位离子。
由图8硅灰石在纯水中各溶解组分的logC-pH曲线可见,pH<7.0时,硅灰石的饱和溶液中以Ca2+和CaOH-为主,而pH≥7.0时,溶液中以H3SiO4-、H2SiO42-等阴离子为主。在图8中,根据“等当点(EP)”法找出硅灰石的零电点为pH 2.4。因此,在pH<2.4时,硅灰石表面的定位离子是Ca2+和CaOH+,而在高pH值下,H3SiO4-、H2SiO42-、H6Si2O42-是可能的定位离子。由于定位离子决定了矿物的表面电位[9, 12],方解石和硅灰石饱和溶液中各组分的logC-pH图进一步说明了两种矿物表面荷电情况差异产生的原因。
2.2.3 XPS分析
对pH 9.0和pH 11.5时的方解石和硅灰石进行XPS全谱扫描,两种矿物的XPS分析结果如表1、表2所示。
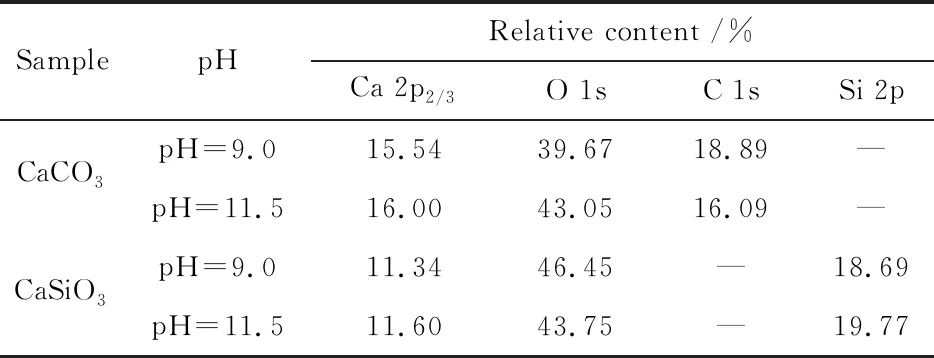
表1 方解石与硅灰石元素的相对含量
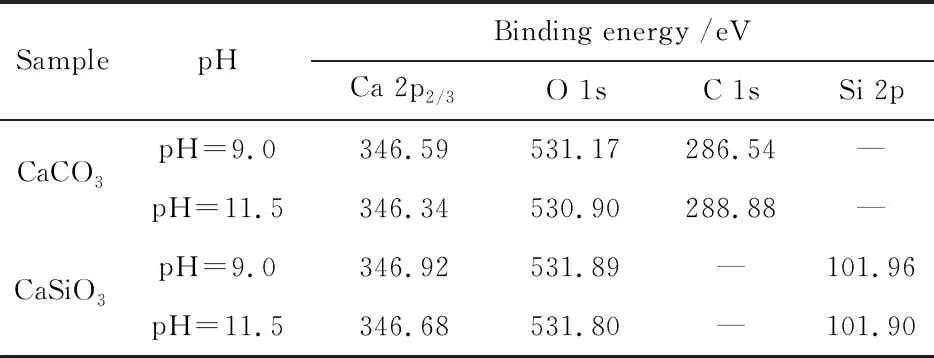
表2 方解石与硅灰石元素的原子轨道结合能
由表1方解石和硅灰石的元素相对含量可知,pH 9.0和pH 11.5时,方解石表面的Ca元素相对含量均高于硅灰石表面的Ca元素相对含量,因而导致方解石比硅灰石表面具有更大的阳离子区域,从而使方解石在溶液中比硅灰石具有更高的Zeta电位,这与前面两种矿物的Zeta电位结果是一致的。
对比表2中两种pH值条件下O、Ca的结合能可以发现,pH 11.5时,方解石和硅灰石中O、Ca的结合能均比pH 9.0时发生了偏移,这表明高pH值对两种矿物的表面环境产生了较大的影响。对pH 9.0和pH 11.5时硅灰石表面O的精细谱进行分峰拟合,结果如图7所示。
由图9(a)可知,pH 9.0时,结合能530.39 eV和531.98 eV位置处O元素的峰分别归属于硅灰石表面的Ca-O-[15]和Si-O-[16, 17]。图9(b)中,pH 11.5时,Si-O-和Ca-O-中O元素峰强度减弱,而在结合能531.20 eV位置出现归属于Ca(OH)2中的Ca-O-H[18]的新峰,说明此时在硅灰石表面有Ca的氢氧化物出现。对于硅灰石在pH>10.0的高pH值范围回收率增高的现象,王淀佐等[13]对金属离子浮选石英的研究结果表明,高pH值下,金属离子通过生成氢氧化物沉淀和羟基络合物的方式,对阴离子捕收剂浮选石英具有很好的活化作用。同样,对于典型的硅酸盐矿物硅灰石,虽然高pH值条件下硅灰石表面净剩电荷为负,但溶液中游离的Ca2+、Mg2+等离子却可以通过形成氢氧化物沉淀和羟基络合物的形式吸附在硅灰石表面,从而改善了油酸钠在硅灰石表面的吸附[9, 14]。
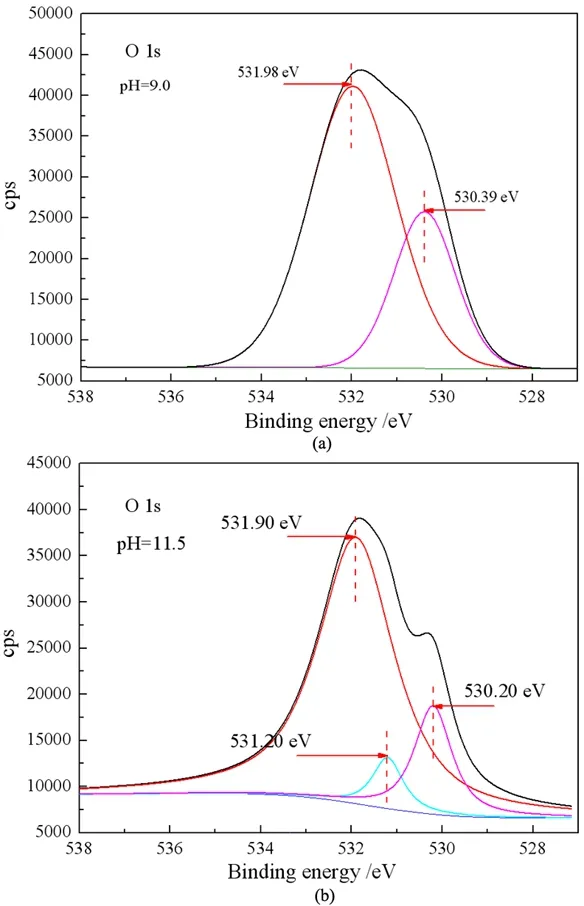
图9 pH 9.0(a)和pH 11.5(b)条件下硅灰石O1s元素的XPS能谱
2.2.4 MS模拟与矿物晶体化学分析
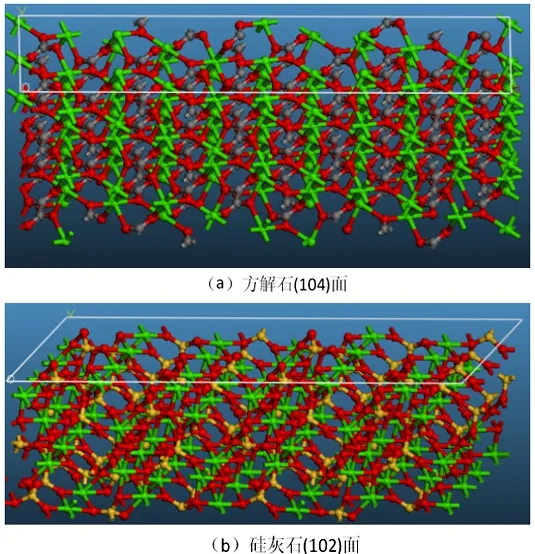
图10 方解石(a)和硅灰石(b)主要解离面上的Ca质点情况
根据图10的模拟结果,对方解石和硅灰石表面Ca质点密度和Ca不饱和键密度的测算结果如表3所示。
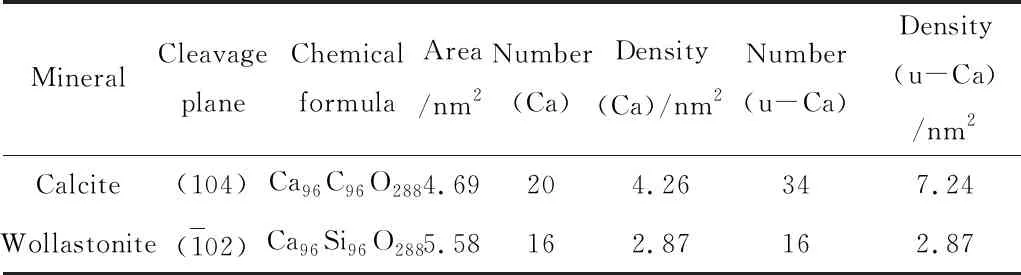
表3 方解石和硅灰石主要解离面上的Ca质点密度和Ca不饱和键密度
由表3中方解石和硅灰石表面Ca质点和Ca不饱和键密度的测算结果可知,方解石主要解离面上Ca质点密度比硅灰石主要解离面上Ca质点密度大;而方解石表面Ca不饱和键的密度也比硅灰石表面Ca不饱和键的密度大,这与两种矿物的XPS检测结果是一致的。当矿物与油酸钠发生接触时,方解石表面有着比硅灰石更多的作用活性位点和更多的反应不饱和键,从而使得油酸钠在方解石表面发生更大量的吸附。反之,具有较少表面Ca质点和Ca不饱和键的硅灰石在与油酸钠接触时,表面Ca质点更少,Ca不饱和键的数目也少,因而对油酸钠的吸附程度较小。
3 结论
(1)十二胺作捕收剂时,具有低Zeta电位的硅灰石的可浮性优于具有较高Zeta电位的方解石的可浮性;而油酸钠作为捕收剂时,具有较高Zeta电位的方解石的可浮性则优于低Zeta电位的硅灰石的可浮性。
(2)方解石和硅灰石的Zeta电位和矿物饱和溶液中各溶解组分的logC-pH分析表明,pH 2.0~12.0的pH值范围内,方解石比硅灰石带有更多的表面净剩正电荷,而这是由矿物表面的定位离子所决定的。
(3)方解石和硅灰石的XPS测试结果表明,方解石比硅灰石表面具有更高的Ca质点密度。而在pH 11.5时,硅灰石表面氢氧化物沉淀的出现,改善了油酸钠在硅灰石表面的吸附。