聚天冬氨酸对白钨矿和方解石浮选分离的影响及其作用机理
谢加文 付君浩 韩海生 陈占发 龙 冰 李文恒 徐 涛 吴江岳恩
(1.中南大学资源加工与生物工程学院,湖南 长沙 410083;2.湖南柿竹园有色金属有限责任公司,湖南 郴州 423037)
随着易选黑钨矿资源的开发殆尽,白钨矿资源的 利用研究逐渐受到重视。萤石和方解石是白钨矿资源中2种典型的含钙脉石矿物,这2种矿物与白钨矿表面化学性质相近且彼此间存在相互影响,导致浮选法分离效果不佳[1]。前期研究表明[2],苯甲羟肟酸—铅离子配合物捕收剂(Pb-BHA)是白钨矿的有效捕收剂。Pb-BHA配合物捕收剂以金属基为作用位点,可以选择性地与白钨矿和方解石表面的氧原子化学结合,所以Pb-BHA对白钨矿和方解石均具有较高的捕收能力,而对萤石没有捕收能力[3],从而有利于后端钨矿伴生萤石资源的回收。另一方面,根据溶解平衡,当方解石和萤石共存于实际矿浆中时,萤石和方解石之间存在表面转化[4],较高的F-浓度推动溶解平衡向CaF2的形成端移动,F-倾向于吸附在方解石表面,形成CaF2膜,直接阻碍Pb-BHA在方解石表面的吸附[5]。因此,在Pb-BHA体系下萤石可以被看作方解石的天然抑制剂,这在以往的研究中已得到了证实[6]。目前Pb-BHA配合物捕收剂已应用于中国许多大型矿山,如行洛坑钨矿有限公司、黄沙坪矿业有限公司和柿竹园有色金属有限责任公司等。
然而,由于近年来对高品位钨矿资源的开发,许多矿山出现了矿石贫化的现象,原矿中方解石含量增加,而萤石含量降低[7]。此时仅仅依靠F-的表面转化无法实现方解石的有效抑制,单一的Pb-BHA药剂体系将难以获得合格的钨精矿,最终导致精矿中方解石含量过高,影响后续的钨冶炼过程[8]。据报道,无机抑制剂水玻璃(Na2SiO3)可用于白钨矿与方解石的分离,价格便宜且易于获得,但选择性较差[9-10]。当前的研究多利用硫酸和多种金属离子对水玻璃进行改性以提高其选择性,但其在一定程度上仍对白钨矿有抑制作用[11];同时,大量水玻璃的存在导致水回用问题严重,环境问题突出。近年来,有机抑制剂逐渐成为研究的热点,一些有机抑制剂(如单宁、木质素磺酸钙、海藻酸钠、羧甲基纤维素和果胶等)被用于白钨矿或萤石浮选过程中方解石的抑制剂[12]。然而,由于上述有机抑制剂存在成本高、溶解性差、难以生物降解等问题,难以大规模工业应用[13]。
聚天冬氨酸(PASP)被认为是一种生态友好的抑制剂,具有无毒、水溶性好、生物可降解性强等优势,且其最终的降解产物为氨、二氧化碳和水,对环境无害[14]。PASP分子结构中含有多个羧基,这些羧基在溶液中易与钙离子发生相互作用,使其用于含钙矿物的浮选成为可能[15]。基于此,本研究以PASP为抑制剂、Pb-BHA为捕收剂进行白钨矿和方解石浮选试验,通过纯矿物浮选试验、Zeta电位测定、XPS分析和晶体化学计算探究了Pb-BHA体系下白钨矿和方解的浮选行为及PASP选择性抑制机理。
1 试验材料及方法
1.1 试验样品及药剂
试验用白钨矿和方解石均来自湖南省郴州市,经化学成分分析及计算得到2种矿物的纯度分别为98%和97%,结合XRD分析结果(图1)可知,矿样纯度较高,杂质矿物含量低,可用于纯矿物浮选试验。将白钨矿及方解石纯矿物破碎磨矿后,筛选38~74 μm粒级样进行浮选试验。

图1 白钨矿及方解石的XRD图谱Fig.1 XRD patterns of scheelite and calcite
试验用苯甲羟肟酸、硝酸铅以及PASP均为化学纯,购自国药集团有限公司;试验过程中采用盐酸和氢氧化钠调节溶液pH值;试验用水为去离子水,电阻率大于18 MΩ/cm。
1.2 浮选试验
纯矿物浮选试验在40 mL的XFGC型浮选机上进行,叶轮转速为1 800 r/min,浮选流程如图2所示。

图2 纯矿物浮选试验流程Fig.2 Flowsheet of pure mineral flotation test
称取2.0 g纯矿物,依次加入PASP、Pb-BHA配合物、pH调整剂及松醇油,药剂作用时间及浮选时间均为3 min。其中,Pb-BHA的添加方式为:将BHA与硝酸铅混合反应20 s,制备Pb-BHA配合物后加入矿浆。浮选结束后,分别收集泡沫产品和槽内产品,烘干后称重,计算回收率。
1.3 Zeta电位测定
采用Zeta Plus电位仪进行Zeta电位测定,测试样品粒度为-2μm。首先,将0.02 g待测样品与40 mL氯化钾溶液(浓度为1.0×10-2mol/L)混合。然后依次加入PASP、Pb-BHA配合物、pH调整剂,药剂与样品的作用时间与浮选试验一致。搅拌作用结束后,沉淀10 min,抽取上清液进行Zeta电位测定。
1.4 XPS分析
将0.50 g、粒度为-2μm的待测样品加入到装有40mL PASP的溶液中,搅拌15 min。然后,过滤悬浮液,将处理后的样品用去离子水洗涤3次,并在35℃下真空干燥。使用Thermo Fisher Scientific K-Alpha 1063 X系统进行测试分析。
2 试验结果与分析
2.1 纯矿物浮选试验
2.1.1 Pb-BHA体系下白钨矿和方解石的可浮性
在 BHA、Pb2+用量均为 2×10-4mol/L的条件下,考察白钨矿和方解石在不同pH值条件下的可浮性,结果见图3。

图3 Pb-BHA体系不同pH值条件下白钨矿和方解石的可浮性Fig.3 Flotability of scheelite and calcite in Pb-BHA system at different pH value
由图3可知:提高溶液碱度,白钨矿和方解石的回收率先升高后降低,pH=8~10时,二者回收率达到70%以上。经计算,Pb-BHA体系下白钨矿和方解石回收率的最大差值小于20%,这说明需要引入抑制剂才能实现白钨矿和方解石的有效分离。
2.1.2 Pb-BHA体系下PASP用量对白钨矿和方解石可浮性的影响
在 BHA、Pb2+用量均为 2×10-4mol/L,pH=9的条件下,考察PASP用量对白钨矿和方解石回收率的影响,结果见图4。
由图4可知:随着PASP用量的增加,方解石及白钨矿的回收率均逐渐下降,方解石的下降幅度远大于白钨矿。当PASP用量由0增大至3 mg/L时,方解石的回收率大幅降低至40%以下,而白钨矿的回收率仍在85%以上,表明PASP对方解石和白钨矿的抑制作用具有较高的选择性。当PASP用量为2 mg/L时,方解石和白钨矿的回收率差值最大,因此确定适宜的PASP用量为2 mg/L。

图4 Pb-BHA体系下PASP用量对白钨矿和方解石可浮性的影响Fig.4 Influence of PASP dosage on flotability of scheelite and calcite in Pb-BHA system
2.1.3 Pb-BHA体系下pH值对PASP抑制效果的影响
在 BHA、Pb2+用量均为2×10-4mol/L,PASP用量为2 mg/L的条件下,考察pH值对白钨矿和方解石回收率的影响,结果见图5。
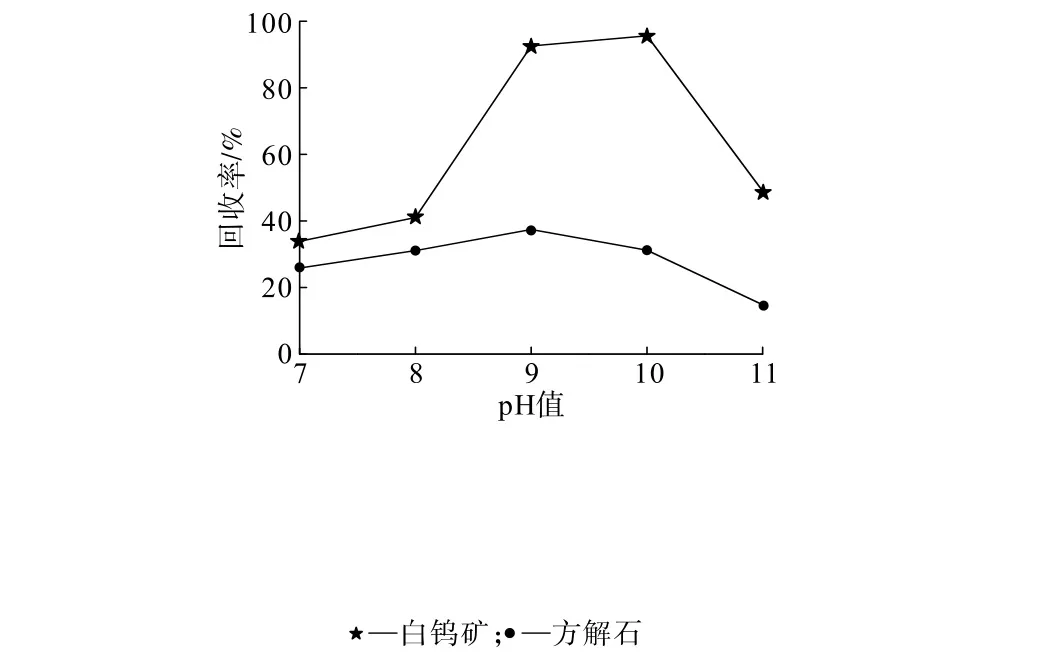
图5 Pb-BHA体系下pH值对PASP抑制效果的影响Fig.5 Influence of pH value on inhibition effect of PASP in Pb-BHA system
由图5可知:提高溶液碱度,白钨矿的回收率先增大后降低,pH=9~10时白钨矿的回收率均较高;试验pH值范围内方解石的回收率均小于40%。当pH=10时,白钨矿和方解石的回收率分别为93.34%、23.14%,二者回收率的差值达70%左右,有望在此条件下实现白钨矿和方解石的浮选分离。
2.2 人工混合矿试验
在 BHA、Pb2+用量均为 2×10-4mol/L、pH=10 的条件下,考察不添加和添加PASP(2 mg/L)2种条件下人工混合矿中方解石占比对白钨矿精矿指标的影响,结果见图6。
由图6可知:无论是否添加PASP,随着方解石占比的增大,精矿CaWO4品位和回收率均呈下降趋势,说明人工混合矿中方解石含量的增加直接影响白钨矿的分离提纯。

图6 人工混合矿中方解石占比对白钨矿精矿指标的影响Fig.6 Influence of calcite proportion in artificial mixed ore on scheelite cencentrate indexes
添加2mg/L的PASP,在方解石占比相同的条件下,精矿品位均显著提升,精矿回收率则影响不大。当白钨矿与方解石的质量比为1∶1时,添加2 mg/L的PASP后精矿中CaWO4的回收率和品位分别达到95.2%和85.0%,这进一步验证了PASP对方解石的高选择性抑制作用。
2.3 作用机理分析
2.3.1 PASP的溶液化学分析
将PASP建模为含有4个天冬氨酸基的分子,记为H4L[16-17],PASP分子的质子化反应和平衡常数可由下式给出:
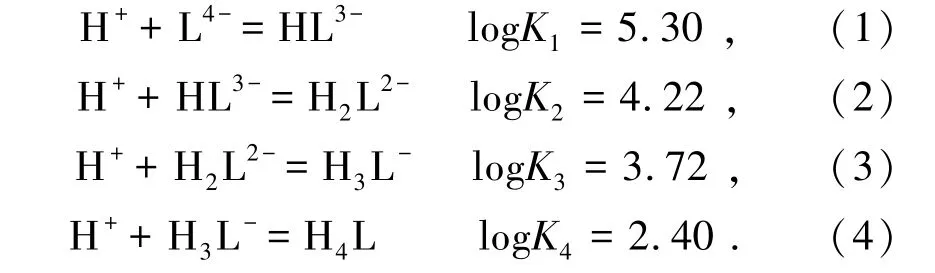
根据式(1)~(4)计算并绘制PASP的组分分布图(cPASP=2 mg/L),结果如图7所示。
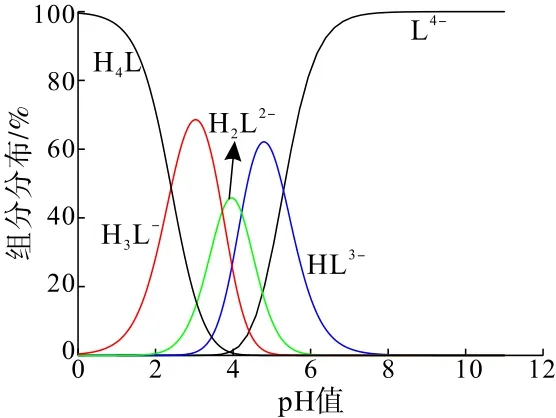
图7 PASP在不同pH值下的组分分布(c PASP=2 mg/L)Fig.7 Component distribution of PASP with different pH value (c PASP=2mg/L)
由图7可知:随着pH值的增加,PASP分子逐渐电离,当pH>7时,L4-成为PASP溶液中的优势组分。白钨矿和方解石分离的最佳浮选pH范围为8.5~10.5,因此,PASP以L4-的形式与矿物发生反应。
2.3.2 Zeta电位分析
PASP添加前后白钨矿与方解石的Zeta电位变化情况如图8所示。

图8 PASP添加前后白钨矿与方解石的Zeta电位变化(c PASP=2 mg/L)Fig.8 Zeta potential changes of scheelite and calcite before and after PASP addition(c PASP=2mg/L)
由图8(a)可知:试验pH值范围内,白钨矿和PASP药剂的Zeta电位均为负值,且随着pH值的升高,负值的绝对值呈增大趋势;添加PASP后,白钨矿表面电荷变化不大,表明PASP对白钨矿表面电荷的影响不大。
由图8(b)可知:方解石零电点为10.5左右,pH<10.5时方解石带正电,pH>10.5时方解石带负电;添加PASP后,方解石Zeta电位发生了显著负移,表明带负电荷的PASP强烈吸附在方解石表面。
添加PASP前后2种矿物表面Zeta电位变化的差异性,表明PASP在方解石表面发生强烈的吸附作用而在白钨矿表面的吸附非常弱,从而导致了PASP对方解石的选择性抑制作用,这与浮选试验结果一致。
2.3.3 XPS分析
表1为PASP处理前后白钨矿表面C、O、W、Ca和方解石表面C、O、Ca的原子浓度。
由表1可知:PASP处理后,白钨矿表面Ca 2p、W 4f、O 1s和C 1s的原子浓度无明显变化,说明PASP在白钨矿表面吸附非常微弱;而方解石表面的Ca 2p和O 1s的原子浓度显著下降,说明PASP吸附在其表面,极大地改变了方解石表面的化学环境。
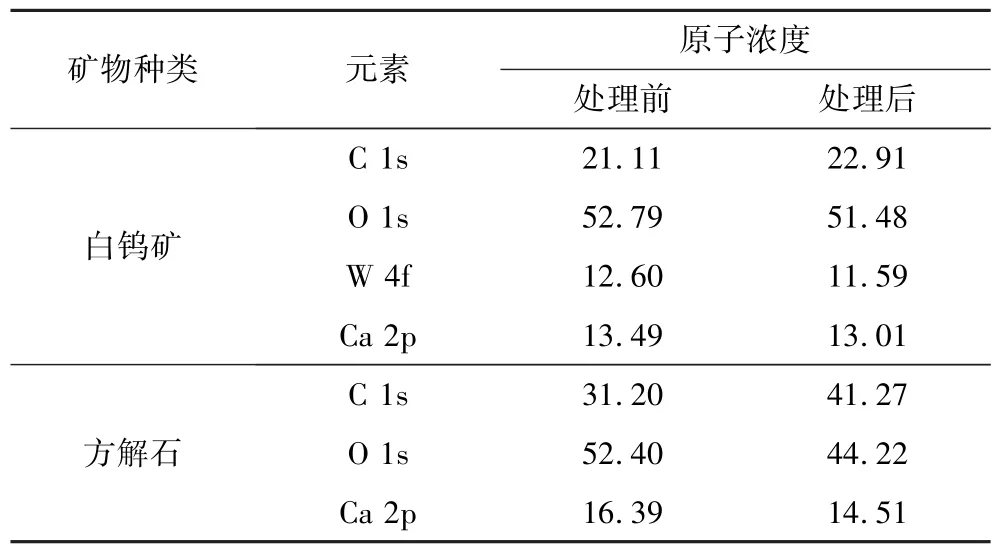
表1 PASP处理前后白钨矿和方解石表面元素的原子浓度Table 1 Atomic concentrations of scheelite and calcite surface elements before and after PASP treatment%
图9、图10分别为PASP处理前后白钨矿、方解石的O 1s和Ca 2p1、Ca 2p3能谱图。

图9 PASP处理前后白钨矿的XPS分析结果(c PASP=2 mg/L)Fig.9 XPS analysis results of scheelite before and after PASP treatment(c PASP=2mg/L)

图10 PASP处理前后方解石的XPS分析结果(c PASP=2 m g/L)Fig.10 XPS analysis results of calcite before and after PASP treatment(c PASP=2 mg/L)
530.37和531.17 eV处的峰分别对应W—O和Ca—O基团的O 1s谱峰[18]。由图9可知:与PASP作用后,O 1s峰分别偏移至530.39和531.14 eV,变化幅度分别为0.02和0.03 eV,均在仪器的测试误差范围内。白钨矿Ca 2p1和Ca 2p3的结合能分别为350.56 eV和347.04 eV,与PASP作用后无明显变化。上述结合能的变化均可以忽略不计,表明PASP对白钨矿表面化学环境的影响很小,无化学吸附。
531.52和532.56 eV处的峰分别对应C—O和Ca—O基团的O 1s峰[19]。由图10可知:与PASP作用后,O 1s (C—O)的结合能降低至531.37 eV,这与PASP结构中的大量羧基氧有关[20];同时,与PASP作用后,O 1s(Ca—O)在整个O 1s谱峰中所占的面积比出现明显增长,这可能与PASP结构中的羧基和Ca2+的相互作用有关,说明PASP在方解石表面发生了剧烈吸附。此外,方解石与PASP作用前后的Ca 2p能谱图中,Ca 2p3和Ca 2p1的结合能分别为347.15和350.69 eV;与PASP作用后,Ca 2p3和Ca 2p1的新峰分别出现在348.05和351.46 eV,均向高结合能位置发生了偏移,这对应于聚天冬氨酸根与钙离子的结合[21]。上述分析说明,PASP可以通过羧基氧原子与方解石表面的Ca质点相互作用,发生化学吸附,从而选择性地抑制方解石。
2.3.4 晶体化学分析
采用Material Studio软件中的DMol3模块进行晶体、解理面及浮选药剂的结构优化及量化性质计算。PASP在矿物表面的选择性吸附行为取决于PASP的分子结构和矿物的表面结构[22-24]。图11为化学稳定的聚天冬氨酸盐基团的分子示意,图12为白钨矿常见解理面{101}、{112}及方解石常见解理面{104}。

图11 化学稳定的聚天冬氨酸盐基团的分子示意Fig.11 Molecular schematic diagram of the chemically stable polyaspartic acid salt group

图12 白钨矿的常见解理面{101}、{112}及方解石常见解理面{104}Fig.12 The normal cleavage plane of scheelite{101},{112}and calcite{104}
对白钨矿的常见解理面{101}、{112}及方解石常见解理面{104}的钙原子分布情况进行统计计算,结果见表2。
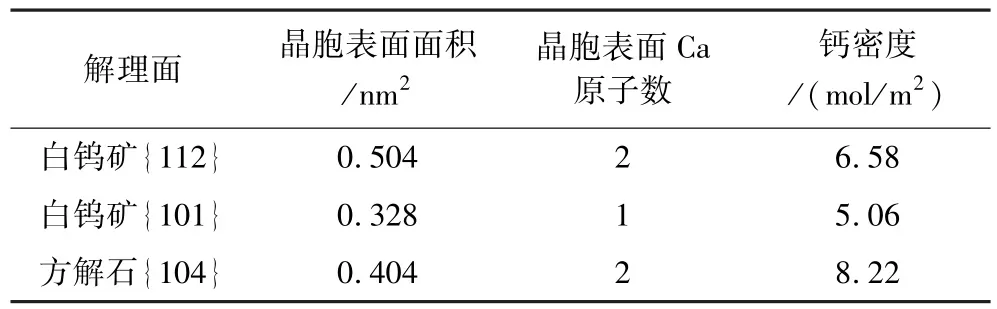
表2 白钨矿和方解石常见解理面钙原子的分布Table 2 Distribution of calcium atoms on the normal cleavage surfaces of scheelite and calcite
由表2可知:方解石解理面的钙原子数量和密度均高于白钨矿解理面,表明相较于白钨矿表面,方解石表面暴露了更多的钙原子,这为PASP的吸附提供了更多的活性钙位点。
由图11及图12可知:PASP离子中羧基的2个氧原子之间的距离为0.261 5 nm,白钨矿{101}和{112}解理面上相邻Ca原子的距离为0.386 7 nm,而方解石{104}面上相邻 Ca原子的距离分别为0.498 8 nm和0.440 7 nm,这表明白钨矿和方解石表面相邻的2个Ca原子之间的距离远比PASP离子中2个羧基氧原子之间的距离长。这意味着PASP离子中的2个氧原子与2种矿物表面Ca原子的结合方式可能是双齿配位而不是桥连配位[25-27]。
在PASP的聚合物结构中存在多个羧基,羧基可以与矿物表面的钙质点相互作用和结合,同时白钨矿和方解石矿物表面钙吸附位点的距离不同。因此PASP的选择性可能与PASP活性位点与官能团的匹配程度有关。由图11可知,PASP离子聚合物结构中相邻2个羧基中氧原子之间的距离分别为0.427 8~0.439 9 nm和0.509 8~0.518 8 nm。对比白钨矿和方解石表面的钙间距(图12),PASP聚合物结构中2个相邻羧基氧原子之间的距离,与方解石表面的钙间距更接近,说明PASP的羧基与方解石表面的Ca—Ca质点具有更高的匹配度,表明PASP官能团与方解石表面活性钙原子的匹配度更高。因此,PASP在方解石表面的吸附更强,与PASP作用前后方解石的Zeta电位和光电子结合能的位移也就更大。
3 结 论
(1)纯矿物浮选和混合矿物浮选结果表明,在pH=10.0的条件下,2 mg/L的PASP可以有效分离白钨矿和方解石,表明了PASP对方解石的选择性高效抑制作用。
(2)Zeta电位和XPS分析结果表明,PASP的添加对方解石的表面电性及表面化学环境影响较大,对白钨矿的影响较小,说明PASP在方解石表面吸附较强,但在白钨矿表面吸附非常弱。
(3)原子间距匹配程度在PASP的高选择性抑制中起了关键作用:PASP结构中多个羧基氧的间距,与方解石表面的钙质点间距的匹配度,明显优于白钨矿,因此PASP在方解石表面的吸附更强。
(4)以PASP为抑制剂,Pb-BHA为捕收剂,形成了一种高选择性的新药剂体系,在上述药剂体系下,PASP在方解石表面发生强烈吸附,捕收剂无法吸附导致方解石被抑制;而白钨矿表面PASP吸附较少,不影响捕收剂Pb-BHA在其表面的吸附,从而上浮。PASP对方解石的高选择性抑制作用为有效分离白钨矿和方解石提供了一种解决方案。

