胁迫驯化及常压室温等离子体复合诱变选育丁醇高产菌株
刘孟荧,罗壹艳,黄小倩,周智友,李 志,李汉广
(江西农业大学生物科学与工程学院/江西农业大学应用微生物研究所/江西农业微生物资源开发与利用工程实验室/江西省菌物资源保护与利用重点实验室,江西南昌 330045)
【研究意义】以可再生资源生产能源物质是解决当前化石燃料储量逐年减少及环境恶化的重要手段之一。丁醇作为继乙醇之后的又一新型生物燃料,因其高燃烧值、低腐蚀性、燃烧特性与汽油相似等优势,使其在生物燃料领域的发展潜力已远超乙醇[1-2],因此加强对丁醇发酵的研究具有重要的现实意义。【前人研究进展】生物丁醇距今已有上百年历史。在20 世纪80 年代以前,丁醇发酵是仅次于乙醇发酵的第二大发酵工业。然而随着石油产业的快速崛起,利用化学合成法生产丁醇在价格上占据了优势,从而逐步取代了发酵法。近年来随着各国对环境保护意识的不断加强,开发环境友好型能源成为未来经济发展的必然趋势,因此发酵法生产丁醇再次成为生物质能源领域的研究热点。传统丁醇发酵常采用梭状芽孢杆菌作为生产菌株,其中,以丙酮丁醇梭菌(Clostridium acetobutylicum)和拜氏梭菌(Clostridium beijerinckii)最为常见[3-5]。然而发酵产物(丁醇)对生产菌株具有较强的生物学毒性,常常导致其发酵结束后出现低产物浓度及低产率现象,因此提高生产菌株的发酵性能是增强其产业化的重要途径之一。近年来,利用人工育种、组学技术等方法对生产菌株进行改良已成为获得优良菌株的常用方法,如Matsusako 等[5]以异丁醇作为选择压力对Synechocystissp.PCC6803 进行定向驯化,获得的突变菌株对各醇类均具有较强的抗逆性,其发酵性能与原始菌株相比也有很大提高。【本研究切入点】目前,丁醇生产菌株的发酵产物主要为乙醇、丙酮、丁醇,其质量比约为1:3:6。其中,副产物的高占比严重降低了底物转化效率,同时增加了后期分离成本。另一方面,丁醇生产菌株虽具有较广泛的底物利用能力,如可利用已糖、戊糖及多糖进行溶剂生产,但在混糖发酵过程中,由于葡萄糖阻遏效应,仍存在戊糖代谢能力不足等问题,从而导致原料利用率降低,甚至影响丁醇发酵的进程;而且木糖作为纤维水解液中第二大可发酵单糖,若能减少葡萄糖阻遏效应,增强菌株对木糖的利用能力,对于木质纤维素丁醇发酵过程具有重要意义[6-7]。因此筛选出可同步利用混糖发酵的高丁醇占比生产菌株对于丁醇发酵的工业化应用具有重要意义。【拟解决的关键问题】为选育出可同步利用混糖发酵的高丁醇占比生产菌株,本文采用实验室自行设计的“三明治”筛选方法对收集的样品进行初步筛选,以获取高丁醇占比菌株,然后对其中发酵性能最好的菌株进行胁迫驯化及常压室温等离子体(atmospheric and room temperature plasma,ARTP)复合诱变,同时对原始菌株及突变菌株的发酵性能进行初步研究,以期为其工业化应用提供一些有益的理论指导。
1 材料与方法
1.1 样品采集
本试验土样采自南昌江红酿造厂及其附近土壤,牛粪样品采自南昌市屠宰厂,每份样品约10 g,采集完成后将样品置于无菌密封袋内封存,标记采样时间、地点等信息,于4 ℃冰箱保存,并尽快进行筛选分离。
1.2 培养基
富集培养基[8]:取新鲜土豆,将其切成大小为0.2 cm3左右的土豆块茎,于4 ℃条件下储藏备用。
分离纯化培养基:葡萄糖40 g,可溶性淀粉40 g,胰蛋白胨6 g,酵母浸粉2 g,乙酸铵3 g,磷酸氢二钾0.5 g,磷酸二氢钾0.5 g,七水合硫酸亚铁0.01 g,结晶硫酸镁0.2 g,琼脂20 g,蒸馏水1 000 mL,pH 自然,121 ℃灭菌20 min。
筛选培养基:在分离纯化培养基基础上添加8~10 g/L丁醇及0.02 g/L刃天青。
发酵培养基:碳源(葡萄糖、木糖或混糖)60 g,胰蛋白胨6 g,酵母浸粉2 g,乙酸铵3 g,磷酸氢二钾0.5 g,七水合硫酸亚铁0.01 g,一水合硫酸锰0.01 g,结晶硫酸镁0.2 g,琼脂20 g,蒸馏水1 000 mL,pH 6.0,121 ℃灭菌20 min。
1.3 筛选方法
1.3.1 富集培养 利用实验室自行设计的“三明治”筛选方法进行富集培养[8],具体试验步骤如下:称取2~3 g样品,以一层样品一层土豆块茎的方式,将其放置于厌氧瓶中(装样高度约为厌氧瓶的2/3)。然后加入20 mL 10 g/L异丁醇,浸没样品及土豆块茎。装瓶完成后,将厌氧瓶置于100 ℃沸水浴中热激120 s,以杀死部分营养细胞,待其冷却后,于37 ℃培养箱中厌氧培养2~3 d。
1.3.2 菌株的分离纯化 由于丁醇生产菌株在发酵过程中会生产大量H2和CO2,因此在富集培养过程中若有丁醇产生菌出现定会大量产气并出现醪盖现象。根据这一特点,将大量产气并出现醪盖现象的厌氧瓶挑出,吸取1 mL样液以10倍稀释法进行平板涂布,37 ℃厌氧培养40~48 h。
1.3.3 丁醇生产菌的可视化筛选 由于丁醇高产菌株一般具有较高的丁醇耐受性及较强的氧化还原力[9]。因此,向分离纯化培养基中加入一定量的丁醇及刃天青,可根据菌落及褪色圈大小,筛选出具有高丁醇耐受性及强氧化还原力的发酵菌株。
1.4 丁醇胁迫驯化
丁醇胁迫驯化试验采用刘小波等[10]所建立的方法,其具体步骤如下:取0.5 mL 对数生长期的细胞置于25 mL厌氧管中,加入4.5 mL不同浓度丁醇溶液作为胁迫因子,摇匀密封后,置于37 ℃培养箱中,浸泡处理。利用分光光度计测定浸泡液吸光值(OD600),待其OD600达到1.0后,取浸泡样液稀释涂布于筛选平板。选取菌落及退色圈较大的单菌落进行ABE 发酵,连续进行传代,在每一次传代过程中,取溶剂产量前3名的菌株,进行下一轮次驯化;在驯化过程中,每次试验都应设置上一浓度梯度作为驯化试验的对照组,当驯化至某一浓度菌体出现生长半停滞或不生长时,返回上一浓度进行重新驯化,若三轮次该浓度驯化均无明显差异,则停止驯化。
1.5 ARTP诱变处理
1.5.1 菌悬液制备 取对数期发酵液8 000 r/min离心15 min,离心完成后弃去上清液,用50 mmol/L PBS缓冲液将细胞浓度稀释至106~107CFU/mL,于4 ℃条件下储藏备用[11]。
1.5.2 ARTP 诱变 取10µL 菌悬液进行诱变处理,工作电压120 v,照射距离2 mm,气体流量15 L/min,诱变时间设置为40、80、120、160、200、240 s,诱变完成后用少量无菌水将菌株洗脱至EP 管中,稀释涂布于筛选平板,选取菌落及褪色圈较大的单菌落进行发酵培养,同时计算致死率及突变率。其中,将丁醇产量高于原始菌株5%以上的突变菌株定义为正突变菌株,丁醇产量低于原始菌株5%以上的定义为负突变菌株[12],两者的计算公式如下:


1.6 测定方法
1.6.1 还原糖含量测定 采用双波长Douglas比色法测定还原糖含量[13],测定波长550 nm,参比波长425 nm。
1.6.2 溶剂(乙醇、丙酮、丁醇)含量测定 取1 mL 发酵液于10 000 r/min 条件离心10 min,上清液与1.21 g/L 异丁醇(异丁醇作为内标)按1:4 比例混匀,用于气相检测。色谱柱条件如下:PEG20M 毛细管柱(30 m×0.32 mm×0.4µm),进样温度:240 ℃,检测器温度:240 ℃,柱温:90 ℃,以氮气作载气,进样量1µL[8]。
2 结果与讨论
2.1 菌株的筛选
利用实验室自行设计的“三明治”筛选方法,从28份土样中共获得5株丁醇生产菌株,为进一步探究筛选所得菌株对单糖及混糖的利用情况,分别以葡萄糖、木糖及混糖(木糖∶葡萄糖=1∶2)作为发酵原料,各菌株发酵的最终结果如表1所示。

表1 筛选菌株不同碳源条件下的丁醇及总溶剂产量Tab.1 The production of butanol and total solvent from different carbon sources by screening strains
由表1 可知,在以葡萄糖为底物进行发酵时,菌株A3 丁醇及总溶剂产量最高,可达到7.93 g/L 和11.47 g/L,丁醇占比为69.2%,但其对木糖利用能力较差,发酵同等浓度木糖仅产生3.62 g/L丁醇;相比之下,菌株L8 对木糖利用能力与葡萄糖基本相当,发酵同等浓度木糖可产生7.13 g/L 丁醇和8.35 g/L 总溶剂,同时在混糖条件下丁醇及总溶剂产量波动较小,丁醇占比较大,可达到总溶剂量的85%以上。
在丁醇发酵的三种主要产物中,以丁醇目前的市场价格最高,约为12 000 元/t,乙醇和丙酮的市场价格约为85 000 元/t和5 000 元/t[14]。由于传统丁醇发酵过程中副产物占比高达到40%,使得底物转化效率严重降低,从而增加了生产成本。因此,获取具有高丁醇占比的溶剂生产菌株,对于提高生物丁醇经济竞争力具有重要意义。与其它筛选菌株相比,菌株L8 发酵性能更优,因此将其作为目的菌株进行后续试验。
2.2 分子生物学鉴定
随着分子生物学技术的发展,微生物分类及鉴定由表观层面深入至基因层面,人们开始在基因水平上研究微生物种群的亲缘关系[15]。在众多检测基因中,16S rDNA存在于所有细菌染色体中,并具有高度的保守性及高变性,利用其可变区序列的差异可对不同种属细菌进行分类鉴定。因此,对未知细菌进行16S rDNA测序已成为细菌鉴定的一个重要依据[16-17]。
为进一步了解菌株L8 的种属特性,将其送至南昌市科畅生物科技有限公司进行16S rDNA 测序,测序完成后将结果与GENEBANK 数据库中的BLAST 软件进行相似性比对,发现菌株L8 与Clostridium bei⁃jerinckiiCP23-KKU相似性达到99%,下载相似性较高序列,利用Mega5.1软件构建系统发育树,其结果如图1所示。结合菌株L8发酵及生理生化特性,最终确定菌株L8为拜氏梭菌(Clostridium beijerinckii)。

图1 基于菌株L8 16S rDNA序列同源性构建的进化树Fig.1 Phylogenetic tree constructed based on 16S rDNA sequence homology of strain L8
2.3 菌株L8对混糖为底物的发酵利用情况
当前可用于丁醇发酵生产的廉价底物主要有木质纤维[6-7]、粗甘油[18]、海洋藻类[19-20]等。其中,木质纤维作为自然界中分布最广,含量最为丰富的可再生资源之一,其水解产物主要由己糖、戊糖及二糖等混合糖组成。尽管不同纤维水解液中糖组分及含量各不相同,但葡萄糖和木糖仍是木质纤维水解液中主要碳源[21-23]。为探究菌株L8 利用不同木质纤维水解液进行丁醇发酵的可行性,本试验利用含不同浓度葡萄糖及木糖的混糖发酵液来模拟水解液中碳源组成,将木糖与葡萄糖的比例分别设置为1∶1、1∶2、1∶3、2∶1、3∶1,观察菌株L8对其利用情况,结果如表2所示。

表2 菌株L8在不同混糖条件下的溶剂产量Tab.2 Solvent production from different mixed sugar by strain L8
由表2 可知,在初始糖浓度不变的条件下,混糖发酵中单糖比例的改变对发酵产物并无明显影响。通过残糖中木糖与葡萄浓度可看出,不同于Raganati 等[24]报道中所提出的只有当葡萄糖浓度降至15 g/L以下时,菌体才能实现对木糖的利用,菌株L8在木糖与葡萄糖比例高达1∶3时,木糖利用亦未受阻,发酵结束后基本无木糖残留。
在混糖发酵过程中,由于葡萄糖阻遏效应的存在,溶剂生产菌株往往无法同时利用葡萄糖和木糖进行发酵生产,发酵结束后木糖的大量残留会造成了严重的底物浪费。而通过观察菌株L8 对不同比例混糖的利用情况可发现,菌株L8 对不同混糖比的适应性较高,即使在葡萄糖浓度高于木糖浓度的发酵液中,也能实现对木糖的有效利用。由于木糖与葡萄糖比为1∶2 时,发酵结束后残糖浓度最低,丁醇及总溶剂产量最高,可达到7.87 g/L 和9.23 g/L。因此,最终确定以木糖与葡萄糖比为1∶2 的混糖比进行后续试验。
2.4 丁醇胁迫驯化
在众多育种技术中,适应性实验室进化(adaptive laboratory evolution,ALE)是为数不多的无需大型仪器设备参与的育种技术之一,其主要通过给予适当选择压力,利用菌株自发突变,来达到育种目的,相对其他育种技术而言,具有操作简便、定向性强等优势[25]。由于丁醇发酵过程中,其主要产物丁醇对细胞的毒性最大,当丁醇浓度达到20 g/L 时细胞即停止生长[26]。因此,为提高菌株L8的丁醇耐受性及溶剂产量,采用逐级提高丁醇浸泡浓度的驯化方法来处理菌株,初始浸泡浓度设为10 g/L,按5 g/L 的梯度逐级增加至30 g/L,其每轮次驯化后的丁醇及总溶剂产量见表3。
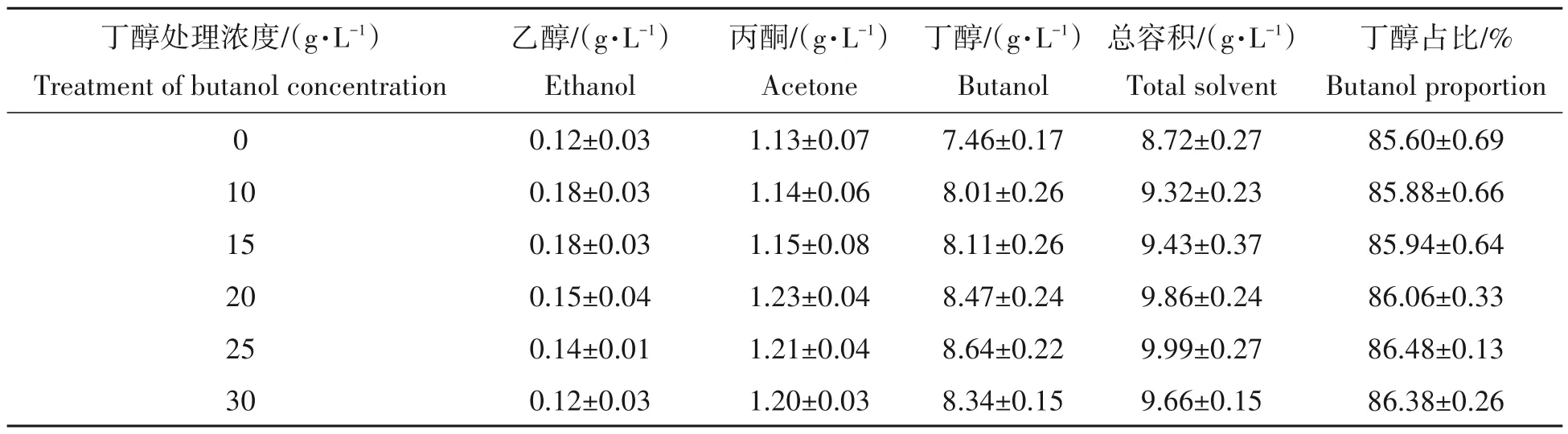
表3 不同浓度丁醇驯化处理后的溶剂产量比较Tab.3 Comparision of solvent production with different butanol concentration immersion
由表3 可知,逐级提高丁醇浸泡浓度在一定程度上可提高菌株溶剂产量。当丁醇浸泡浓度达到25 g/L 时,驯化菌株X8-4 丁醇及总溶剂产量最高,可达到8.64 g/L 和9.99 g/L,较原始菌株分别提高了15.8%及14.6%;而当丁醇浸泡浓度提高至30 g/L 时,驯化菌株溶剂产量并无明显变化,其可能原因是丁醇胁迫驯化虽可模拟生物进化进程,但其对菌株突变频率的干预较为有限。通过本次试验最终确定将菌株X8-4作进一步研究之用。
2.5 ARTP诱变
2.5.1 诱变时间的确定 与传统物理诱变技术相比,ARTP诱变技术可直接对细胞悬液进行处理,有效避免了诱变过程中因抽真空造成的细胞损伤;同时,由于可引起DNA的多种修复机制,产生丰富的位点错配,致使ARTP诱变具有更高的突变率[27-28]。本节试验为确定最佳诱变时间,以丁醇驯化后的菌株X8-4作为出发菌株进行ARTP诱变处理,辐照时间分别为40、80、120、160、200、240 s,其具体诱变结果如图2所示。

图2 不同处理时间下菌株致死率及突变率Fig.2 Mutation rate and lethality by atmospheric and room temperature plasma

图3 ARTP诱变高产菌株丁醇及总溶剂产量Fig.3 The production of butanol and total solvent by mutant strains
由图2可知,菌株致死率与处理时间存在一定的剂量效应关系,致死率随处理时间的增加而增加。当处理时间为160 s和200 s时,致死率分别为92.3%和96.5%,当处理时间达到240 s时,致死率达到100%;另一方面,当处理时间在40~160 s时,菌株正突变率随诱变时间的增加而增加,当处理时间在120~160 s时,菌株正突变率高于负突变率,当诱变时间为160 s时,正突变率最高,达到5.3%。而随着处理时间的继续增加,菌株正突变率开始下降。综合考虑菌株致死率及突变率等因素,最终确定最佳诱变时间为160 s。
2.4.2 诱变菌株的选育 将诱变处理后的菌悬液稀释涂布于筛选平板中,此平板中已加入不同浓度丁醇及刃天青(常作为厌氧培养中的氧化还原指示剂),因此,在此平板上长出菌株的菌落越大说明其丁醇耐受能力越高,同时若褪色圈越大,说明其还原力越强,这样的菌株一般具有较强的丁醇生产能力,为此,选取菌落及褪色圈较大的单菌落进行发酵试验,发酵结束后其丁醇及总溶剂产量如图3所示。
由图3 可知,经诱变处理后,共出现33 个褪色圈较大的单菌落,将它们分别挑出接入发酵培养中进行发酵试验。结果表明大部分突变菌株的溶剂产量高于出发菌株。其中,菌株Y10 丁醇及总溶剂产量最高,可达到10.51 g/L 和12.16 g/L,较出发菌株分别提高了21.6%和21.7%,较原始菌株分别提高了40.9%和39.4%。因此,选取突变菌株Y10作为进一步研究菌株。
2.4.3 突变菌株遗传稳定性实验 良好的遗传稳定性是所有发酵菌株应具备的基本条件之一。为验证突变菌株Y10遗传稳定性,对其进行10次传代培养,其每代溶剂产量见表4。

表4 诱变菌株遗传稳定性试验Tab.4 Inheritance stability of mutant strain Y10
由表4可知,经10次传代培养后,第10代菌株丁醇及总溶剂产量分别为10.26 g/L和11.81 g/L,较第一代仅分别下降了2.5%和2.9%;同时,在10次传代培养过程中,丁醇及总溶剂的平均产量分别为10.36 g/L和11.96 g/L,与第一代相比仅分别下降了1.6%和1.6%。虽然在10 次传代培养过程中,菌株丁醇及总溶剂产量略有下降,但总体而言菌株发酵性能并无明显变化。因此,从试验所得结果可知菌株Y10遗传稳定性能良好。
2.6 原始菌株L8与突变菌株Y10发酵性能比较
2.6.1 糖利用速率 为进一步研究原始菌株L8 与突变菌株Y10 对不同碳源的利用情况,将其分别接种于葡萄糖、木糖及混糖发酵培养基中,研究发酵过程中碳源的消耗动力学情况,其结果如图4所示。

图4 原始菌株L8与突变菌株Y10糖利用情况Fig.4 Utilization of different sugarsbyoriginal strain L8 and mutant strain Y10
由图4可知,三种碳源条件下突变菌株糖利用速率均高于原始菌株。在以单糖为底物发酵时,突变菌株Y10 对葡萄糖和木糖的利用速率分别为0.60 g/(L·h)和0.58 g/(L·h),较原始菌株分别提高了28.2%和31.8%。同时,葡萄糖利用速率略高于木糖,该结果与Ezeji等[30]实验结果基本一致;而在以混糖为底物发酵时,其试验结果与Ounine等[31]所提出的只有当葡萄糖基本耗尽后菌株方可启动对木糖的利用这一结论不一致,具体情况是原始菌株L8和突变菌株Y10对木糖的利用均未受葡萄糖影响,木糖与葡萄糖可在发酵过程中被同步利用。其中,混糖条件下突变菌株Y10对木糖利用速率为0.26 g/(L·h),葡萄糖利用速率为0.35 g/(L·h),总糖利用速率为0.61 g/(L·h),其混糖发酵的糖利用速率与单糖发酵基本一致。
2.6.2 溶剂产量 溶剂产量是反应菌株发酵性能最直观的指标之一,将原始菌株L8 与突变菌株Y10 分别接种于葡萄糖、木糖及混糖发酵培养基中,每隔6 h取样测定其溶剂产量,结果如图5所示。

图5 原始菌株L8与突变菌株Y10在不同碳源条件下的溶剂产量Fig.5 Solvent production by original strain L8 and mutant strain Y10 under different carbon sources
由图5 可知,突变菌株Y10 利用混糖为底物进行发酵时,其丁醇及总溶剂产量可达到10.35 g/L 和11.92 g/L,较原始菌株分别提高了38.6%和33.5%;且不论是原始菌株L8 还是突变菌株Y10 其混糖发酵的溶剂产量均略高于单糖发酵的溶剂产量,该现象在工程大肠杆菌生产D-葡萄糖二酸中也存在[32],且张杰等[33]在对拜氏梭菌S3进行发酵研究时发现,其混糖发酵的溶剂产量也略高于葡萄糖发酵的溶剂产量;另一方面,混糖发酵过程中,突变菌株Y10的丁醇得率及生产强度可达到0.23 g/g和0.14 g/(L·h),较原始菌株分别提高了10.8%和40%,该试验结果进一步证明适应性实验室进化及ARTP诱变是一种提高菌种发酵性能的有效手段,因此,本试验结果可为通过该方法获得更多优良生产菌株提供有益参考。
3 结论
本试验采用自行设计的“三明治”筛选方法,从28份样品中共筛选出5株丁醇生产菌株。其中,菌株L8 在单糖及混糖发酵过程中,溶剂产量波动较小且丁醇占比较大,为进一步确定菌株种属特性,对其进行了16S rDNA 分子鉴定,最终确定为拜氏梭菌(Clostridium beijerinckii)。然后采用丁醇胁迫驯化及ARTP 诱变技术对菌株L8 进行复合诱变处理,并结合理性筛选模型获得了高产突变菌株Y10,经遗传稳定性试验表明突变菌株溶剂产量较为稳定。在混糖发酵过程中,突变菌株Y10 丁醇得率及生产强度可达到0.23 g/g和0.14 g/(L·h),与原始菌株相比分别提高了10.8%和40%。本试验所获得的丁醇生产菌株丰富了丁酵发酵的菌种普系,所采用的复合诱变方法及理性筛选模型可为其它试验或工业生产中快速获得优良生产菌株提供有益的参考。
木糖作为纤维水解液中第二大可发酵单糖,若能减少葡萄糖阻遏效应,增强菌株对木糖的利用能力,对于丁醇发酵过程中木质纤维素的利用具有重要意义。Jiang 等[34]在研究Clostridium acetobutylicumATCC824对混糖的利用情况时发现,外源调控发酵过程中pH 值可使菌株对木糖的利用率由11.5%提高至31.5%。与之相比,突变菌株Y10 在无外源调控pH 值的条件下,仍能稳定利用木糖进行发酵生产,同时对混糖发酵的适应性较高,能实现葡萄糖和木糖的同步利用,且菌株具有较好的遗传稳定性,说明突变菌株Y10在利用木质纤维生产丁醇方面具有较大的发展潜力。

