混合设计新序列在药物可互换性中的探究
凌佳 刘圣洁 言方荣

[摘要] 目的 提出一种混合设计新序列(TTRR、RRTT、RTTR、TRRT)来探究其在药物可互换性方面的适用情况。方法 基于Chow等提出的药物可交换标准(SCDI)为评价标准,考虑药物个体间变异,探索新序列在药物可互换性中的适用情况,并和常用序列(TRTR、RTRT)进行比较。 结果 通过计算机对不同情境的模拟,发现新序列大体上呈现一致趋势并且在药物可互换关键部分σWR、σD等变动时,本研究提出的新序列表现出比常用序列更加敏感的特点。 结论 虽然新序列比常用序列在药物可互换中对于变异变动时更加敏感,但多出的两个序贯使得其在样本量方面表现欠佳。
[关键词] 序列;药物可互换性;药物可交换标准;平均生物等效性
[中图分类号] R969 [文献标识码] A [文章编号] 1673-7210(2020)09(c)-0008-05
Exploration of a new hybrid design sequence in drug interchangeability
LING Jia1 LIU Shengjie2 YAN Fangrong2▲
1.College of Education, Jiangsu Open University, Jiangsu Province, Nanjing 210019, China; 2.College of Science, China Pharmaceutical University, Jiangsu Province, Nanjing 210009, China
[Abstract] Objective To propose a new hybrid design sequence (TTRR, RRTT, RTTR, TRRT) to explore its application in drug interchangeability. Methods Based on criterion for drug interchangeability (SCDI) scaled by Chow, etc. as evaluation criteria, the application of the new sequence in drug interchangeability was explored by considering the variation among drug individuals, and was compared with the common sequence (TRTR, RTRT). Results Through computer simulation of different situations, it was found that the new sequence presented a consistent trend. In addition, the new sequence presented in this study was more sensitive than the common sequence when the key parts σWR, σD of drug interchangeability were changed. Conclusion Although the new sequences are more sensitive to variation than the common sequence in drug interchangeability, the additional two sequences make it less effective in sample size.
[Key words] Sequence; Drug interchangeability; Scaled criterion for drug interchangeability; Average bioequivalence
随着越来越多的仿制药在市场上可用,人们开始关心当互换使用这些药物时是否具有相同的性能和安全性。为了解决这个问题,人们开始考虑将变异的特性,如服药后受试者间的变异,受试者自身的变异以及药物和个体的交互作用等考虑进等效性的评价中来[1-7]。美国食品和药物管理局(FDA)也在原先平均生物等效性(ABE)的基础上发布了一些关于群体生物等效(PBE)和个体生物等效(IBE)的统计方法和指南文件[8]。其中PBE、IBE与ABE的不同之处就在于它们不仅包含了平均的特性,还将变异的特性考虑进去[7]。而药物变异的估算又与实际操作时设计的受试者服药序列有一定的联系,如ABE评价时常用的2×2交叉序列(TR、RT,其中T为试验药,R为参比制剂),每个受试者依次服用两种药品,此时就无法计算每个受试者对于同种药品的个体内变异,此序列在药物可互换性评价中就显得有所欠缺。
本文旨在尝试用一种混合设计新序列来探究其在药物可互换性方面的适用情况,并且从σWR、σD(药物可互換的重要影响因素)等方面和常用的重复交叉设计序列TRTR、RTRT进行比较。本研究首先提出具体的统计模型、序列设计和评价标准,然后进行模拟比较,最后对结果进行分析讨论。
1 资料与方法
1.1 统计模型
考虑下述统计模型[3]:
Yijk=μ+Fl+Pj+Qk+Wljk+δikl+εijk。
式中,Y表示受试者i在第j个周期,第k个序列的效应值;μ表示总体均值;Pj表示周期j的固定效应;Qk表示序列k的固定效应;Fl表示药物l的固定效应1.2 序列设计
由于多数药物个体间变异系数远远大于个体内变异系数,使用交叉设计可以有效规避个体间变异给试验带来的偏倚,因此在大多数等效性检验中,一般均采用TR、RT交叉设计的方法[8-9]。但在某些情况下,尤其是对高变异、长半衰期药物,它们的个体内变异往往比个体间变异大,此时平行设计就显得优于交叉设计。当评价涉及一些需要估算受试药品和参照药品测量指标个体内方差以及药物和个体相互作用的方差分量时,重复交叉设计又显得至关重要,如常见的TRT、RTR序列和TRTR、RTRT序列。實际应用中常采用TRTR、RTRT序列,但在计算时可能会存在偏差。因为此序列在计算同种药品变异时不可避免的经过了另一种药品的洗脱,但通常为了计算方便,都假定有充足的洗脱期,不存在药品的延滞效应。
近年来,为了更加直接准确的的估算出同种药品的个体内变异,在药物的可互换性方面人们开始尝试提出一些平行和交叉组合的混合设计序列(TT、RR、TR、RT),如Chow等[10]。但该设计中有两组序贯内的受试者两次服用的都是同种药物(如序贯1内的受试者两次服用的都是T药,序贯2内的受试者两次服用的都是R药),在计算两药效应差值时就会少了两个序贯的受试者。综上,结合各种序列的优点,本研究考虑将一种类似于平行和交叉混合的序列TTRR、RRTT、RTTR、TRRT[10]应用在药物可互换的等效性评价上,探究其可适用性。
1.3 评价标准
在统计学上,药物可互换性的概念可以被视为平均生物利用度和生物利用度的变异性是高度相似或几乎相同的,即其中δ都很小。在实际中,δ通常为25%,然而,在监管指导或文献中关于δ的信息很少。为了解决药物互换性问题,文献中曾提出了几个标准:①Chen(2000)等[11]提出了用个体和药物交互作用引起的变异性估计σ作为衡量指标;②FDA(2001)[2]提出用于评估药物可替换性的IBE标准;③Chow(2015)等[12]制定了一个综合了PBE、IBE,类似于SABE标度的平均生物等效性(SABE),符合药物可互换性标准(SCDI);④Chen(2017)等[13]提出在评价时候颠倒T和R位置的平均生物等效性(RABE)。
虽然模拟结果显示与ABE比较,RABE是一个更严格的标准,但其还是基于平均生物利用度的平均生物等效评价,未考虑制剂的变异性。虽然其比较简单,但用于考虑药物的可互换性并不适合。2000年时Endrenyi等[14]指出,在用σ指标作为药物可互换评价标准时,σ的估计值为有偏估计,因为该估计值反映的并非是真实的药物间相互作用,而是含有了参比制剂的个体内变异σ。故只单独考虑交互作用的σ评价标准存在很大缺陷。Chen等[13]在文献中对SCDI评价标准和其他评价标准进行模拟比较时发现,在一些关键参数发生变动时SCDI评价标准较为敏感。综合来看,SCDI标准在药物可互换性评价方面性能较优,故本文选用Chow等[12]在2015年提出的SCDI标准作为评价准则。此外,还有更多相关文献可参见[15-19]。
2 结果
2.1 参数设置
将序列TRTR、RTRT简称为序列Q1,序列TTRR、RRTT、RTTR、TRRT简称为序列Q2。为评估序列Q2在药物可互换性中的适用情况,将其和常用序列Q1进行比对。模拟分析时,参数设置情境和Chen等[13]文献中的保持一致,参数设置如下:N=40,σ=σ=0.2,μ=5,μ=5、5.25、5.5[即几何平均数(GMR)=1、1.05、1.1]σ=0、0.15、0.3,σ=0.1、0.2、0.3,周期和序列固定效应为0.001,每个场景模拟1000次。
2.2 模拟结果
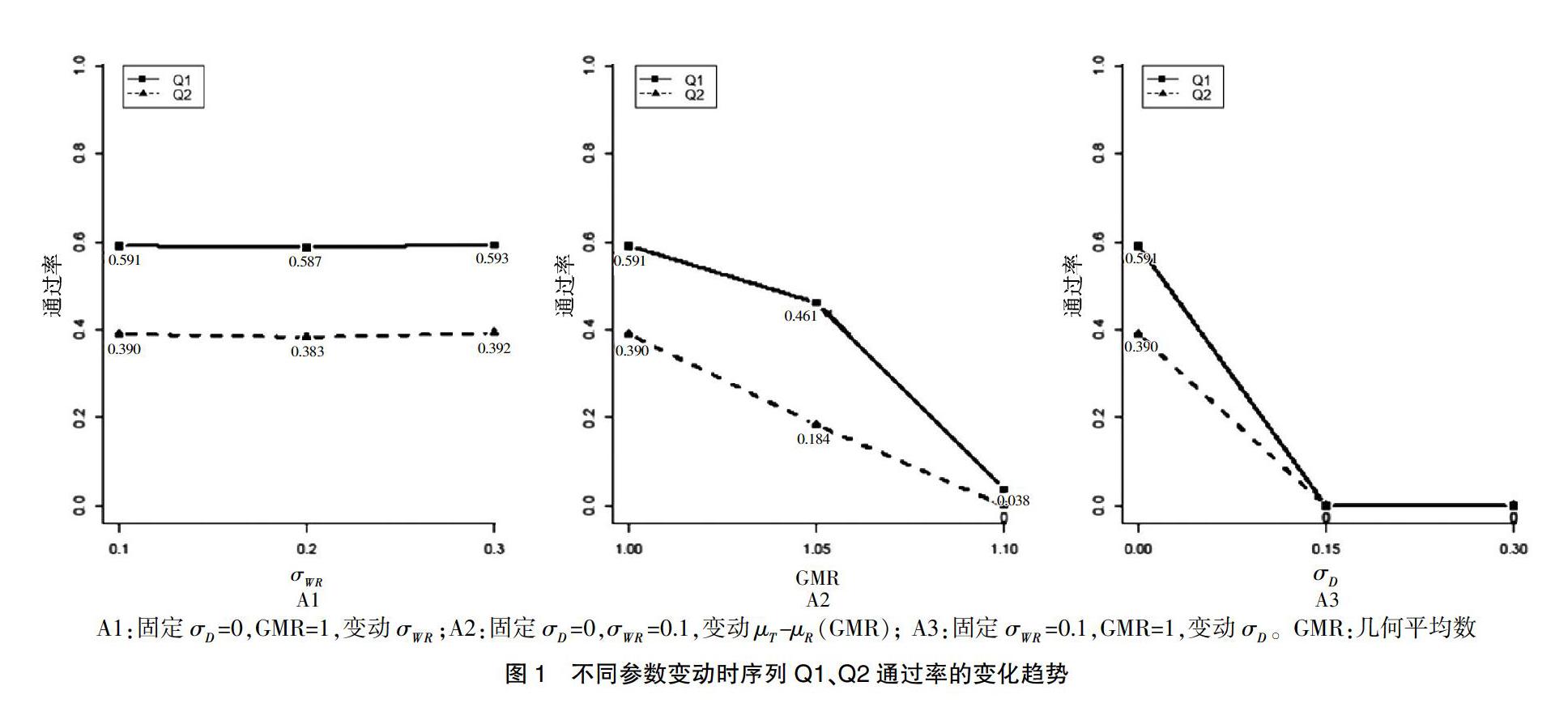
2.2.1 情形一:低水平的药物变异性、交互作用以及两制剂差值μ-μ 从图1-A1中可以看出:当设GMR=1,σ=0,σ从0.1变动到0.3时,序列Q1和序列Q2的通过率基本维持稳定,说明两种序列趋势上大体保持一致。但是序列Q2的通过率明显小于序列Q1,可能是由于序列Q2的序贯数目多,但是总人数却和序列Q1保持一致。图1-A2、A3中,当其中两个参数设定在较低水平另一个参数变动时,序列Q1和序列Q2的趋势保持一致,通过率都呈现降低的趋势。图1-A3中,当σ从0变动到0.15时,通过率直接降为0,而在图1-A2中,当GMR发生变动时,通过率有个缓冲下降,说明序列Q2对σ比对GMR更敏感。
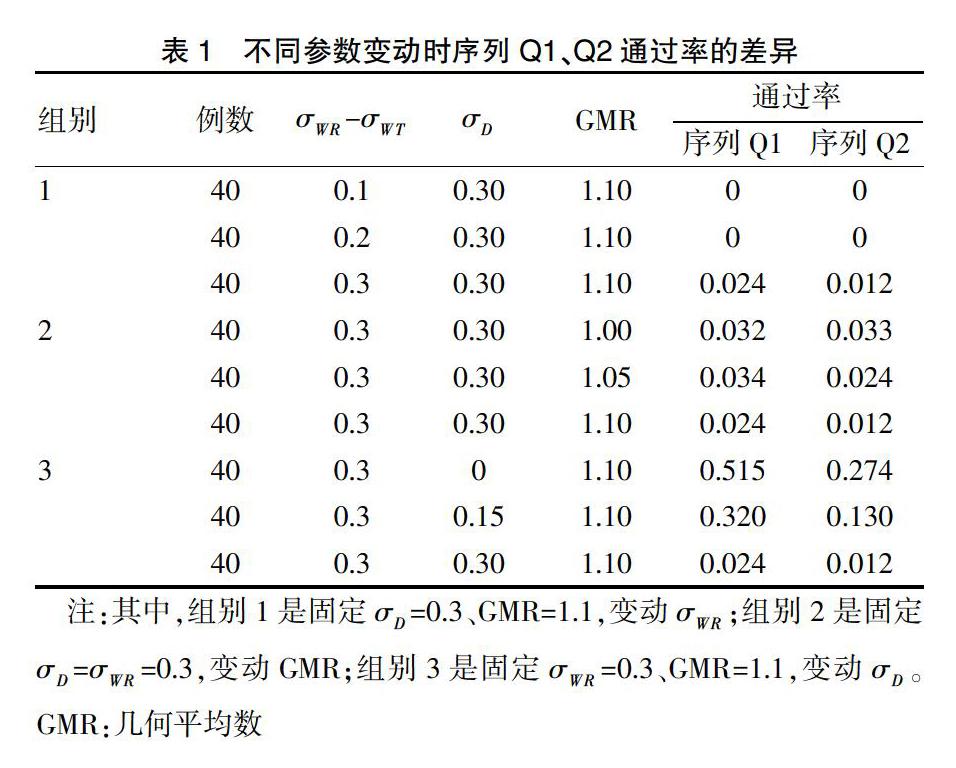
2.2.2 情形二:高水平的药物变异性、交互作用以及两制剂差值 对于组别1,当设定σ=0.3,GMR=1.1时,药物和个体间的交互作用较大且GMR偏离1,此时两个药物之间基本是不可互换的,从表1中可以看出来,σ从0.1变动到0.2时,通过率都是0(特殊的是在σ达到0.3时序列Q1和序列Q2的通过率都有从0的轻微递增)。对于组别2,当σ和σ均固定在0.3时,增大GMR,从整体上看,序列Q1和序列Q2的通过率都在降低。当GMR从1.00变动到1.05时候,序列Q1的通过率基本不变,但序列Q2的通过率却降低了27.27%[(0.024-0.033)/0.033=-27.27%],再从1.05变动到1.10时,通过率降低了1/2左右,可见序列Q2比Q1对GMR的变化更敏感。由上图1-A2也可以看出,固定σ,σ时,GMR从1.00变动到1.05,序列Q1下降幅度为(0.591-0.461)/0.591=22%,序列Q2下降幅度为(0.390-0.184)/0.390=52.82%,Q2的下降幅度大于Q1。对于组别3,当设定σ=0.3,GMR=1.10时,变动σ,序列Q1和序列Q2的通过率都在降低,但序列Q2的变化差异较明显。通过计算变化率可以更清晰地看出差异,如:在σ从0变动到0.15时,序列Q1为37.9%[(0.320-0.515)/0.515=-37.9%],序列Q2为52.6%[(0.130-0.274)/0.274=-52.6%],序列Q2的降低速度明显高于序列Q1,说明序列Q2对于σ的变化更加敏感。
表1 不同参数变动时序列Q1、Q2通过率的差异
注:其中,组别1是固定σ=0.3、GMR=1.1,变动σ;组别2是固定σ=σ=0.3,变动GMR;组别3是固定σ=0.3、GMR=1.1,变动σ。GMR:几何平均数
2.2.3 情形三:样本量 设定GMR=1,个体内,个体间变异为0.2(σ=σ=0.2σ=σ=0.2),从图2中可以看出,随着样本量增加,序列Q1和序列Q2的通过率都会增加,但也可以看出,序列Q2的增长较Q1更缓慢,其原因一方面是由于序列Q2中每个序贯内受试者数目小于序列Q1,另一方面是受试者的增加也会一定程度导致药物个体间变异增加,使得通过率降低。
3 讨论
本文探究了一个混合设计新序列在药物可互换性方面的适用情况,并且从σ、σ、GMR等方面和常用的重复交叉设计序列TRTR、RTRT进行比较。通过模拟可以看出将该混合新序列应用在药物可互换性评价中主要有以下特点:①在高水平的药物变异性、交互作用以及两制剂差值时(即σ、σ、GMR均较大,两种药物基本不可互换时)[20-22],序列Q2比序列Q1对于药物可互换性评价中的变异部分显得更加敏感和苛刻,通过率比序列Q1低,说明通常在使用常用序列计算变异时,由于经过另一种药品的洗脱,为方便假定的充足洗脱期不存在药物残留效应,或者不存在个体和药物交互作用等直接估算变异可能都会有不合理的地方;②在低水平的药物变异性、交互作用以及两制剂差值时(即σ、σ、GMR均较小的情况,我们期望两种药物可互换),序列Q2和序列Q1的变化趋势一致,但序列Q2的通过率都比序列Q1低,可能是由于序列Q2由4个序贯组成,而序列Q1只有两个序贯,序列Q2中每个序贯的受试者数目相当于比序列Q1少了一半,也显示出序列Q2的不足之处,就是序贯数目较多,在实际中可能需要更多的受试者才能提升检验的把握度。③无论是序列Q1还是序列Q2,增加样本量都能够提升检验的把握度[23-24]。但是新序列也存在一些不足之处,比如每个受试者需要连续服用4次药物,和常用2×2序列比较服药次数多、试验周期长等;整个序列由4个序贯组成,和常用2×2完全重复交叉序列两个序贯比较,可能需要更多受试者等。本研究所用的混合设计新序列在药物可互换性方面尚处于探索阶段,如何运用到评价生物等效性的药物可互换性方面的临床试验中,并符合实际要求还需要进一步研究。
[参考文献]
[1] 朱赛楠,马林茂.生物利用度—生物等效性评价方法概述[J].中国临床药理学杂志,2003,19(5):388-392.
[2] 张天一.仿制药一致性评价工作全面展开[N].中国医药报,2016-05-30(001).
[3] 凌佳,盛海林.基于統计模型的平均生物等效性检验[J].统计与决策,2013,13(2):8-11.
[4] 刘华.3×3设计中个体生物等效性评价的广义P-值法[J].阜阳师范学院学报,2005,22(4):20-23.
[5] 张孔生,葛莉.基于自助法和随机加权法的个体生物等效性评价[J].阜阳师范学院学报,2008,25(2):7-11.
[6] 李玲玲,都丽萍,张钰宣,等.仿制药与原研药间可互换性探讨[J].中国药学杂志,2015,50(2):178-181.
[7] 谢松梅,高晨燕,白玉,等.生物类似药临床相似性比较试验设计和评价的思考[J].中国药学杂志,2015,50(6):490-493.
[8] FDA. Guidance for Industry,Statistical Approaches to Establishing Bioequivalence [D]. U.S.Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research(CDER),2001.
[9] Chow SC,Shao J,Wang H. Individual bioequivalence testing under 2x3 designs [J]. Stat Med,2002,21(5): 629-648.
[10] Chow SC,Liu J. Design and Analysis of Bioavailability and Bioequivalence Studies,Third Edition [M]. New York: CRC Press,2008:1-10.
[11] Chen M,Patnaik R,Hauck WW,et al. An individual bioequivalence criterion:Regulatory considerations [J]. Stat Med,2000,19(20):2821-2842.
[12] Chow SC,Xu HL,Endrenyi L,Song F Y. A new scaled criterion for drug interchangeability [J]. Chinese J Pharm Anal,2015,35(5):844-848.
[13] Chen M,Chow SC. Assessing bioequivalence and drug interchangeability [J]. J Biopharma Stat,2017,27(2): 272-281.
[14] Endrenyi L,Taback N,Tothfalusi L. Properties of the estimated variance component for subject-by-formulation interaction in studies of individual bioequivalence [J]. Stat Med,2000,19(20):2867-2878.
[15] Benet L. Bioavailability and bioequivalence:definitions and difficulties in acceptance criteria. In:Midha KK,Blume HH,editors. Bio-International 2:bioavailability,bioequivalence and pharmacokinetics [C]. Stuttgart:Medpharm,1993:27-35.
[16] European Medicines Agency [EMEA] Committee for Medicinal Products for Human Use [CHMP]. Note for guidance on the investigation of bioavailability and bioequivalence [R]. London:EMEA,2001:1-22.
[17] Boddy AW,Snikeris FC,Kringle RO,et al. An approach for widening the bioequivalence acceptance limits in the case of highly variable drugs [J]. Pharm Res,1995,12(12):1865-1868.
[18] 何春遠,孙华,谢海棠.高变异药物生物等效性试验及量化评价[J].中国临床药理学与治疗学,2016,21(7):721-730.
[19] 李自强,黄宇虹,王保和,等.FDA,EMA和CFDA关于高变异性药物生物等效性研究指南比较[J].中国新药杂志,2017,26(1):7-13.
[20] 言方荣,朱惠红,蒋丽芸,等.生物等效性评价早期停止条件研究[J].中国卫生统计,2017,34(5),825-828, 831.
[21] 刘月,蔡晶晶,于宣宣,等.高变异药物生物等效性分析方法的比较[J].中国临床药理学与治疗学,2019,24(7), 792-798.
[22] 赵杨,于浩,娄冬华,等.交叉设计多中心临床试验的混合效应模型[J].中国临床药理学与治疗学,2005,10(1):116-120.
[23] Tothfalusi L,Endrenyi L. An exact procedure for the evaluation of reference-scaled average bioequivalence [J]. AAPS J,2016,18(2):476-489.
[24] Karalis V,Macheras P. An insight into the properties of a two-stage design in bioequivalence studies [J]. Pharm Res,2013,30(7):1824-1835.
(收稿日期:2020-04-01)

