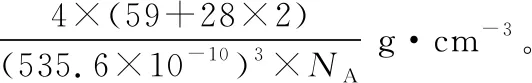优秀原创试题选登
本刊编辑部整理
【作者单位 姓名】湖北省武汉市华中科技大学附属中学 陈功健
【例1】下列有关说法正确的是
( )
A.在空气质量检测中的PM2.5,属于气溶胶
B.麒麟990 5G芯片的发布,二氧化硅功不可没
C.向某溶液中通入HCl气体,产生了白色沉淀,则原溶液中含有Ag+
D.金属钠可保存在石蜡油中,实验后多余的钠可放回原试剂瓶
【答案】D
【命题意图】本题考查化学与STSE,掌握元素化合物知识以及相关物质的性质与用途为解题的关键,侧重分析和应用能力的考查,渗透的核心素养是科学态度与社会责任。
【解析】A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,如果微粒直径介于1~100 nm,即0.01~0.1微米之间,则可形成气溶胶,否则不能,故A错误;
B.制作芯片的材质为晶体硅,不是二氧化硅,故B错误;
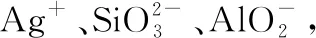
D.钠化学性质比较活泼,易与空气中氧气、水反应,与石蜡油不反应,且密度大于石蜡油,可保存在石蜡油中,为保证安全,实验时多余的钠放回原瓶中,故D正确。
【例2】已知NA是阿伏加德罗常数的值,下列说法正确的是
( )
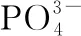
B.标况下,3.36 L HF中含有的质子数为1.5NA
C.1 mol冰的晶体中含有的氢键数目为2NA
D.60 g SiO2晶体中含有的Si—O键数目为2NA
【答案】C
【命题意图】本题考查阿伏加德罗常数的应用,掌握物质的微观结构及盐类水解的应用为解题的关键,渗透的核心素养是宏观辨识与微观探析。
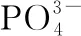
B.标准状况下,HF为液态,3.36 L HF的物质的量不为0.15 mol,其含有的质子数也不为1.5NA,故B错误;
C.1个水分子可形成4个氢键,1个氢键被2个水共用,即1 mol冰的晶体中含有的氢键数目为2NA,故C正确;
D.60 g SiO2物质的量为1 mol,根据二氧化硅的空间立体结构可知,1 mol SiO2中1 mol Si形成2 mol Si—O键,2 mol O形成2 mol Si—O键,合计4 mol,故D错误。

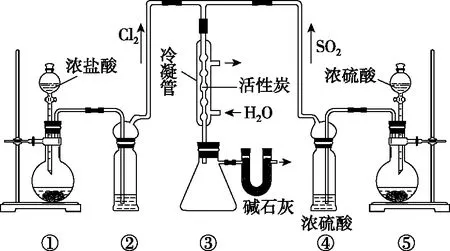
下列说法正确的是
( )
A.冷凝管中的活性炭的主要利用其吸附性
B.装置①中圆底烧瓶中的固体药品可能为KMnO4、KClO3或MnO2
C.依据装置②、④中单位时间内的气泡数可调节Cl2和SO2的流量
D.装置②中盛放饱和食盐水,除去HCl气体,装置③应置于冰水中
【答案】C
【命题意图】本题考查无机物的制备实验,涉及气体的制备、气体的除杂及尾气处理等,把握实验的基本原理为解题的关键,侧重分析与实验能力的考查,渗透的核心素养是证据推理与模型认知。
【解析】A.冷凝管中的活性炭的主要作用为催化剂,故A错误;
B.常温下KMnO4、KClO3可以与浓盐酸反应制备氯气,而MnO2与浓盐酸反应制备氯气需要缓慢加热,故B错误;
C.由化学反应方程式可知,反应中SO2和Cl2的化学计量数之比为1∶1,气体流量可通过观察②、④中单位时间内的气泡数来调节,故C正确;
D.Cl2中有HCl对磺酰氯的制备无影响,为防止SO2Cl2的水解,装置②中应盛放浓硫酸。磺酰氯的沸点为69.1 ℃,为减少磺酰氯的挥发,装置③宜用冰水冷却,故D错误。
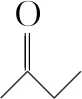
( )
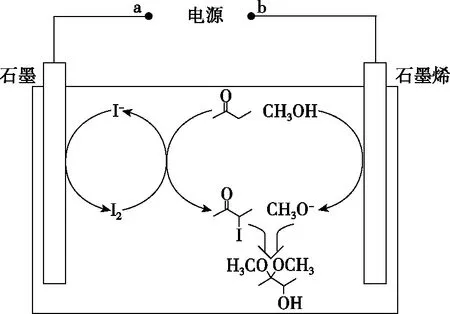
A.石墨上的电势比石墨烯高
C.每生成33.6 L H2,电路中转移的电子数为3NA
D.接通电源后,石墨电极附近溶液会变黄
【答案】C
【命题意图】本题考查电解池的工作原理及应用,涉及电势的判断、化学方程式的书写、电化学相关计算等知识,意在考查学生的知识应用能力和分析能力,渗透的核心素养是证据推理与模型认知。
【解析】A.石墨电极为阳极,石墨烯电极为阴极,则石墨电极上的电势比石墨烯上的高,故A正确;
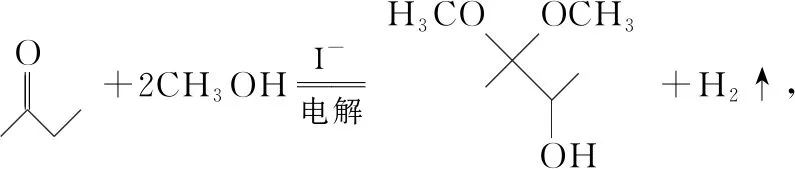
C.状态未知,无法由体积求H2物质的量,故C错误;

【例5】二水合氯化亚锡(SnCl2·2H2O)为白色单斜晶系结晶,熔点247 ℃,沸点623 ℃,易溶于水、乙醇、冰醋酸,极易溶于盐酸,在实验室中被广泛用作还原剂。一种氯化亚锡的制备方法是先用金属锡、氯气和水在盐酸存在下,于60 ℃下进行反应,主要生成氯化锡,然加入金属锡反应生成氯化亚锡。实验装置如下图,回答下列问题。
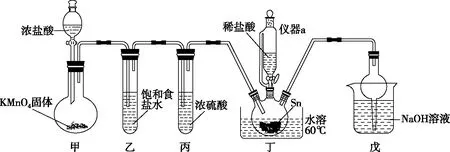
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
Ⅱ.SnCl2易水解生成碱式氯化亚锡Sn(OH)Cl,在水溶液中以SnCl2·2H2O的形式析出。
Ⅲ.SnCl4为无色液体,熔点-33 ℃,沸点114 ℃,遇水强烈水解,可溶于乙醇、四氯化碳等。
(1)锡元素在周期表中的位置是________,仪器a的名称为________。
(2)装置甲中发生的离子方程式为:________________________。
(3)装置丁中滴加稀盐酸的目的是________________________。
(4)指出该实验装置可能存在的缺点________________________。
(5)待装置丁反应完成后,继续添加Sn粉,其作用为:①调节溶液pH;②________。
(6)某小组同学通过下列方法测定所用锡的纯度(杂质不参与反应)
②加入过量的FeCl3;
③用0.100 mol/L KMnO4溶液滴定生成的Fe2+。
则滴定过程中发生反应的离子方程式为____________________________________________,滴定终点的现象是______________________________,取1.5 g锡,经上述各步反应后,平均消耗KMnO4溶液32.00 mL,则锡的质量分数是________。
【命题意图】本题考查了无机物的制备,涉及了化学仪器的识别、实验方案的设计与评价、陌生条件下离子方程式书写、化学计量的综合运算。充分体现了学生对基础知识的掌握和分析问题、解决问题的思维能力,凸显了理科综合考试中的综合性与实用性的特点。渗透的核心素养为科学探究与创新意识。
【答案】(1)第五周期ⅣA族 恒压滴液漏斗
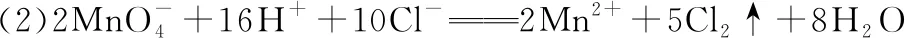
(3)防止Sn2+、Sn4+水解
(4)装置乙、丙属于多余装置
(5)作还原剂,将Sn4+还原成Sn2+
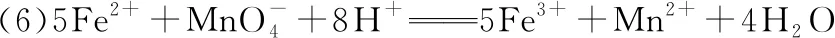
【解析】(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数50,则在周期表中的位置为:第五周期ⅣA族,仪器a的名称为恒压滴液漏斗。

(3)由题干可知Sn2+、Sn4+在水溶液中极易水解,加入稀盐酸可防止Sn2+、Sn4+水解;
(4)从装置丁可知,反应的过程中加入了稀盐酸,故氯气的制备过程中无需进行净化处理;
(5)在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化,加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH。此外,Sn可以将被氧化生成的Sn4+还原成Sn2+;
【作者单位 姓名】江西省南昌市建新区第一中学 谢叶归
【例6】下列说法错误的是
( )
A.第二周期元素,从左到右第一电离能依次增大
B.白磷(P4)易溶于CS2是因为二者均为非极性分子
C.非金属性:C>Si,故酸性:H2CO3>H2SiO3
D.气态氢化物稳定性:HF>HI
【答案】A
【命题意图】本题考查元素周期律及其应用,涉及元素第一电离能大小比较,相似相溶的原理、元素非金属性强弱的比较及应用,意在考查学生的知识应用能力和分析能力。渗透的核心素养为证据推理与模型认知。
【解析】A选项,第二周期元素,从左到右第一电离能呈“增大趋势”,而不是“依次增大”,ⅡA,ⅢA族及ⅤA,ⅥA族有特例,A错误。
B选项,白磷(P4)和CS2二者均为非极性分子,符合“相似相溶原理”,B正确。
C选项,元素的非金属性越强,最高价氧化物对应水化物的酸性越强,C正确。
D选项,元素的非金属性越强,气态氢化物的稳定性越强,D正确。
综上,本题答案为A。
【例7】下列有关“有机物官能团的检验”描述正确的是

( )
【答案】D
【命题意图】本题考查有机官能团的检验,掌握化合物官能团的性质是解题的关键,侧重应用能力的考查,渗透的核心素养是证据推理与模型认知。
【解析】A选项,苯酚的酸性很弱,不能使指示剂显色,A错误。
B选项,淀粉水解液为酸性,而银镜反应需在碱性环境下进行,B错误。
C选项,氯乙烷和氢氧化钾溶液共热后,溶液中氢氧化钾会干扰氯离子的检验,不能检验氯乙烷中的氯原子,C错误。
D选项,新制氢氧化铜与乙酸发生中和反应,蓝色絮状沉淀消失,溶液变为蓝色,是检验羧基的方法,D正确。
综上,本题答案为D。
【例8】工业上以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如下:

下列说法错误的是
( )
B.适当增加硫酸浓度、提高反应温度、减小铁硼矿粉粒径都可以提高浸出效率
C.利用Fe3O4的磁性,可将其从“浸渣”中分离,剩余固体为SiO2
D.“粗硼酸”中的主要杂质是Al2(SO4)4和FeSO4
【答案】CD
【命题意图】本题考查工艺流程,把握流程中发生的反应、混合物的分离提纯、发生的反应为解答的关键,渗透的核心素养为证据推理与模型认知。
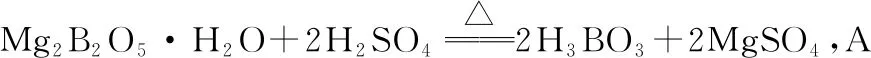
B选项,铁硼矿与硫酸的反应为固液反应,为提高反应速率可通过升高温度、增大溶液浓度、增大固体表面积(粉碎矿石)、搅拌等措施,B正确。
C选项,Fe3O4与硫酸发生反应,浸渣中不含有Fe3O4,C错误。
D选项,从流程图看,铁硼矿中的Fe3O4、Fe2O3、FeO、Al2O3和SiO2等杂质经过前几次操作均已被除去,剩余含MgSO4和硼酸的溶液,会有MgSO4·7H2O晶体混杂在硼酸中,D错误。
综上,本题答案为CD。
【例9】CoSi2合金化合物是一种高性能的热电材料,备受研究人员关注。
(1)基态Co的价电子排布式为________。
(2)SiF4的中心原子杂化类型为________分子空间构型为________。
(3)金刚石、金刚砂(SiC)、单晶硅的熔点由高到低顺序为________。
(4)CoSi2具有萤石结构,其晶胞如下图所示,若晶胞参数a=535.6 pm,则CoSi2的密度为________g·cm-3(不必化简)。
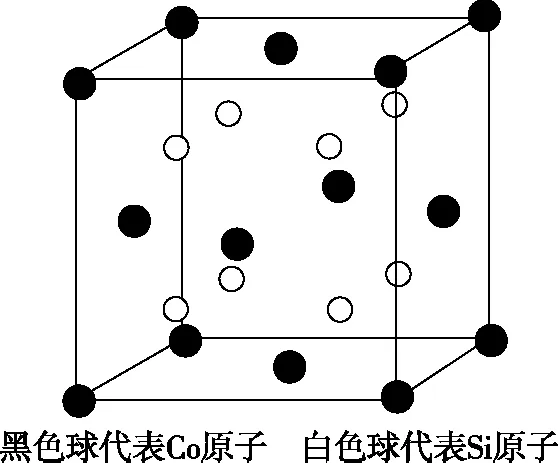
图1 CoSi2合金模型
【答案】(1)3d74s2
(2)sp3杂化 正四面体形
(3)金刚石>金刚砂(SiC)>单晶硅
【命题意图】本题考查物质结构和性质,涉及价电子排布式、杂化轨道理论、空间构型、熔点比较及密度计算等,渗透的核心素养是宏观辨识与微观探析。
【解析】(1)钴的原子序数为27,故基态钴原子的价电子排布式为:3d74s2。
(2)SiF4中心原子价电子对数是4,为sp3杂化,分子空间构型为正四面体形。
(3)金刚石、金刚砂(SiC)、单晶硅均为原子晶体,结构相似,共价键键长越短,键能越大,原子晶体熔点越高,因此,金刚石、金刚砂(SiC)、单晶硅的熔点逐步降低。