MpCYS4基因对苹果褐斑病病原菌侵染的响应表达及其转化株系抗性鉴定
谭延肖 郑现和 石 莹 赵文超 马锋旺 刘长海,*
(1 德州市农业科学研究院,山东 德州 253015;2 西北农林科技大学园艺学院,陕西 杨凌 712100)
半胱氨酸蛋白酶抑制剂(cystatin)是生物体内特异性与半胱氨酸蛋白酶结合,并抑制其活性的一类蛋白[1]。它们通常可以与木瓜蛋白酶等半胱氨酸蛋白酶的活性中心结合,抑制其催化活性,或者与酶的变构部位结合成紧密的复合物,阻止酶原转化成有活性的酶,从而抑制相关蛋白质的降解[2-3]。Cystatin在生物体内广泛存在,在哺乳动物、昆虫和植物中均有报道[4]。Abe 等[5]在1987年首次从水稻种子中克隆到cystatin基因的植物同源物,随后在小麦、马铃薯等80多个物种中成功克隆和鉴定到cystatin基因[6]。
在植物中,cystatin参与调控植株发育、种子萌发、叶片衰老及细胞程序性死亡等生物学过程[7-9]。此外,cystatin也参与植物对干旱、高盐、极端温度等环境胁迫的响应[10-13]。近年来,一些研究也发现,cystatin在植物应对害虫和某些病原菌引起的生物胁迫过程中也发挥了非常重要的作用[14]。Haq 等[15]将原核表达的cystatin蛋白通过体外饲喂有害昆虫,发现其体重明显下降,生长明显受到抑制。同时,通过转基因手段将水稻等的cystatin基因导入甘蔗植物体内,发现转基因植物对线虫、豆象等有害昆虫的侵袭有显著抗性[16-17]。Roby等[18]观察到西瓜感染菜豆炭疽菌(Colletotrichumlagenarium)后,叶片内的tin蛋白含量会上升。将植物cystatin体外纯化蛋白添加到培养植物病原真菌的培养基中,病原真菌的孢子萌发及菌丝体生长均受到明显抑制[19-22]。
苹果(Malusdomestica)是世界上栽植面积最大的果树之一。我国苹果栽植面积和产量均居世界首位,但其往往受到干旱、高盐、极端温度及病虫害等不良外界环境的制约[23-24]。本研究前期在苹果属楸子(M.prunifolia)叶片中克隆到一个cystatin基因MpCYS4(GenBank登录号:KF477275)[25],利用农杆菌介导法将其在苹果矮化砧木M26中进行过量表达后可以提高植株对干旱胁迫的抗性[26]。本研究以MpCYS4过表达株系为试验材料,探索MpCYS4基因在苹果响应褐斑病病原菌侵染过程中的功能,鉴定过表达株系材料的抗病性,同时,对MpCYS4融合蛋白进行体外诱导纯化和抑菌活性分析,以期为进一步揭示苹果MpCYS4基因的生物学功能奠定基础,为苹果抗逆育种提供新的理论依据。
1 材料与方法
1.1 试验材料
本试验以苹果矮化砧木M26野生型(WT)和MpCYS4过表达株系#1、#3、#4为试验材料[26],栽植于陕西省杨凌区西北农林科技大学园艺场温室内(34°20′N,108°24′E)。
供试菌株:子囊菌门苹果盘二孢DiplocarponmaliY. Harada & Sawamura。
1.2 试验方法
1.2.1 苹果褐斑病病菌(Diplocarponmali)分离与接种 苹果褐斑病病菌分离纯化:参考殷丽华[27]的方法,在田间收集有单一典型症状且带有分生孢子盘的苹果褐斑病病叶,将其置于铺有湿润滤纸的培养皿中,25℃黑暗保湿培养2~3 d,待产生白色分生孢子时,于显微镜下根据孢子的形态结构鉴定病原菌[28],接种针挑取,用无菌水配制1×106个·mL-1孢子悬浮液。用接种环接种少量孢子悬浮液于马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA),置于25℃恒温培养箱中培养2~3 d。待病原菌生长为直径约1 cm的菌落后,镜检,并挑取边缘少量菌丝于新的PDA培养基上,进行二次转接培养。如此经过3~4 次转接后,可使菌种得到纯化。每次转接前,需对菌落形态和颜色进行观察,同时镜检,确认为苹果褐斑病菌。
病原菌回接鉴定:在抗性鉴定之前,为确保分离得到的是苹果褐斑病病原菌,采用喷雾法将分离纯化的孢子悬浮液接种于田间采集的苹果健康叶片,10片为一组,重复3次。置于铺有湿润滤纸的培养皿中,25℃保湿培养,观察发病情况。
苹果褐斑病抗性鉴定:田间采集从底部数第9~第12叶位完全展开、生长健康的M26野生型和转基因株系叶片,无菌水冲洗叶表面。将叶柄在无菌水中剪去末端,脱脂棉包裹,叶片晾干后,接种20 μL分生孢子悬浮液,置于铺有湿润滤纸的培养皿中,25℃黑暗保湿培养,10 d后调查发病情况并统计病情指数。根据发病程度制定5级分级标准[27]:0 级:无病害症状;1 级:病斑面积≤10%;2 级:10%<病斑面积≤30%;3 级:30%<病斑面积≤50%;4 级:50%<病斑面积≤75%;5 级:病斑面积>75%。
发病率=发病叶片数/调查总叶片数×100%
(1)
病情指数(disease index,DI)=Σ(病级叶片数×该级代表值)/(调查总叶数×最高发病级代表值)×100%
(2)。
1.2.2MpCYS4基因表达分析 苹果M26野生型叶片在接种病原菌后0、2、4、6、8 d分别取样,于-80℃保存,用于RNA提取,以非接种病毒菌叶片为对照。MpCYS4基因表达水平通过实时荧光定量PCR进行检测[26]。以MpActin为内参基因,每5个处理叶片混合为一个RNA样本,进行3次生物学重复。
1.2.3 MpCYS4融合蛋白纯化及活力测定 MpCYS4融合蛋白诱导及纯化参考Tan等[26]的方法。将构建的pET-32a-MpCYS4表达载体转入大肠杆菌BL21感受态细胞,挑取单菌落接种于含100 mg·L-1氨苄青霉素(Amp)的Luria-Bertani(LB)液体培养基中,37℃、200 r·min-1振荡培养过夜,然后以1∶100重新接种,培养至OD600=0.6~0.8,加异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)至终浓度为0.1 mmol· L-1,16℃下诱导表达12 h。诱导结束后收集菌体,进行聚丙烯酰胺凝胶电泳,观察融合蛋白的表达情况。经Ni-NTA亲和层析法进行蛋白纯化,纯化后蛋白浓度测定使用考马斯亮蓝蛋白测定试剂盒(美国sigma公司)进行。
将200 μL 1 mg·mL-1木瓜蛋白酶溶液、l mL 0.5 mol· L-1磷酸二氢钠溶液加入离心管中,37℃条件下静置3 min;试验组加入1 mL含有0、5、10、20、30 μg·mL-1的MpCYS4重组蛋白溶液,对照组加入相应浓度pET-32a空载体蛋白,37℃下静置4 min,然后分别加入500 μL 1 mg·mL-1苯甲酰基-L-精氨酸-对硝基苯胺(benzoyl-L-arginine-p-nitroanilide)作为底物,37℃条件下反应20 min,用20%乙酸终止反应。用UV-2550分光光度计(日本SHIMHDZU公司)分别测定405 nm处的吸光值,确定半胱氨酸蛋白酶的相对活性[29]。
1.2.4 MpCYS4蛋白体外抑菌活性分析 将苹果褐斑病病菌在PDA固体培养基上活化培养[30],在无菌水中分离纯化孢子,并将其浓度调整为1×106个·mL-1。 将50 μL孢子悬浮液加入10 mL PCDA液体培养基中,分别加入0、10、20、30、40、50 μg·mL-1体外纯化的MpCYS4融合蛋白,25℃振荡培养24 h,以50 μg·mL-1PET-32a空载体蛋白为对照。在492 nm波长处测定吸光度值,分析苹果褐斑病病菌的生长差异[31]。
1.3 数据分析
各试验处理均重复3次,数据统计进行3次生物学重复。采用Microsoft Office Excel 2010和SPSS 11.0软件进行数据处理,使用Sigma Plot软件作图,并应用独立样本的t检验对变量进行显著性差异分析。
2 结果与分析
2.1 MpCYS4基因对苹果褐斑病病原菌侵染诱导的响应
在不同时间点对接种褐斑病病原菌的M26叶片进行取样,提取总RNA,采用实时荧光定量PCR检测MpCYS4的表达水平。由图1可知,接种病原菌2 d后,MpCYS4基因表达水平迅速上升到最高值,4~8 d后其表达水平持续下降。以喷布无菌蒸馏水为对照,在检测过程中MpCYS4基因表达水平无明显变化,表明MpCYS4的表达明显受到苹果褐斑病病原菌的诱导。
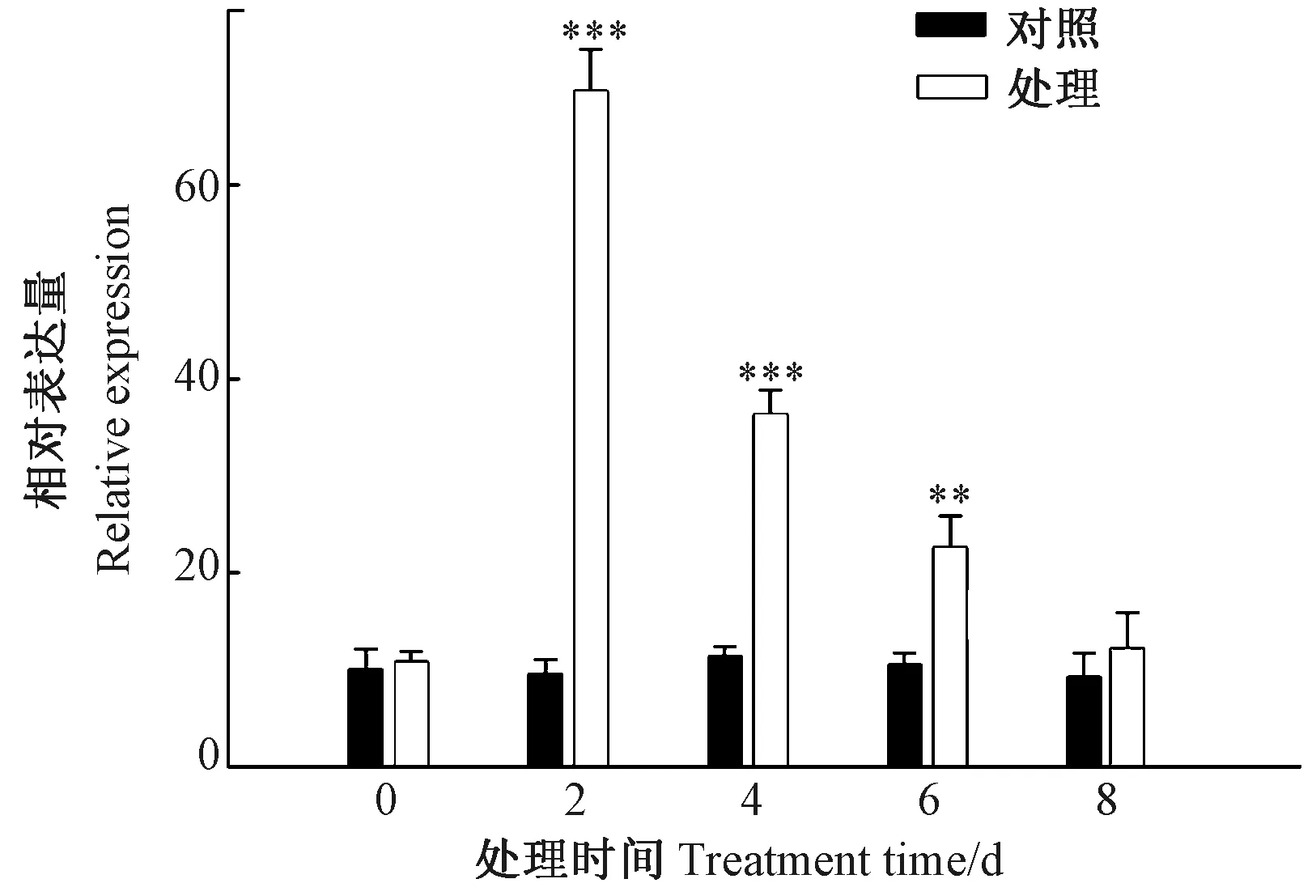
注:**、***分别表示在0.01、0.001水平上差异显著。下同。Note:** indicates significant difference at 0.01 level, *** indicates significant difference at 0.001 level. The same as following.图1 苹果MpCYS4对苹果褐斑病的响应Fig.1 The response of apple MpCYS4 to Diplocarpon mali infection
2.2 苹果MpCYS4基因过表达株系叶片抗性鉴定
在抗性鉴定前,将分离纯化得到的病原菌,对田间苹果健康叶片进行了回接鉴定。接种7 d后接种点出现病斑,与田间自然发病的症状相似。通过对接种叶片的再分离、培养形状和病原形态学观察,接种病原菌的发病叶片均再次分离得到与接种菌一致的菌,证明回接菌株是苹果褐斑病病原菌。
随后,对野生型和转基因M26苹果叶片进行了抗性鉴定,发现病菌接种10 d后,野生型叶片褐色病斑多且连接成片,而转基因株系叶片病斑数量明显较少、发病情况明显较轻(图2)。发病情况统计显示,接种10 d后,野生型叶片接种点的发病率达到90%,转基因叶片仅为60%~70%。此外,转基因接种叶片的病情指数也显著低于野生型植株(图3)。综上说明,MpCYS4过量表达显著提高了苹果叶片对褐斑病的抗性。

图2 褐斑病接种10 d后野生型和MpCYS4转基因株系(#1、#3、#4)叶片发病情况Fig.2 Phenotypes of apple leaves (wild-type and transgenic line #1,#3,and #4) after inoculation with Diplocarpon mali for 10 days
2.3 MpCYS4融合蛋白诱导及活力分析
为确定MpCYS4融合蛋白的活性,以木瓜蛋白酶为底物进行体外试验。由图4-A、 B可知,纯化得到的MpCYS4目的蛋白纯度较好,对木瓜蛋白酶的活力具有明显的抑制效果,且这种抑制效应随着反应体系中MpCYS4蛋白含量的增加而增强。
2.4 MpCYS4融合蛋白抑菌活性分析
由图5-A、B可知,加入空载体pET-32a的蛋白粗提液与不加任何蛋白的褐斑病病菌生长结果相似,OD492基本相等;加入MpCYS4融合蛋白的褐斑病培养液OD492明显小于对照。且随着MpCYS4蛋白浓度增加,OD492减小,抑菌活性增强。上述结果初步显示,MpCYS4融合蛋白对苹果褐斑病具有一定的生长抑制作用。

图3 褐斑病接种10 d后野生型和MpCYS4转基因株系(#1,#3,#4)叶片发病率及病情指数Fig.3 Incidence and disease index of apple leaves (wild-type and transgenic line #1,#3,and #4) after inoculation with Diplocarpon mali for 10 days
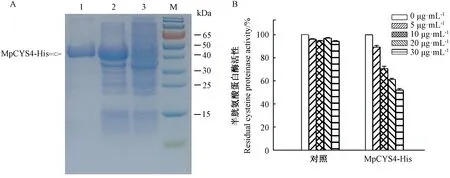
注:1:纯化的MpCYS4-His融合蛋白;2:经IPTG诱导12 h的总可溶性蛋白;3:未经IPTG诱导的总可溶性蛋白。Note: 1: Purified recombinant MpCYS-His fusion protein. 2: Total soluble protein fraction after 12 h of IPTG induction. 3: Total soluble protein fraction without IPTG induction.图4 MpCYS4融合蛋白对半胱氨酸蛋白酶活性的抑制效应Fig.4 Inhibition of MpCYS4 fusion protein on cysteine proteinase activity
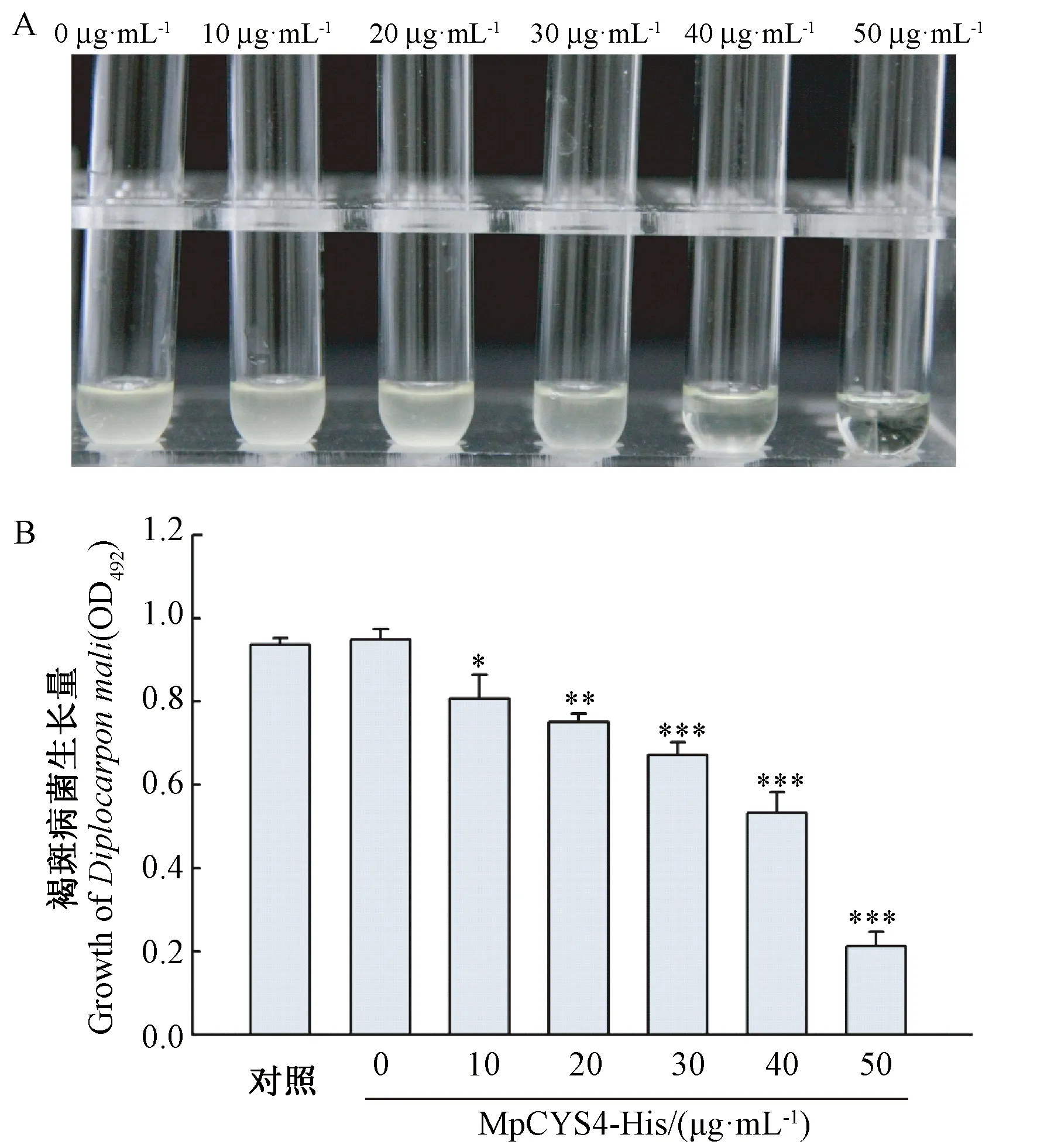
图5 MpCYS4融合蛋白对苹果褐斑病菌的抑制活性Fig.5 Antifungal activity of MpCYS4 recombinant protein to Diplocarpon mali
3 讨论
研究发现,在植物对害虫和某些病原菌的侵染防御响应中cystatin发挥着重要的作用,它们通过调节蛋白酶活性和蛋白质代谢,保护细胞、组织及器官中的蛋白质免受来自病原微生物和昆虫等外源蛋白水解酶的水解,参与一系列生理病理反应过程,形成生物体免疫系统的重要组分[32]。有报道称cystatin可抑制鳞翅目、鞘翅目等有害昆虫消化道内半胱氨酸蛋白酶的活性,扰乱其体内的正常代谢,最终导致发育不正常而死亡[33]。植物cystatin抗虫作用机制的研究报道较多,但对其抗病功能机制的研究还很缺乏[21, 32]。
本研究结果表明,褐斑病病原菌侵染可诱导MpCYS4基因的表达显著上调。在M26中过量表达,离体叶片接种褐斑病病菌后,转基因株系与野生型相比发病情况明显减轻。将MpCYS4体外纯化蛋白添加在培养褐斑病病原真菌的培养基中,病原真菌的孢子萌发和菌丝生长受到明显抑制,这与前人报道的一致[19-22]。表明苹果MpCYS4基因参与其对褐斑病病菌的防御反应,且具有抑制苹果褐斑病病菌生长的作用,但相关的作用机理仍有待深入研究。
有研究者认为,病原微生物需要依赖胞外蛋白酶降解寄主组织,以获得其生长和增殖所需的氨基酸,实现其侵染与扩展。而植物则可能通过分泌蛋白酶抑制剂阻止病原菌蛋白酶对寄主组织的降解,导致其营养不足,生长和增殖受限,达到抗病的目的[34]。也有报道表明,cystatin对病原真菌生长的抑制作用与病原菌体内半胱氨酸蛋白酶的活性并无直接关系,可能通过影响真菌细胞壁的形成或者改变细胞膜的通透性,影响病原真菌的生长[35]。因此,cystatin在植物抗病反应中的相关作用机理仍有待进一步探究。
4 结论
本研究表明,苹果MpCYS4基因的表达受褐斑病病原菌侵染的诱导,在苹果矮化砧木M26中过量表达MpCYS4明显提高了叶片对褐斑病的抗性。将MpCYS4体外纯化蛋白添加在培养褐斑病病原菌的培养基中,病原菌孢子的萌发和菌丝生长均受到明显抑制。本研究为进一步探究MPCYS4的生物学功能及其抗病作用机制奠定了基础,也为苹果抗逆育种提供了新的理论依据。

