立枯丝核菌毒素的研究进展
徐琴琴 陈卫良 毛碧增,*
(1 浙江大学农业与生物技术学院,浙江 杭州 310058;2 农业部作物病虫分子生物学重点实验室,浙江 杭州 310058)
立枯丝核菌(RhizoctoniasolaniKühn)属半知菌亚门丝核菌属(Rhizoctonia),根据菌丝融合情况被划分为14个融合群(anastomosis groups,AGs),即AG-1~AG-13和AG-BI,大多数类群为植物病原真菌,可引起病害[1-2]。
立枯丝核菌不产生无性孢子,常以菌丝或菌核的形态在土壤中或寄主残体上越冬[3],其寄主范围广、危害大,可侵染水稻、马铃薯、大豆、玉米、小麦和烟草等260多种植物[4-5]。据报道每年因立枯丝核菌侵染所引起的水稻纹枯病造成水稻产量减少10%~30%,在华南、江南、长江流域及江淮稻区水稻减产最为严重,高达50%左右[6];玉米纹枯病一般发病率为70%~100%,造成减产损失10%~20%,严重时高达35%[7];马铃薯黑痣病在各马铃薯种植区都有不同程度的发生,特别是在东北三省及内蒙古地区发病率高达70%~80%[8]。因此,如何有效防控立枯丝核菌的侵染与发展已成为国内外十分关注的问题。诸多学者通过转化葡聚糖酶、几丁质酶[9-11]等外源基因来创制纹枯病抗性育种材料,但由于立枯丝核菌寄主范围广、腐生性强,一直都难以寻找到理想抗源,育种进程漫长。基于植物—病原菌互作的机理,立枯丝核菌的致病机理成为研究热点,大量研究表明,立枯丝核菌致病的主要因子为毒素和细胞壁降解酶[12-14]。本文从立枯丝核菌毒素提取工艺的发展、成分鉴定、生物活性及致病机理进行综述,旨在为立枯丝核菌的深入研究和有效防治提供一定的理论依据。
1 立枯丝核菌毒素提取工艺的发展
自1933年首次报道菊池链格孢菌毒素以来,植物病原真菌毒素受到越来越多学者关注,至今已对镰刀菌属(Fusarium)、链格孢属(Alternania)、长蠕孢属(Helminthospo)等进行了系统的研究[15-17]。真菌毒素即真菌在生长繁殖过程中产生的次级代谢物,能够染污几乎所有种类的食用、饲用农产品以及中草药等严重危害人畜健康[17]。大多数病原真菌采用液体培养基培养至菌丝生长紧密成团、收集滤液方法来提取毒素,但不同病原真菌适宜培养基及产毒条件不同。
在立枯丝核菌培养液选择方面,1963年,Aoki等[18]首次采用稻叶培养液培养立枯丝核菌并提取获得了立枯丝核菌毒素。此后,康霄文等[19]和徐敬友等[20]采用不同培养液及培养条件对立枯丝核菌进行培养,发现利用pH值7的改良Richard培养液,在25~30℃黑暗条件下培养15 d,每隔8 h人工振荡1次的条件下产生的毒素对水稻胚根生长抑制率最高(89%)。此外,张正禹等[14]采用待立枯丝核菌菌丝长满培养基并产生大量菌核后,将菌丝及培养基切成小块进行浸泡的方法来提取毒素;Aliferis等[21]直接对菌核成熟过程化合物进行分析鉴定。综上表明,获取立枯丝核菌毒素通常采用Richard培养液培养的方法,Richard培养液营养成分简单,用于毒素的分离纯化具有优势,但Richard培养液组分与植物组织成分存在较大的差异,故用其培养立枯丝核菌获得的毒素成分及含量与该病原菌在寄主上产生的毒素成分及含量可能有一定的差异。在毒素浓缩纯化方面,Xu等[22]、陈夕军等[23]和Frederick等[24]主要采取乙酸乙酯萃取法、真空浓缩法、活性炭吸附法、酸度调节萃取法、乙醚萃取法和活性炭吸附萃取等方法对毒素进行浓缩提纯,发现通过乙醚萃取法所得的立枯丝核菌毒素的毒性最强。
2 立枯丝核菌毒素的成分鉴定
真菌代谢物的成分主要包括多糖、糖肽、酚类、杂环化合物、氨基酸衍生物、类萜化合物以及脂类化合物等[25]。早期由于毒理学研究技术的限制,真菌毒素的研究不全面,主要集中在黄曲霉毒素、链格孢毒素、长蠕孢毒素和镰刀菌毒素[15-16, 26-27]。迄今为止,立枯丝核菌毒素的成分尚无明确定论,大多认为其成分为羧酸及衍生物或者糖类及糖胺。
2.1 羧酸及衍生物
1962年,Aoki等[18]从甜菜中分离到2株立枯丝核菌菌株,代谢物成分为乳酸(图1-A)、丁二酸(图1-B)、苯乙酸(图1-C)、2-呋喃甲酸(图1-D)和间羟基苯乙酸(图1-E)。1980年,Mandava等[28]从大豆中分离出AG1-IA 亚群菌株,代谢物成分为羧酸及衍生物,并首次发现了新化合物成分间甲氧基苯乙酸(图1-F),还通过高效液相色谱法定量分析了羧酸及衍生物含量。
近年来随着光谱和色谱技术的不断发展,立枯丝核菌代谢物成分鉴定越来越精确。2015年,Xu等[22]通过电喷雾质谱(electrospray ionization mass spectometry,ESI-MS)、高分辨电喷雾质谱(high resolution electrospray ionization mass spectometry,HR-ESI-MS)、核磁共振氢谱(1Hnuclear magnetic resonance,1H NMR)和核磁共振碳谱(13Cnuclear magnetic resonance,13C NMR)等方法,发现分离于水稻的立枯丝核菌菌株产生的次生代谢物包含了8种化合物,其中,间-羟基苯基乙酸甲酯(图1-H)、(Z)-3-甲基戊-2-烯-1,5-二酸(图1-I)和3-甲氧基呋喃-2-羧酸(图1-G)首次被鉴定出。
2016年,Frederick等[24,29]从马铃薯中分离到属于立枯丝核菌融合群AG-3中菌株,应用高效液相色谱(high performance liquid choromatography,HPLC)和核磁共振质谱(nuclear magnetic resonance,NMR)技术对其发酵液进行分析,鉴定出3-甲硫基丙酸(3-Methylthiopropionic acid,3-MTPA)(图1-J)和3-甲硫基丙烯酸(3-Methylthioacrylic acid,3-MTAA)(图1-K)2种新成分。傅立叶转红外光谱(fourier tansform infrared spectrometer,FTIR)结果显示,其主要官能团包括2 962.1(-CH3)、1 465.6(-CH2-)、1 727.9(C=O)、1 729.8(-COOH)和1 124.3 cm-1(-OH)。
Hu等[30-31]采用超效液相色谱四极飞行时间质谱分析(ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry,UPLC-QTOF-MS)技术对立枯丝核菌AG1-IA亚群3个菌株菌核成熟过程中代谢物进行分析,首次在菌丝体中鉴定出细交链孢菌酮酸(tenuazonic acid)(图1-L)。研究表明,细交链孢菌酮酸是一种天然植物毒素剂,已被证明是一种新型的光系统Ⅱ抑制剂[30-31]。

注:A:乳酸;B:丁二酸;C:苯乙酸;D:2-呋喃甲酸;E:间羟基苯乙酸;F:间甲氧基苯乙酸;G:3-甲氧基呋喃-2-羧酸;H:间-羟基苯基乙酸甲酯;I:(Z)-3-甲基戊-2-烯-1,5二酸;J:3-甲硫基丙酸;K:3-甲硫基丙烯酸;L:细交链孢菌酮酸。注:A:Lactic acid. B:Succinic acid. C:Phenylacetic acid. D:2-Furoic acid. E:M-hydroxyphenylacetic acid. F:M-methoxyphenylacetic acid. G:3-methoxyfuran-2-carboxylic acid. H:Methyl m-hydroxyphenyl acetate. I:(Z)-3-methylpent-2-en-1,5-dioic acid. J:3-Methylthiopropionic acid. K:3-Methylthioacrylic acid. L:Tenuazonic acid.图1 立枯丝核菌羧酸及衍生物类代谢物化学结构式Fig.1 Chemical structures of carboxylic acids and and derivatives metabolites from Rhizoctonia solani
2.2 糖类及糖胺
糖类及糖胺的研究始于1997年,Vidhyasekaran等[32]从水稻上分离到立枯丝核菌株,其组分含甘露糖、葡萄糖和N-乙酰基葡萄糖。2001年,Sriram等[33]研究发现立枯丝核菌毒素为一类含葡萄糖、甘露糖和N-乙酰半乳糖胺的糖类及糖胺类混合物。近年来,陈夕军等[23]对立枯丝核菌毒素进行HPLC、薄层层析(thin layer chromatography,TLC)、红外光谱(infrared spectrometer,IR)和气相色谱-质谱联用(gas choromatography mass spectrometry,GC-MS)分析,发现其包含葡萄糖、蔗糖和N-乙酰氨基甘露糖。Yang等[34]认为立枯丝核菌毒素组分包含甘露糖、木糖和半乳糖等6种糖类物质。杨迎青等[12]采用GC-MS方法检测糖类,液相色谱-质谱联用(liquid choromatography mass spectrometry,LC-MS)方法检测苯乙酸及其衍生物,检测到甘露糖、葡萄糖、阿拉伯糖、木糖、半乳糖和核糖6种糖类物质,未检出苯乙酸及其衍生物。
植物病原菌毒素对寄主致病范围不同,可将毒素分为寄主专化性毒素(host-specific toxin,HST)和非寄主专化性毒素(non-host-specific toxin,NHST)。国内外关于立枯丝核菌毒素属于HST型或属于NHST型的报道均有,但尚未有明确定论。Aoki等[18]主张立枯丝核菌毒素为NHST型毒素,其成分为羧酸及衍生物;Vidhyasekaran等[32]主张立枯丝核菌毒素为HST型毒素,其成分为糖类及糖胺。此外,羧酸及其衍生物毒素中的间羟基苯乙酸、3-甲硫基丙酸和细交链孢菌酮酸为毒素的主要毒性成分;糖类及糖胺毒素作为粗毒素混合溶液也具有明显生物活性,但其中主要毒性成分的确定以及如何共同发挥作用有待进一步研究。
3 立枯丝核菌毒素的生物活性检测
生物活性检测是一种最普遍、最传统的方法,检测结果也最直观[25]。检测材料大到整株植物甚至整个群体,小至某个细胞、原生质体甚至细胞器或亚细胞器。整株植株检测材料方法简单,但要求能大量制备毒素,细胞和原生质体检测材料适合那些不易制备的毒素。立枯丝核菌毒素的生物活性检测分为粗毒素混合物生物活性检测和单一化合物生物活性检测。
3.1 粗毒素混合物生物活性检测
测定不同菌株的毒素对不同抗性植株毒力强弱的常用方法包括胚根胚芽伸长抑制法、叶鞘针刺接种法和离体叶片针刺法。研究表明,立枯丝核菌毒素对胚根生长有明显抑制作用,而对胚芽生长抑制作用不明显。刘洪涛等[35]指出不同菌株毒素毒力差距明显,致病力强的菌株,毒素毒力越强。Zhou等[36]研究发现,多核丝核菌分离株产生的毒素毒力最强,对玉米种子发芽和根的生长抑制率分别高达81.76%和82.99%;双核丝核菌分离株产生的毒素毒力次之;单核丝核菌分离株产生的毒素毒力最低,对玉米种子发芽和根的生长抑制率为7.04%和14.93%。Ren等[37]采用一年生苦苣菜、大白菜、菠菜、莴苣、油麦菜和烟草代替水稻对立枯丝核菌毒素的生物活性进行评价,结果显示,莴苣是最佳模式植株。张正禹等[14]发现在不同抗性水平水稻间,同一菌株产生的毒素毒力无明显差别;但不同水稻组织对毒素的敏感性不同,水稻叶鞘比叶片更为敏感,且通过针刺接种法将毒素接种至叶鞘部位会产生与纹枯病相似的症状。
3.2 单一代谢物生物活性检测
Aoki等[18]在生物活性测定试验中发现,当苯乙酸浓度为0.005%时,能抑制油菜和水稻根的生长,苯乙酸浓度达到0.05%时能抑制甜菜根的生长,但随着浓度的增加不会产生坏死现象;而间羟基苯乙酸为0.025%时能抑制甜菜根的生长,且当浓度达到1%时会产生坏死斑。因此,苯乙酸并不是毒素发挥毒性的主要成分,立枯丝核菌先产生苯乙酸,再通过各种代谢途径形成各类衍生物共同发挥作用。Mandava等[28]通过测定粗毒素和邻、间、对羟基苯乙酸溶液对莴苣幼苗下胚轴生长、大豆第二节间伸长和大豆幼苗枯萎及固氮作用的影响来比较其生物活性。结果显示,各溶液均对莴苣幼苗下胚轴伸长均有明显抑制作用;粗毒素和邻、间羟基苯乙酸溶液均能诱导大豆第二节间的细胞伸长,而对羟基苯乙酸有明显抑制作用;较低浓度的粗毒素溶液处理便能使大豆幼苗萎焉,邻、间、对羟基苯乙酸仅在浓度处理条件下致萎;各溶液均能显著抑制固氮,且粗毒素与间羟基苯乙酸抑制作用较强。Frederick等[29]研究表明,MTPA处理后的马铃薯根长明显缩短,根的坏死率达80%;75 d后其株高、鲜重和冠层覆盖率显著降低,匍匐茎数量显著减少且植株患病率高达82%。
4 立枯丝核菌毒素的致病机理
植物病原真菌毒素致病机理十分复杂[38]。大多研究表明,真菌毒素能干扰和破坏寄主植物的各种代谢,其主要作用位点是细胞质膜、叶绿体和线粒体等,同时还对植物蛋白质和核酸的合成有一定的抑制作用[39-40]。
4.1 毒素对细胞破坏作用
陈夕军等[13]和Frederick等[24]对立枯丝核菌粗毒素混合溶液处理后细胞进行显微观察,发现细胞结构破坏明显:细胞膜解体(图2-6)直至消失、线粒体(图2-5)和叶绿体变形、内质网肿胀(图2-2)、细胞内含物消失(图2-3)、细胞核内可以看见更多的染色质、细胞壁松散变薄不再光滑等。这是由于毒素作为一种化学性的损害因子导致细胞坏死,细胞膜、细胞器、细胞壁和细胞核在结构发生一系列的变化。
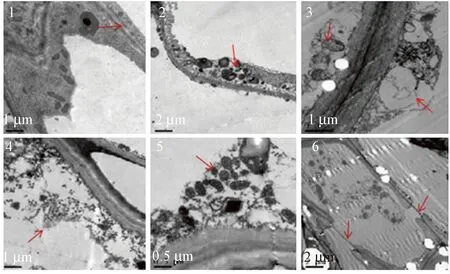
注:1:对照正常细胞膜结构(×10 000);2:处理24 h后肿胀质粒(×5 000);3:处理48 h后肿胀内质网(×10 000);4:处理后72 h细胞内含物消失(×20 000);5:处理马铃薯中线粒体的变形(×20 000);6:处理 马铃薯中质膜的破裂(×5 000)。Note:1:The normal structure of cell membrane in control (×10 000).2: Plasmids swelling 24 hours after treatment (×5 000). 3:Endoplasmic reticulum swelling 48 hours after treatment (×10 000). 4: Cell inclusions disappeared 72 hours after treatment (×10 000). 5: Deformation of mitochondrial in treatment (×20 000). 6: Rupture of plasma membrane in treatment (×5 000).图2 立枯丝核菌毒素对马铃薯组织和细胞的破坏[24]Fig.2 Destructive effects of Rhizoctonia solani phytotoxin on tissue and cell of potato[24]
4.2 毒素对细胞膜的损伤作用
Vidhyasekaran等[32]和陈夕军等[13]研究证明,立枯丝核菌毒素处理水稻组织后电解质外渗显著,且处理时间越长,毒素浓度越高,外渗率越高。这是因为毒素作用于类脂和蛋白质构成的生物膜从而导致细胞膜透性改变、电解质外渗。Ren等[37]研究表明,毒素溶液处理后的水稻和莴苣组织磷素均外渗,但经融合群AG1-IA菌株产生的毒素处理后,水稻和莴苣组织细胞磷外渗高达140 μg左右,而经融合群AG1-IB菌株产生的毒素处理后,水稻和莴苣组织细胞磷外只有25 μg左右。这说明细胞膜中的类脂可能是毒素的靶标位点,且不同融合群菌株产生的毒素生物活性不同,导致对细胞膜的损伤效果存在显著。
4.3 毒素对寄主植物酶的影响
虽然开展病原真菌毒素对寄主植物各种酶影响的研究较晚,但进展很快,近年来学者们研究较多的是β-1,3葡聚糖酶和几丁质酶等病程相关蛋白[41-43]。此外,毒素对寄主植物体内一些防御酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)和苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)有一定影响。Sriram等[44]指出立枯丝核菌毒素能诱导水稻植物中几丁质酶和β-1,3-葡聚糖酶合成;Ramalingam[45]、徐艳[46]、左示敏等[47]和Paranidharan等[48]研究表明,低浓度和高浓度毒素处理水稻,POD、PPO、PAL、SOD活性变化很小;当毒素稀释100倍,各酶活性达最大值;且随着处理时间的延长各酶性活丧失。此外,感病水稻品种比中抗品种各防御酶达到峰值的时间要晚。
5 结论与展望
立枯丝核菌毒素通常采用液体培养基培养至菌丝生长紧密成团、收集滤液的方法来获取。立枯丝核菌最佳产毒培养条件为:pH值7的改良Richard培养液,25~30℃黑暗条件下培养15 d,每隔8 h人工振荡1次。在毒素纯化方面,通常采用萃取蒸发方法来提取毒素,陈夕军等[23]研究表明通过乙醚萃取法所得的立枯丝核菌毒素的毒性最强。立枯丝核菌毒素为立枯丝核菌重要致病因子之一。病原菌在培养过程中会向培养液中分泌毒素,不同融合群或亚群病原菌产生的毒素可能不同[49],且不同的培养液及不同的提取方法获得的毒素也不同[22、24、33、49]。因此,改善毒素分离和纯化方法,获得能稳定制备具有生物活性毒素方法是今后研究的重点之一。
针对立枯丝核菌毒素成分,研究学者有2种看法:一种认为立枯丝核菌毒素为NHST型,其成分为羧酸及衍生物;另一种认为立枯丝核菌毒素属HST型,其成分为糖类及糖胺。以上2种看法不统一,尚无明确定论。研究表明,并非代谢物中的所有成分都为毒素物质,进一步明确代谢物中发挥毒性的单一成分并对其分子结构分析是今后研究重点之一。但由于有些成分物质分子量相差很小,且不同组分分流时间间隔较小,很难分段收集,因而较难获得单一组分纯品。在毒素生物活性的测定方面,生物活性评价方法有待于进一步规范统一,毒素发挥生物活性有待于进行定量分析。
立枯丝核菌毒素致病机理十分复杂,现有研究还停留在毒素对组织细胞破坏与对寄主植物防御酶影响等基础方面。近年来Ghosh等[50-51]从立枯丝核菌对水稻叶绿体破坏、光合作用的影响、基因调控和代谢组的改变来鉴定其侯选致病因子。Sriram等[33]和Shanmugam等[52]发现分别从黄绿青霉和椰子叶片中分离到的α-葡萄糖苷酶能抑制毒素活性。Vidhyasekaran等[32]早先研究指出,寄主专化性立枯丝核菌毒素成分中有85%为葡萄糖单元,而α-葡萄糖苷酶能水解葡萄糖苷键释放出葡萄糖和其他物质[53-54]。因此,α-葡萄糖苷酶可能通过水解葡萄糖苷键从而降解毒素。但未对人工合成的α-葡萄糖苷酶进行研究,如果人工合成的α-葡萄糖苷酶具有相同的活性,将具有很好的应用前景。此外,Yang等[55]发现井冈霉素也能减弱立枯丝核菌毒素的毒力。虽然抑制部分真菌产毒基因已被克隆,但在立枯丝核菌上的研究还很少,因此,开展抑制纹枯病菌毒素产生的研究具有十分重要的意义。

