春兰与大花蕙兰杂交种红花呈色机理初探
孙 叶 刘 红 李风童 刘春贵 周春华 包建忠 陈秀兰 赵国琦,*
(1 扬州大学动物科学与技术学院,江苏 扬州 225009;2 江苏里下河地区农业科学研究所,江苏 扬州 225007)
春兰(Cymbidiumgoeringii)是兰科(Orchidaceae)兰属(Cymbidium)的原生种之一,大花蕙兰(C.hybridum)是兰属的杂交种。兰属植物约有48个原生种,目前已知用来作为大花蕙兰杂交亲本的原生种有近20种,其中也包括春兰。春兰是传统国兰的重要代表种之一,自然花期正值我国传统节日春节前后,在年销花市场有很大的开发潜力。受传统兰文化的影响,春兰优良品种以瓣型绿花为主,红花品种稀缺。大花蕙兰是当今全球畅销的主要兰花种类之一,作为我国年销花市场高档盆栽花卉的明星品种,年销售量在200万盆以上[1]。大花蕙兰品种的花形、花色极为丰富,在花色素、花色基因及转基因调控花色等研究方面也取得了很大的进展[2-3],但大多数品种无香味、叶形散乱,在我国达不到春化温度的南方地区不易种植开花[4]。目前利用春兰优良品种与大花蕙兰远缘杂交选育小花型、花色丰富、有香味、耐寒的兰属新品种是市场开发的热点[5],同时这些新品种也是研究花色形成和呈色机理的理想材料。
高通量转录组测序技术弥补了非模式生物缺乏参考基因组信息的不足,已在观赏植物领域广泛应用。近年来春兰、蕙兰、建兰、墨兰、春剑等国兰利用转录组测序技术,在花发育、花色、叶色、叶形等相关功能基因的挖掘和基因组转录调控分析方面取得了很大的进展[6-12]。兰科植物的花色主要由类黄酮、类胡萝卜素和叶绿素的含量及其比例决定,花青苷是红花显色最重要的色素。植物中类黄酮、类胡萝卜素和叶绿素合成代谢途径中的关键结构基因已研究得比较清晰,影响结构基因表达调控的转录因子正成为研究热点,其中MYB(V-myb avain myeloblastosis viral ohcogene)转录因子的研究最为广泛[13-15]。目前已在拟南芥中发现了339个MYB转录因子,位于美国斯坦福大学的拟南芥信息资源网站(TheArabidopsisInformation Resource, TAIR)已公布了133个MYB成员。MYB转录因子中 R2R3-MYB 的数量最多,在拟南芥和水稻已分别鉴定出126和109个R2R3-MYB家族成员[16]。根据蛋白C端保守的氨基酸基序的分析,R2R3-MYB转录因子划分为 28 个不同的亚家族[17],其中S7、S6 和 S2亚家族分别对黄酮醇[18]、花青素及原花青素[19]的调控起关键作用。植物花青苷的合成代谢途径中MBW(MYB-bHLH-WD40)复合体调控模式处于核心地位[20],其中R2R3-MYB转录因子起关键性作用[21],Hsu等[22]认为PeMYB2、PeMYB11和PeMYB12三个 R2R3-MYB转录因子以不同比例的组合表达导致蝴蝶兰中大量复杂的花色素沉着模式。
兰科植物调控花色的结构基因和调节基因的研究已取得了很大的进展[23],但相关基因的克隆和功能验证主要集中在洋兰上,关于国兰的研究进展缓慢,春兰花色形成的分子机理更鲜见报道。前期研究[24]发现绿花春兰品种间杂交,F1出现了红花新种质;绿花春兰品种与黄花大花蕙兰品种杂交,F1同样也出现了红花新种质,且花器官不同发育阶段显色差异较大。本研究采用绿花春兰品种与黄花大花蕙兰品种的红花杂交后代黄金梅2个不同发育期的花瓣进行转录组测序,解析测序数据,系统挖掘春兰与大花蕙兰种间杂交种花色相关的关键结构基因和转录因子,探究基因的表达调控及不同发育期花瓣色素含量的变化,旨在为花色基因的克隆及功能分析,花色调控及呈色机理的解析和新种质的定向选育提供重要的参考依据。
1 材料与方法
1.1 试验材料及转录组测序
供试材料黄金梅是母本绿花春兰大宋梅(图1-A)与父本黄花大花蕙兰黄金虎(图1-B)的杂交种,保存于江苏里下河地区农业科学研究所中国兰种质资源圃。该种质花器官遗传了母本的瓣型和父本的着花数特征,花色发生了变异,小花蕾期为淡黄绿色,随着花蕾的发育逐渐转色,绽蕾后花色渐变为紫红色,与父、母有明显差异。2019年1月选取黄金梅同一株系不同发育期小花蕾样品(图1-C)、黄绿色小花蕾花瓣(主瓣和侧瓣)(图1-D)、紫红色始花期小花瓣(主瓣和侧瓣)(图1-E),用于转录组测序,剩余花瓣同时采样用于花色素测定。取样前用无水乙醇轻擦拭外瓣,分别设3个生物学重复,取样后立即用液氮冻存,测序材料用干冰保存送至上海为青生物技术有限公司进行RNA提取,构建cDNA文库,在Illumina HiseqTM 2000测序平台进行高通量测序;得到原始测序序列(sequenced reads),即原始数据(raw data)。通过过滤去除N(N表示无法确定碱基信息)的比例大于10%、低质量序列、带接头(adapter)的reads,最终获得Clean Data后,利用Trinity软件对Clean Data进行序列组装,得到Unigene库。

注:A:母本大宋梅;B:父本黄金虎;C:杂交种黄金梅;D:小花蕾期;E:始花期。Note: A:Female parent Dasongmei. B:Male parent Huangjinhu.C:Hybrid Huangjinmei. D:Little flower Bud stage. E:Opening stage.图1 取样材料及其亲本Fig.1 Sampling materials and their parents
1.2 差异表达基因功能注释、富集分析及花色素基因分析
使用BLAST软件将测序Unigene与Pfam、TrEMBL、eggNOG、Swiss-Prot、GO、KEGG数据库进行序列比对,获得Unigene的注释信息,对差异表达基因(differential express genes, DEGs)做GO功能富集分析、KEGG注释及通路富集分析。检索类黄酮、类胡萝卜素及叶绿色合成途径中关键结构基因及花青素合成相关转录因子信息,获取相关基因的核苷酸长度及2样本差异表达的FPKM(fragments per kilobase per million)值。利用BLAST软件在NCBI数)据库中筛选花青苷合成途径中下游关键基因和转录因子的同源基因。
1.3 基因转录模式验证
选择类黄酮及类胡萝卜素形成关键通路14个表达差异较大基因设计引物(表1),以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参,利用转录组测序时提取的小花蕾、始花期花瓣RNA反转录获得cDNA作为荧光定量PCR(quantitative real-time PCR, qPCR) 反应的模板,在LightCycler96实时荧光定量PCR仪(瑞士罗氏公司)中进行,验证基因的表达。根据SYBR®PremixExTaqⅡ (Tli RNaseH Plus)(日本TaKaRa公司)说明书配置反应体系,每个样品设3次重复。反应体系:SYBRPremixExTaqⅡ (Tli RNaseH Plus) (2×) 10.0 μL、10 μmol·L-1正反向引物各0.8 μL、cDNA模板50~100 ng、ddH2O补足至20 μL。PCR扩增程序:95℃预变性30 s;95℃变性5 s,60℃退火,延伸20 s, 40个循环;熔解曲线分析程序:95℃持续1 s,65℃持续60 s,97℃持续1 s。用2-ΔΔCt方法进行相对定量分析。
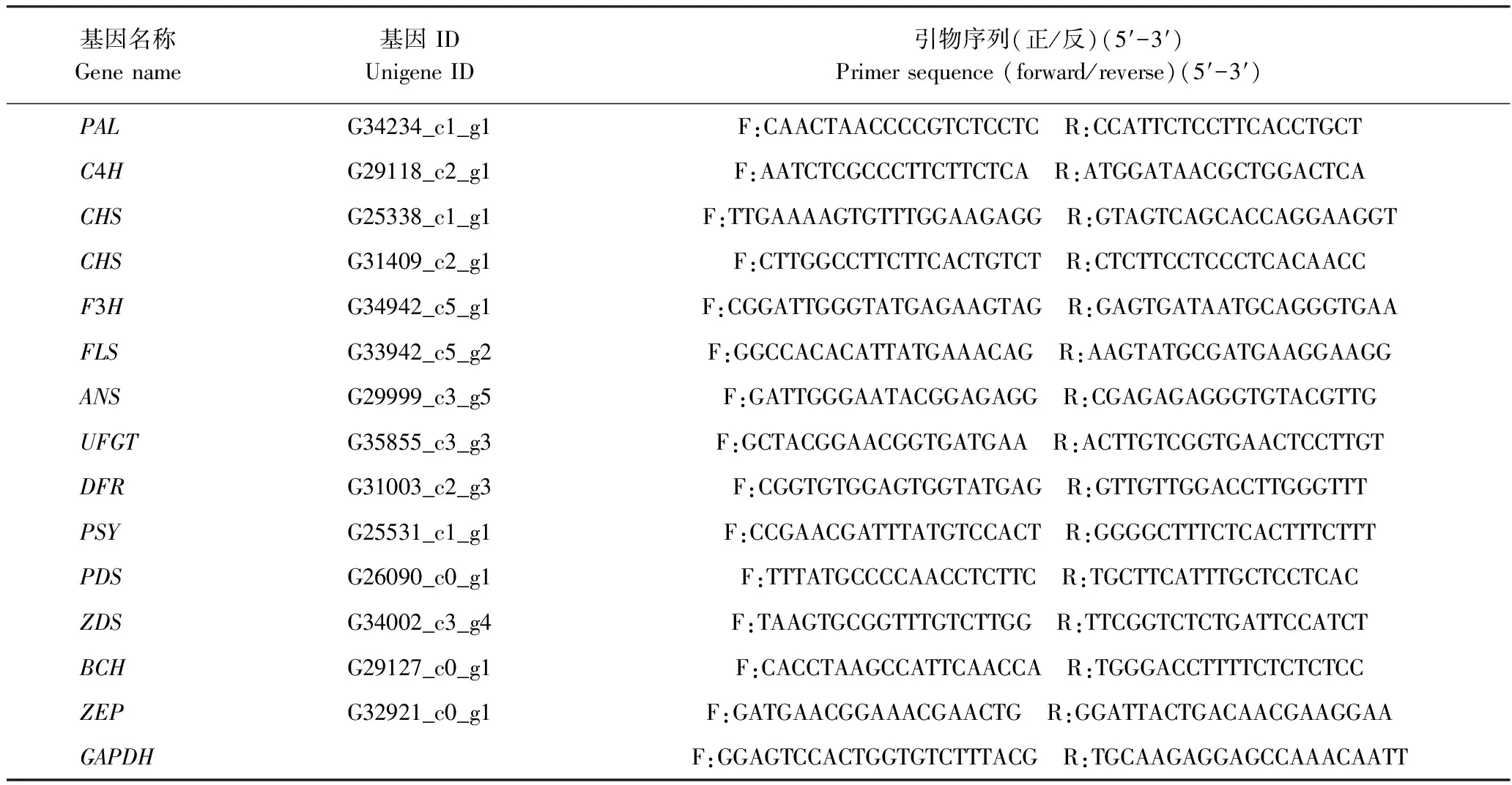
表1 基因及内参引物信息Table 1 The primer information of gene and internal reference
1.4 总花青素苷、总黄酮、类胡萝卜素及叶绿素含量测定
花青素及黄酮提取参考Yang等[25]的方法,总花青素苷含量(total anthocyanin content, TAC)测定采用可见分光光度法[26],总黄酮含量(total flavonoids content, TFC)的测定采用AlCl3显色法[27],重复3次。参照 Lichtenthaler 等[28]的方法进行叶绿素和类胡萝卜素含量的测定,3次重复。采用SPSS 17.0 进行t检验计算不同发育期色素含量的差异显著性。
2 结果与分析
2.1 转录组测序数据分析与组装
提取试验材料黄金梅小花蕾期和始花期花瓣的总RNA,结果显示,A样品RNA浓度为276 μg·μL-1,总量为27.6 μg;B样品RNA浓度为291 μg·μL-1,总量为29.1 μg;OD260/280>2.0,OD260/230>1.8,RIN>9.0,28S:18S>1.6;凝胶电泳结果显示5S、18S、28S条带完整,样品质量符合建库标准要求。建库后对2个样品进行转录组测序,测序数据经FASTX过滤后共获得高质量碱基序列140 453 340个,碱基数为39 908 521 302 bp, 2个样品Mapped Reads在Clean Reads中所占比例分别为86.83%(A)、88.29%(B);质量值Q20和Q30均大于90%,GC含量均大于47.5%,证明测序质量好。Trinity合并组装后分析统计拼接长度数据(表2),得到 188 837条Transcript和113 780条Unigene,其中200~300 bp的Unigene比例最高有48 564 条,比例最少的为1 500~2 000 bp的Unigene 4 041条,仅占3.55%;组装得到Transcript与Unigene的平均长度为725.64 bp和586.53 bp,N50分别为1 229 bp 和882 bp,组装完整性较高,可进行下一步分析。
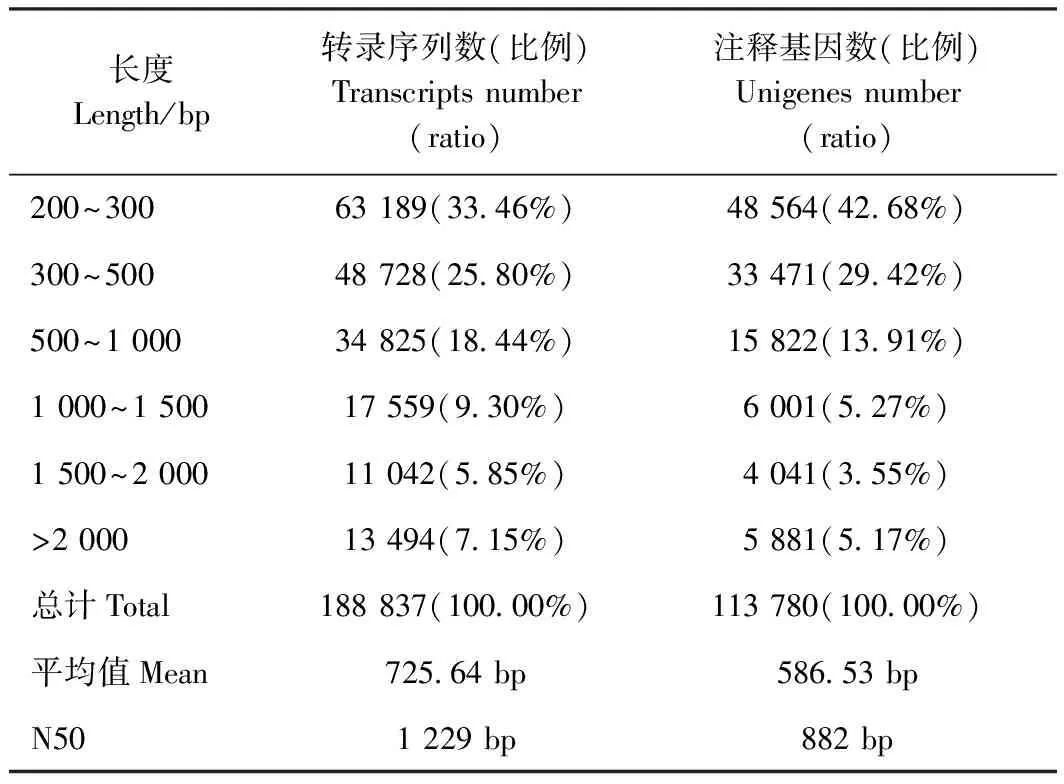
表2 转录组长度分布统计表Table 2 Statistical table of the length distribution of the transcriptome
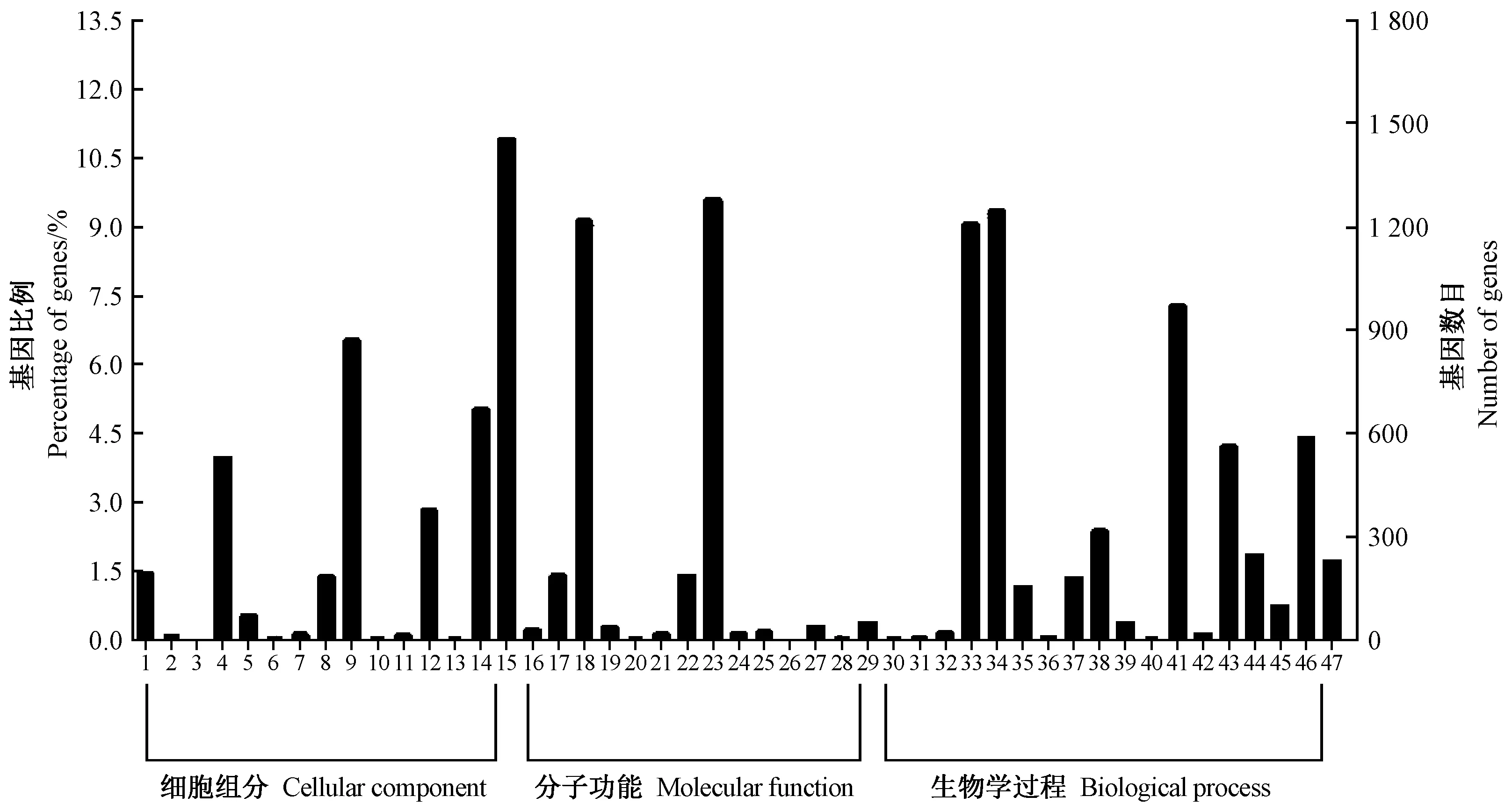
注:1:胞外区;2:细胞;3:细胞核;4:细胞膜;5:细胞连接;6:胞外基质;7:膜封闭腔;8:复杂大分子;9:细胞器;10:细胞外基质部分;11:细胞外区域部分;12:细胞器组分;13:病毒粒子部分;14:膜结构;15:细胞组分;16:蛋白结合转录因子活性;17:核酸结合转录因子活性;18:催化活性;19:受体活性;20:鸟嘌呤核苷酸交换因子活性;21:结构分子活性;22:转运活性;23:结合;24:电子载体活性;25:抗氧化活性;26:金属伴随子活性;27:酶调节活性;28:营养贮存活性;29:分子转导活性;30:繁殖;31:细胞杀伤;32:免疫系统过程;33:代谢过程;34:细胞过程;35:生殖过程;36:信号传导;37:多细胞生物过程;38:发育过程;39:生长;40:运动;41:单一生物过程;42:生物调节;43:刺激反 应;44:定位;45:多细胞生物过程;46:生物调节;47:细胞组成机制或生物合成。Tips: 1: Extracellular region. 2: Cell. 3: Nucleoid. 4: Membrane. 5: Cell junction. 6: Extracellular matrix. 7: Membrane-enclosed lumen. 8: Macromolecular complex. 9: Organelle. 10: Extracellular matrix part. 11: Extracellular region part. 12: Organelle part. 13: Virion part. 14: Membrane part. 15: Cell part. 16: Protein binding transcription factor activity. 17: Nucleic acid binding transcription factor activity. 18: Catalytic activity. 19: Receptor activity. 20: Guanyl-nucleotide exchange factor activity. 21: Structural molecule activity. 22: Transporter activity. 23: Binding. 24: Electron carrier activity. 25: Antioxidant activity. 26: Metallochaperone activity. 27: Enzyme regulator activity. 28: Nutrient reservoir activity. 29: Molecular transducer activity. 30: Reproduction. 31: Cell killing. 32: Immune system process. 33: Metabolic process. 34: Cellular process. 35: Reproductive process. 36: Signaling. 37: Multicellular organismal process. 38: Developmental process. 39: Growth. 40: Locomotion. 41: Single-organism process. 42: Rhythmic process. 43: Response to stimulus. 44: Localization. 45: Multi-organism process. 46: Biological regulation. 47: Cellular component organization or biogenesis.图2 差异表达基因GO功能富集Fig.2 GO function enrichment of differentially expressed genes
2.2 转录组的功能注释及转录组差异表达分析
基于基因在小花蕾期和始花期2个样品中表达量,对识别到的DEGs进行功能注释,使用BLAST软件将Unigene与Pfam,TrEMBL,eggNOG,Swiss-Prot,GO,KEGG数据库进行序列比对,44 088个Unigene获得注释信息,27 801个Unigene被GO数据库注释,32 528 个Unigene被eggNOG数据库注释,32 781个Unigene被KEGG数据库注释。组装得到的Unigene进行FPKM值表达量统计,2个样品测得4 349 个DEGs,较小花蕾期1 855个基因表达上调,较始花期2 494个基因表达下调。
2.3 差异表达基因GO功能富集
使用Blast2GO软件对检测到的DEGs进行GO功能注释和富集分析。由图2可知,DEGs划分为47个功能组,包括生物学过程、细胞组分、分子功能三大类。其中6 658个GO条目属于生物学过程,DEGs主要分布于细胞转化(1 416,9.35%)、代谢过程(1 372,9.06%)、单细胞生物工程(1 101,7.27%)、生物调节(663,4.38%)、刺激反应(639,4.22%);4 989个GO条目属于细胞组成,注释为细胞组分(1 651,10.90%)、细胞器(989,6.53%)、膜组分(759,5.01%)等相关的DEGs富集较多;3 494个GO条目属于分子功能,注释为结合(1 453,9.60%)、催化活性(13 83,9.13%)等功能相关的DEGs较多。
2.4 差异表达基因KEGG通路富集分析
本试验测序数据中1 219个DEGs被KEGG数据库注释,涉及166条代谢途径。DEGs富集排名前五的KEGG通路为苯丙醇生物合成(phenylpropanoid biosynthesis)(ko00940,68)、淀粉与蔗糖的代谢(starch and sucrose metabolism)(ko00500,41)、植物激素信号转导(plant hormone signal transduction)(ko04075,40)、氰氨基酸代谢(cyanoamino acid metabolism)(ko00460,28)、α-亚麻酸代谢(alpha-linolenic acid metabolis)(ko00592,25);与花色形成紧密相关的有类黄酮生物合成途径(flavonoid biosynthesis)(ko00941,10)、黄酮和黄酮醇生物合成途径(flavone and flavonol biosynthesis)(ko00944,2)、类胡萝卜生物合成途径(carotenoid biosynthesis)(ko00906,6)卟啉和叶绿素代谢(porphyrin and chlorophyll metabolism)(ko00860,1)。
2.5 花色相关基因表达分析
根据差异基因KEGG代谢途径及基因注释,从类黄酮、类胡萝卜素、叶绿素合成代谢途径,挖掘出与花色相关的54个关键结构基因(表3)和21个转录调控基因(表4)。由FPKM值可见小花蕾期和始花期2个样本基因表达的差异,始花期样品中结构基因有24条单基因较小花蕾期上调,30条单基因下调;类黄酮双加氧酶基因(naringenin 3-dioxygenase,F3H)、DFR、ANS、矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷转移酶基因(cyanidin 3-O-rutinoside 5-O-glucosyltransferase, 3,5GT)、PDS、ZDS、类胡萝卜素裂解双加氧酶基因(cis-β-carotene 9′, 10′-cleaving dioxygenase,CCD7)、叶绿素a合成酶基因(chlorophyll a synthase, CHLG)、叶绿素b还原酶(chlorophyll b reductase,NOL)、叶绿素酶基因(chlorophyllase,CLH)、脱镁叶绿酸加氧酶基因(pheophorbide a oxygenase,PAO)、顺式-环氧类胡萝卜素双加氧酶基因(9-cis-epoxycarotenoid dioxygenase,NCED)均为上调表达;PAL、查耳酮异构酶基因 (chalcone isomerase,CHI)、类黄酮3′-羟化酶基因(flavonoid 3′-monooxygenase,F3′H)、类黄酮-3',5-羟化酶基因(flavonoid 3′,5′-hydroxylase, F3′5′H)、UFGT、花青素糖基转移酶基因(Anthocyanidin 3-O-glucosyltransferase, 3GT)、PSY、BCH、ZEP、胡萝卜素顺反异构酶基因(carotene cis-trans isomerase, CRTISO)、镁螯合酶基因(magnesium chelatase subunit H,CHLH)、叶绿素a加氧酶基因(chlorophyllide a oxygenase,CAO)均为下调表达;C4H、香豆酸:辅酶A连接酶基因(4-coumarate—CoA ligase, 4CL)、CHS、FLS、花青素双糖基转移酶基因(anthocyanidin5,3-O-glucosyltransferase, 5,3GT)的表达量既有上调也有下调;类胡萝卜素合成代谢途径的关键酶基因除ZDS和CCD7表达量较高外,其他基因表达量均较小;叶绿素合成酶基因仅CHLG表达量上调,叶绿素降解酶基因均上调。小花蕾期CHS(Unigene ID:G31409_c2_g1)基因表达量最高,始花期F3H(Unigene ID:G34942_c5_g1)基因表达量最高。
与小花蕾期样品相比,始花期样品的调节基因有8条单基因上调,13条单基因下调;通过基因注释,在样本中筛选出玉米糊粉层有色基因(coloured aleurone,C1)、玉米种皮有色基因(pericarp color,P)、玉米转录因子(zeamays1,Zm1)、MYB4、MYB6、外种皮透明基因2(transparent testa 2,TT2)、bHLH13同源性较高的转录因子,Zm1转录因子的表达量较高;小花蕾期转录因子MYB306(Unigene ID:G19067_c0_g1)表达量最高,始花期转录因子MYB31(Unigene ID:G12396_c0_g1)表达量最高。
与小花蕾期样品相比,始花期样品中花青苷合成下游关键结构基因DFR、ANS、3,5GT及转录因子Zm1、Hv1、MYB305、MYB31表达量整体较高,且在始花期均为上调。在NCBI数据库BLAST花青苷下游合成基因及部分表达量较高的转录因子同源性物种,由表5可见,与DFR、ANS、3GT基因同源性最高的物种均为大花蕙兰,与5,3GT、3,5GT、Zm1同源性最高的为蝴蝶兰或石斛兰,与转录因子MYB31同源性最高的为墨兰,与转录因子Hv1、MYB305、MYB306同源性最高的均为建兰。
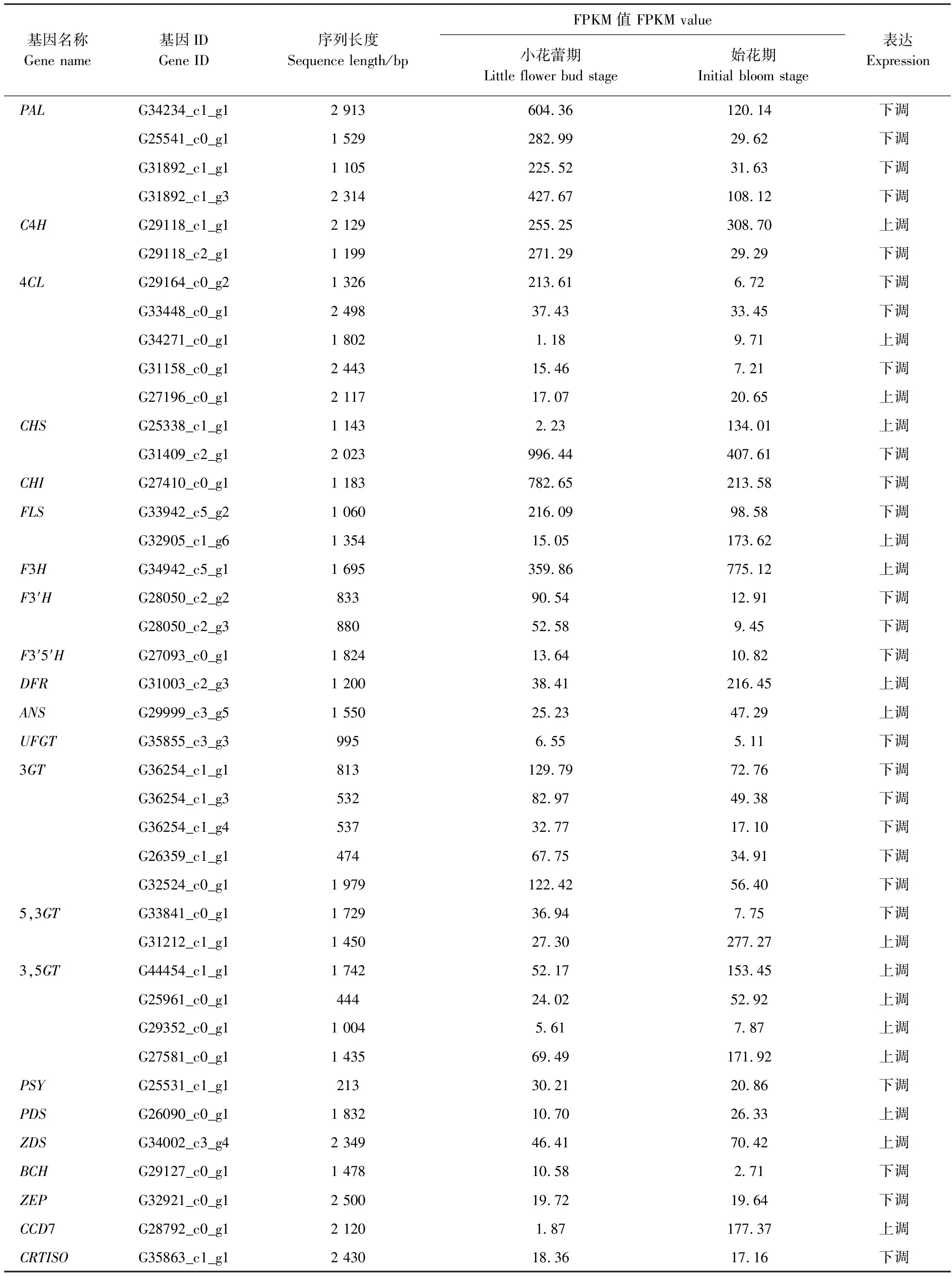
表3 花色关键结构基因差异表达Table 3 Differential expression of key structural genes related flower color
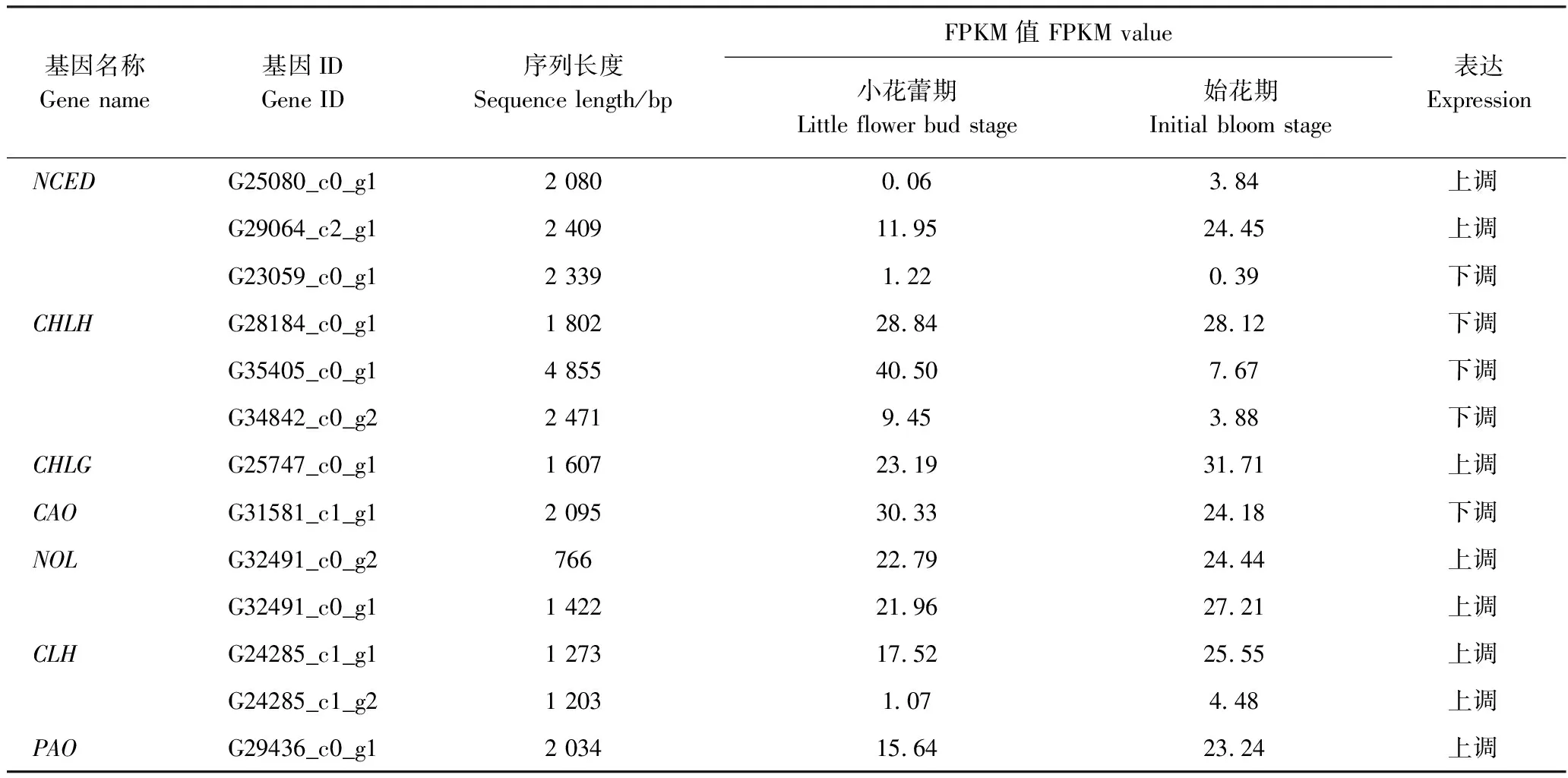
表3(续)
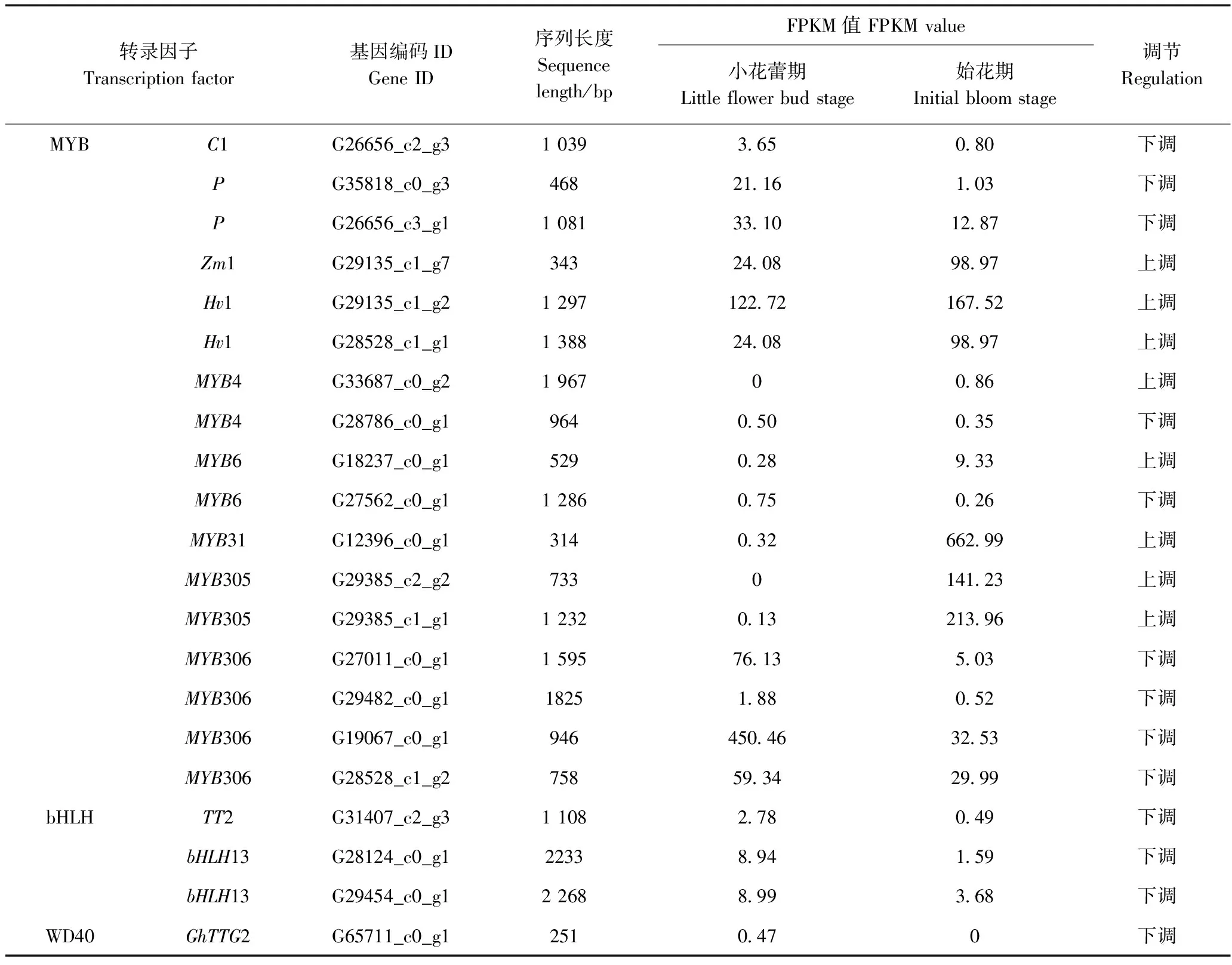
表4 花色相关转录因子差异表达Table 4 Differential expression of transcription factors related flower color
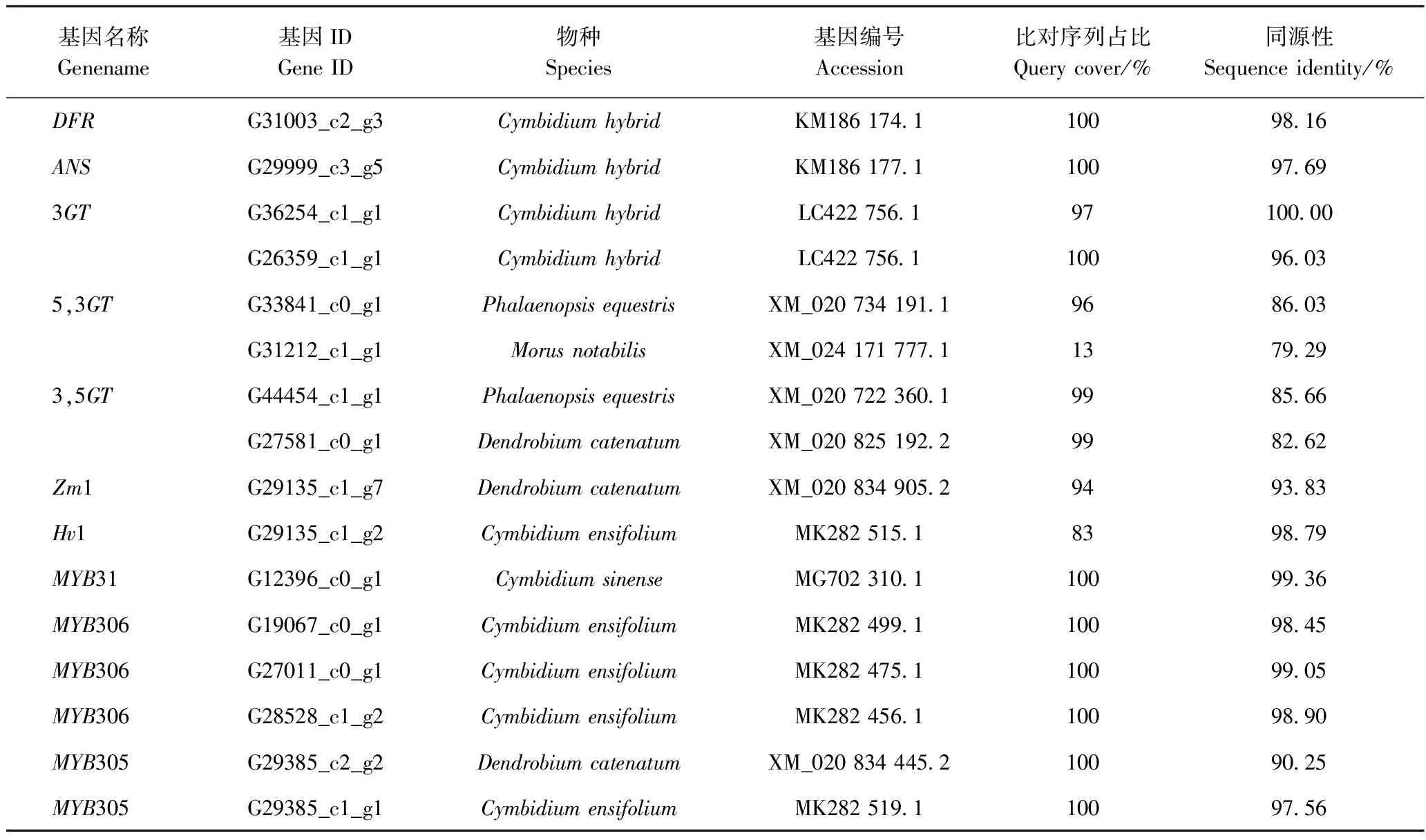
表5 部分花青苷合成关关键基因的最大同源性物种比对Table 5 The maximum identity of partial key genes of the synthesis of anthocyanins among species
2.6 部分差异结构基因转录模式验证
对测序材料转录组中类黄酮、类胡萝卜素代谢途径的部分结构基因进行qPCR验证,结果显示所选基因qPCR结果与转录组测序表达结果的变化趋势一致,说明转录组测序结果的可信度较高;基因PAL(Unigene ID:G34234_c1_g1)、CHS(Unigene ID:G25338_c1_g1)、F3H(Unigene ID:G34942_c5_g1)、FLS(Unigene ID:G33942_c5_g2)、DFR(Unigene ID:G31003_c2_g3)在小花蕾期和始花期表达量均较高,其中PAL(Unigene ID:G34234_c1_g1)基因在小花蕾期表达量最高,DFR(Unigene ID:G31003_c2_g3)基因在始花期表达量最高;类胡萝卜素合成途径的关键结构基因表达量整体明显低于类黄酮合成途径的关键结构基因表达量(图3)。
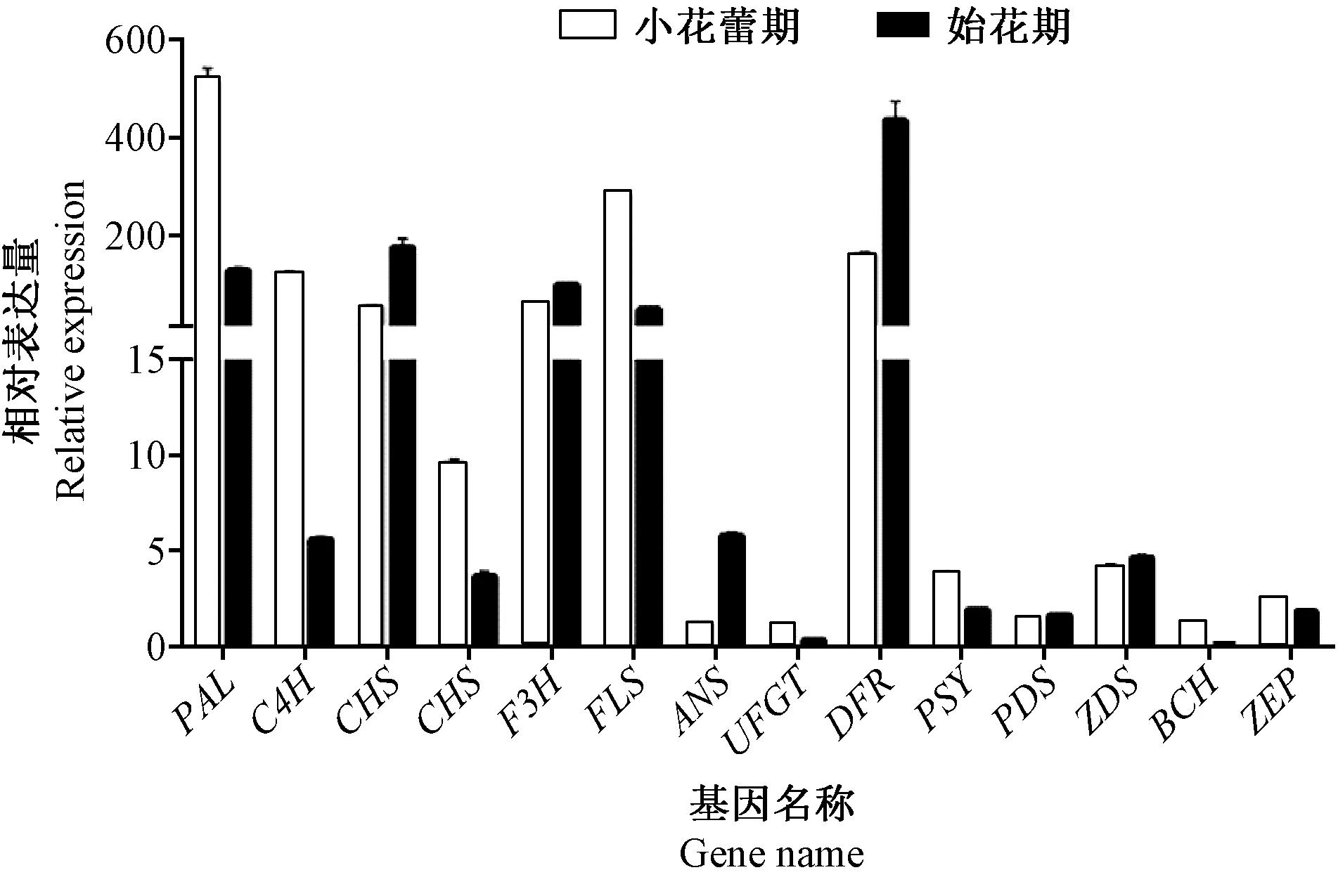
图3 花瓣转录组基因相对表达量的qPCR验证Fig.3 qPCR verification of gene relative expression in petal transcription group
2.7 花瓣色素的检测
对试验材料不同发育期花瓣的色素含量进行检测,结果显示(表6)小花蕾期花瓣花青苷未检出,始花期总花青苷含量为0.247 9 mg·g-1FW;不同花发育期各花色素含量均有极显著差异;总黄酮的含量均高于类胡萝卜素、叶绿素及总花青苷含量;与小花蕾期花瓣比较,始花期花瓣中类胡萝卜素、叶绿素及总黄酮含量均降低,仅总花青素苷含量升高。
3 讨论
本研究对2个不同发育期的黄金梅花瓣进行转录组测序,2个样品Mapped Reads在Clean Reads中所占比例分别为86.83%(A)、88.29%(B);质量值Q20和Q30均大于90%,GC含量均大于47.5%,可见测序数据质量较高。测序共获得113 780条Unigene,组装的Transcript与Unigene平均长度为725.64 bp和586.53 bp,N50分别为1 229 bp和882 bp。李文建等[9]对同株建兰黄绿色和红色花瓣转录组测序获得106 479条Unigenes,200~300 bp的Unigene比例最高;Transcript与Unigenes的平均长度分别为1 150.14 bp和655.25 bp,N50分别为2 127 bp和1 087 bp,以上测序数据与本研究有一定差异,但GO功能富集分析中各类差异基因占比与本研究结果有一定趋同性。
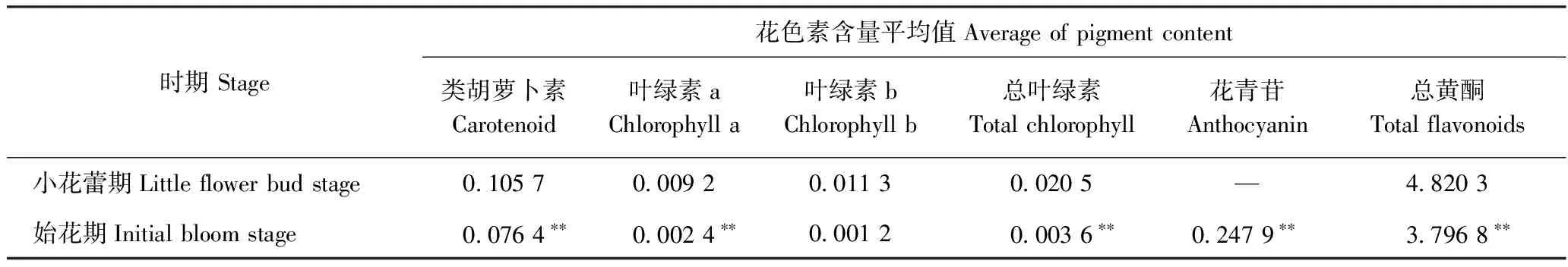
表6 不同花发育期花瓣色素含量Table 6 The content of flower pigment in different flower development stages /(mg·g-1 FW)
花青苷与原花色素、黄酮醇等类黄酮物质共享底物及上游代谢路径,CHS、CHI、F3H、DFR、ANS、FLS、GT基因是类黄酮合成代谢途径的关键结构基因。本试验测序数据中除ANS基因,其他关键酶基因的表达量均较高,推测ANS基因表达量较低是花瓣中花青苷含量大幅低于总黄酮含量的主要原因之一;糖基转移酶是生成花色苷的关键酶[29],本试验筛出多个花青素单糖基转移酶(3GT)及双糖基转移酶(3,5GT)基因,特别是矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷转移酶基因(3,5GT)在始花期花瓣中表达量上调明显。Huai等[30]研究也认为类黄酮糖基转移酶在开花后期表达强度与花色素合成呈正相关,推测黄金梅始花期花瓣为紫红色,3,5GT酶基因起到了关键作用。本试验测序数据中PSY、PDS、ZDS、BCH、ZEP、CCD7、CRTISO、NCED类胡萝卜素合成代谢途径的关键结构基因,除ZDS和CCD7表达量较高外整体表达量较低,CCD7为胡萝卜素裂解酶,其高表达能导致类胡萝卜素含量降低,始花期样品中类胡萝卜素含量较花青苷含量低,推测是花瓣表观呈紫红色的原因。自然界中绿色花较少,但国兰特别是春兰、蕙兰以绿花为主,试验材料黄金梅母本春兰也为绿花。而叶绿素是绿色花的基础,本试验测序数据中CHLH、CHLG、CAO基因为叶绿素a(chlorophyll a)和叶绿素b(chlorophyll b)的合成酶基因,NOL、CLH、PAO基因为叶绿素降解酶基因,从转录组表达量结果来看,叶绿素合成基因仅CHLG表达量上调,而叶绿素降解酶基因均上调,推测从小蕾期到始花期花瓣叶绿素合成减缓、代谢增强,因此始花期叶绿素含量明显降低。
本研究通过基因注释筛选出了与C1、P、Zm1、MYB4、MYB6、TT2、bHLH13等转录因子序列,已有研究表明这些转录因子与花青苷的合成紧密相关[31-38],C1、P、Zm1是玉米中与花青苷合成相关的转录因子,本研究中Zm1转录因子表达量较高;此外,与花色素合成代谢有关的Hv1、MYB31、MYB305转录因子表达量较高,且在始花期上调,张春玲等[39]认为万寿菊中Hv1与番茄红素β-环化酶基因,即类胡萝卜素的代谢机制与叶黄素含量的调控有关,Fornalé等[40]研究认为玉米中MYB31参与了类苯丙烷基因的调控;Liu等[41]和Wang等[29]认为MYB305调节类黄酮代谢基因的表达;本试验测序数据中MYB306转录因子表达水平较高,且在始花期下调,有研究指出,MYB306 的表达参与调控花青苷、总黄酮、酚类物质合成等生理代谢[42-44],相关转录因子的调控功能将在后续研究进行重点验证。
本研究材料黄金梅的母本为绿花品种大宋梅,父本为黄花品种黄金虎,杂交后代黄金梅花瓣显紫红色,分析其花青苷合成的下游关键结构基因和部分转录因子,BLAST分析发现与DFR、ANS、3GT基因同源性最高的物种均为大花蕙兰,推测基因与父本同源性高;与花青苷双糖基转移酶基因(5,3GT、3,5GT)同源性最高的为蝴蝶兰或石斛兰,与转录因子MYB31同源性最高的为墨兰,Hv1、MYB305、MYB306同源性最高的均为建兰,推测部分基因与母本同源性高;黄金梅显色的原因是否为父母花青苷结构基因和调控基因的互补或重组,可进一步通过春兰全基因组测序结果作验证。
4 结论
本研究通对黄金梅不同发育期花瓣转录组测序及数据分析,获得44 088个Unigene注释信息;ANS和GT基因的表达在花青苷合成代谢中起到了关键调控作用;红花的呈色主要由花青苷决定,与黄金梅DFR、ANS、3GT基因同源性最高的物种均为大花蕙兰,与花青苷双糖基转移酶基因(5,3GT、3,5GT)同源性最高的为蝴蝶兰或石斛兰,与转录因子MYB31同源性最高的为墨兰,与Hv1、MYB305、MYB306同源性最高的均为建兰。本研究为下一步花色基因的克隆、功能分析及分子调控机理的解析提供了一定参考。

