水母胶原蛋白的提取及性能研究
仇雷雷,王 博,邹帅军,王倩倩,张黎明 (海军军医大学海军特色医学中心海洋生物医药与极地医学研究室,上海200433)
0 引言
胶原蛋白主要存在于动物皮肤、骨骼和结缔组织中,是主要的结构蛋白质。胶原蛋白具有较低的免疫原性、较好的生物相容性、良好的生物降解性等生物学优点,广泛应用于生物制药、医疗保健、组织工程、食品加工、美容化妆品等领域。目前胶原蛋白主要来源于陆生牲畜(牛、羊和猪等),但某些疾病(口蹄疫、疯牛病)以及宗教相关问题,使得这些牲畜来源的胶原蛋白应用受到一定约束[1]。海洋来源的胶原蛋白资源丰富,且不存在传染性病菌和伦理等问题,因而,对海洋生物来源的胶原蛋白进行开发利用具有良好的应用前景[2]。
目前,从海洋生物提取胶原蛋白的研究主要集中在鳕鱼、罗非鱼、海参以及水母等,这些海洋生物的皮肤、肌肉、软骨组织及中胶层等部位中含有丰富的胶原蛋白[3]。水母是一类胶质状的浮游生物,属刺胞动物门,种类多,分布广,我国近海海域水母资源丰富。大型水母伞部直径可达2 m,中胶层非常厚实,其中胶原蛋白(122.64~693.92 mg/g,干重)约占总蛋白含量的50%[4]。本研究选用青岛海域采集的越前水母(Nemopilema nomurai),对其伞部胶原蛋白进行分离纯化和表征,为水母胶原蛋白的开发应用提供理论基础。
1 材料与仪器
1.1 仪器
SCIENTZ-12N 冷冻干燥机(宁波新芝生物科技股份有限公司);LA8080 氨基酸自动分析仪(日本株式会社日立高新技术科学);Nicolet iS50 傅里叶变换红外光谱仪(美国Thermo Scientific 公司);X′Pert3 Powder X 射线衍射仪(荷兰帕纳科公司);VARIOSKAN LUX 多功能酶标仪(美国Thermo Scientific 公 司);Mini-PROTEAN Tetra System 垂直电泳系统(美国BIO-RAD 公司)。
1.2 试剂
越前水母样品采集于青岛海域,腌制后于-20 ℃保存;牛I 型胶原蛋白标准品(河北考力森公司);胃蛋白酶(上海生工生物工程公司);标准蛋白Marker(日本TaKaRa 公司);其余试剂均为国产分析纯。
2 实验方法
2.1 胶原蛋白的提取与纯化
提取:经腌制的水母样品用自来水清洗,去除表面盐分,4 ℃下用去离子水浸泡、洗净后,再用异丙醇去除脂肪、NaOH 去除杂蛋白、过氧化氢去除色素。称取去杂水母伞盖样品,组织匀浆后加入相应体积不同浓度(0.3~0.6 mol/L)的乙酸溶液,胃蛋白酶的添加量为水母伞盖质量的0.1%~0.5%,酶消化时间为24~96 h,反应后的液体使用200 目网过滤,离心(4 ℃,10 000 r/min)30 min 取上清即得粗提液。
纯化:①超滤:分别取粗提液5 ml 至分子量10 万和 5 万的超滤管中,4 ℃ 离心(4 000 r/min,30 min),收集滤液进行SDS-PAGE 分析。②透析:分别取粗提液5 ml 到分子量5 万和10 万的透析袋中,4 ℃透析3 d,每8 h 换一次透析液,取样进行电泳分析。③盐析:取粗提液5 ml,添加NaCl 至浓度为 0.9 mol/L,4 ℃ 下 10 000 r/min 离心 10 min,收集沉淀,复溶于0.5 mol/L 乙酸溶液,重复上述过程2 次,取溶液进行电泳分析。仅改变NaCl 浓度(0.9 mol/L→0.9 mol/L→2.0 mol/L 或 2.0 mol/L→0.9 mol/L→0.9 mol/L),重复实验。
粗提液纯化后,在-80 ℃冷冻干燥得水母酶溶性胶原蛋白(PSC)。
2.2 单因素分析和正交实验设计
以水母胶原蛋白得率(冻干胶原蛋白质量/水母干重)为指标,确定基本反应条件(乙酸浓度、料液比、胃蛋白酶用量、提取时间),每次改变其中一个条件进行水母胶原蛋白提取的单因素实验。
获得单因素数据后,设计正交实验(表1)来获取最佳的实验方案。

表1 水母胶原蛋白提取正交实验因素水平表
2.3 天狼星红法测定胶原蛋白浓度
参照Coentro 等[5]的方法检测胶原蛋白浓度,将100 μl 胶原蛋白溶液添加至1 ml 天狼星红色染料中静置30 min,然后以12 000 r/min 离心30 min。去除上清,沉淀用碱性试剂溶解30 min,取200 μl胶原蛋白液于540 nm 处读数。
2.4 X 射线衍射
用X 射线衍射仪分析胶原蛋白样品的晶体结构,X 射线源为 Cu 靶 Ka 辐射(λ=0.154 nm),电流为 40 mA,电压为 40 kV。扫描角度 2θ 为 5°~40°,扫描速率为 3.6°/min,并根据公式 λ=2d sinθ,计算d 值。
2.5 紫外光谱分析
胶原蛋白溶解于0.5 mol/L 乙酸中,用多功能酶标仪检测其紫外光谱。扫描波段为200~400 nm,波长间隔为1 nm。以0.5 mol/L 乙酸溶液作为空白对照。
2.6 傅里叶变换红外光谱分析
取胶原蛋白5 mg 和适量KBr 置于研钵中,研磨均匀。取适量的混合样品于压片磨具中,用压片机制成试样薄片。将压片放入傅里叶变换红外光谱仪内进行扫描(500~4 000 cm-1,分辨率 2 cm-1)。
2.7 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)
胶原蛋白溶液和上样缓冲液混匀后水浴(100 ℃)加热 5 min,取 15 μl 上样,使用 8% 的分离胶和5%的浓缩胶,80 V 电泳100 min。
2.8 氨基酸组成分析
胶原蛋白样品在110 ℃下盐酸水解24 h,水解产物12 000 r/min 离心20 min,上清液用氨基酸自动分析仪进行氨基酸含量测定。
本文采用MIDAS-GTSNX岩土有限元软件来模拟双排水盲沟的渗流计算。一般计算模型如图2所示。计算时,在模型两侧以及排水盲沟处设置给定水头边界;在模型底面、顶面,以及排水盲沟上的开挖面设置给定流量边界,流量为0,即为隔水边界。
2.9 胶原蛋白的溶解性
将胶原蛋白样品溶于0.5 mol/L 乙酸溶液中,配成1 mg/ml 的胶原蛋白溶液,分别取10 ml 溶液调配成不同 pH 值(3~9 共 7 个梯度)和 NaCl 浓度(0.5、0.6、0.7、0.8、0.9、1.0、1.1 mol/L),10 000 r/min离心,取上清液进行胶原蛋白浓度测定,并绘制变化曲线。
2.10 数据处理
3 结果与分析
3.1 胶原蛋白提取的单因素结果
从图1A 可见,当酶的用量从0.1%升到0.3%时,胶原蛋白得率逐渐增高并达到最大值。继续增加酶使用量,胶原蛋白得率反而减少,可能是过量酶对胶原蛋白具有一定破坏作用。从图1B 可见,当乙酸浓度为0.4 mol/L 时,胶原蛋白的得率最高。而乙酸过量,会破坏已生成胶原蛋白。从图1C可见,料液比在1∶2 g/ml 时,水母胶原蛋白的得率最大。可能是料液比低于1∶2 g/ml 时,胶原溶胀不充分,而料液比继续增加并没有多余胶原以供溶胀。从图1D 可见,随着时间推移,胶原蛋白的得率先升高再下降:48 h 和24 h 相比,增加了8.8%;72 h和 48 h 相比,增加了 15.9%;96 h 和 72 h 相比,得率反而下降,说明72 h 是胶原蛋白提取的最佳时间点。
3.2 胶原蛋白提取的正交实验
表 2 正交实验极差 R 分析中,RA>RD>RC>RB,即在胶原蛋白提取中,酶的使用量起着最关键的作用,提取时间排第二,料液比和乙酸浓度的影响比较小。综合这9 组数据,确定最优理论水平为A3B2C2D3,即乙酸(0.4 mol/L)、料液比(1∶2 g/ml)、胃蛋白酶(0.3%),提取 72 h,此时的得率为(33±0.63)%。
3.3 胶原蛋白的纯化
图2 中水母胶原蛋白粗提物(泳道8)在分子量13 万处含有大量的目标胶原蛋白,分子量10 万以下有杂条带。不同规格透析袋处理(泳道1、2)后,分子量10 万以下的杂蛋白部分去除;盐析结果显示,0.9 mol/L→0.9 mol/L→2.0 mol/L NaCl 的盐析(泳道4)可以去除大量杂蛋白,但目标蛋白损失较多,而 0.9 mol/L→0.9 mol/L→0.9 mol/L NaCl(泳道3)处理既可以保留目标蛋白又能够去除部分杂蛋白。最后超滤结果显示,分子量10 万(泳道6)的超滤管可以明显减少杂蛋白含量。
3.4 SDS-PAGE 电泳分析
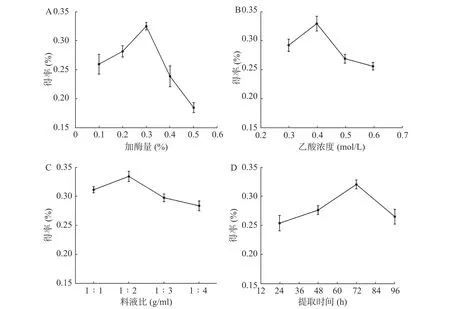
图1 水母胶原蛋白提取的单因素分析

表2 水母胶原蛋白提取正交实验结果
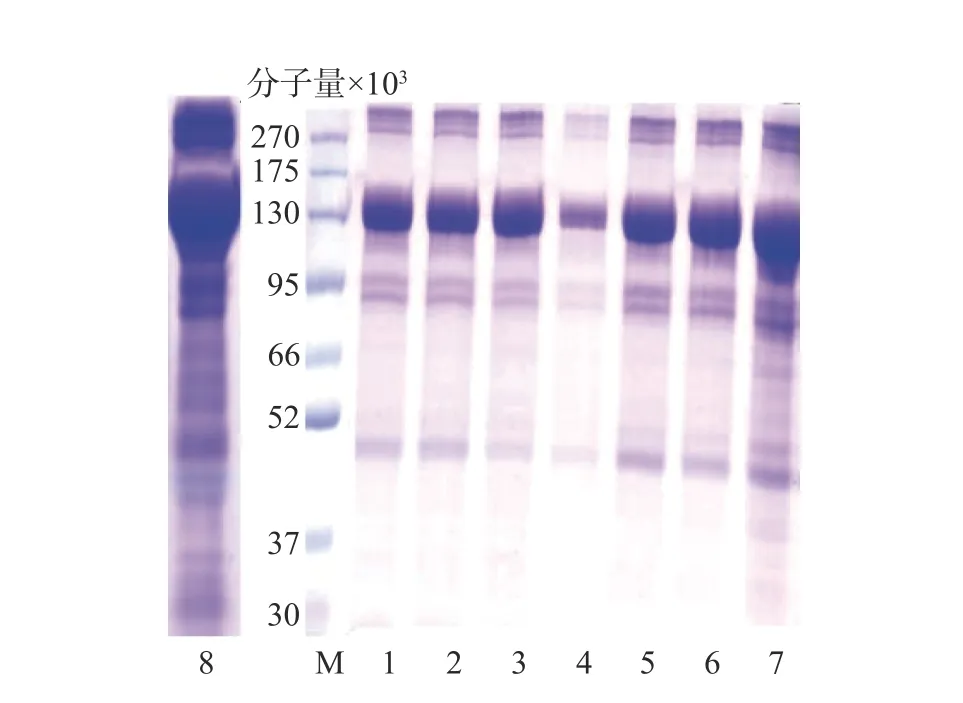
图2 水母胶原蛋白纯化过程 SDS-PAGE 电泳图
纯化实验结果提示,单一纯化方法不能完全去除杂蛋白,传统透析处理耗时长,而反复盐析会增加胶原蛋白溶液NaCl 含量。综合权衡后确定纯化条件为0.9 mol/L→0.9 mol/L→0.9 mol/L NaCl 盐析和100 kDa 超滤组合。图3 是组合纯化后胶原蛋白电泳图:泳道b 为牛I 型胶原蛋白标准品,在分子量 13 万左右有 α1、α2链,而 β 链 γ 链的分子量都在20 万以上。本实验提取的水母胶原蛋白(泳道a),分子量10 万下基本没有杂蛋白,但α 链只发现了一条,其分子可能是(α1)3[6-7],分子量在13 万左右,符合I 型胶原蛋白的特征。
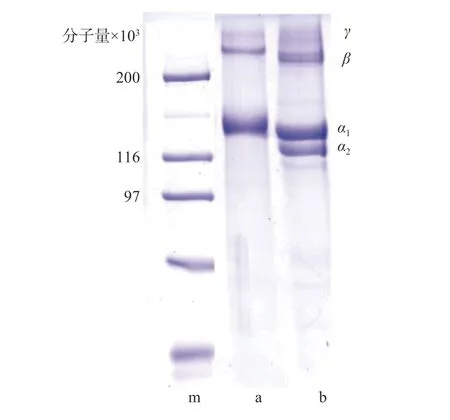
图3 纯化后水母胶原蛋白 SDS-PAGE 电泳图
3.5 胶原蛋白的X 射线衍射图
胶原蛋白X 射线衍射分析结果如图4、表3 所示。水母胶原蛋白和牛胶原蛋白都有3 个衍射峰。峰1 形状尖锐与胶原蛋白三螺旋结构有关,d 值反映胶原蛋白分子链间距离[8],水母和牛胶原蛋白的d1值分别为 1.244 nm 和 1.226 nm。在20°附近出现一个宽大峰(峰2),代表胶原蛋白纤维内部众多结构层次所引起的漫散射[9]。在30°附近出现了第3 个峰(峰3),该峰较小,其d 值显示三股螺旋结构中沿螺旋中心轴相邻氨基酸残基之间的距离[10],水母和牛胶原蛋白峰3 的d3值分别为0.295 nm 和0.296 nm,极为接近。说明水母胶原蛋白和牛胶原蛋白标准品一样,保持了完整的三股螺旋结构。
3.6 胶原蛋白的紫外吸收光谱
蛋白通常含有芳香族氨基酸酪氨酸、色氨酸和苯丙氨酸,这些氨基酸含有苯环共轭双键系统,在特定波长(280 nm 和251 nm)处有最大吸收峰。但在胶原蛋白中这些氨基酸含量少,其紫外吸收峰主要集中在220~230 nm,主要是由羰基C=O 的n→π跃迁所致。水母胶原蛋白的紫外光谱如图5 所示,其最强吸收峰在220 nm 处,与牛胶原蛋白吸收峰出现的位置类似,接近Ab Aziz 等[11]报道的水母Rhopilema hispidum 胶原蛋白紫外吸收峰(218 nm),提示本实验中提取的水母胶原蛋白纯度较高。
3.7 胶原蛋白的傅里叶变换红外光谱
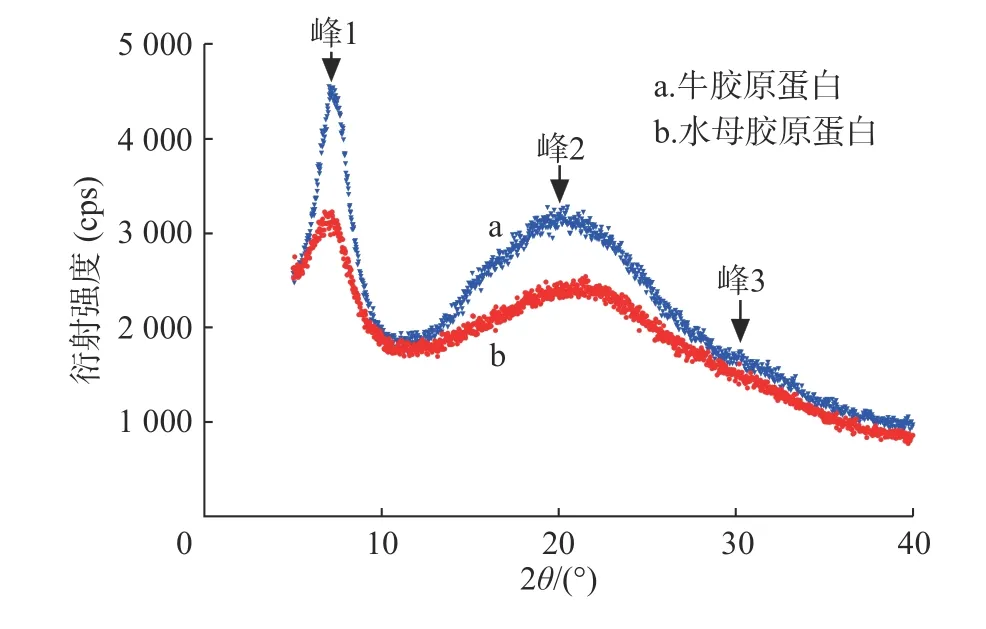
图4 胶原蛋白的 X 射线衍射图谱
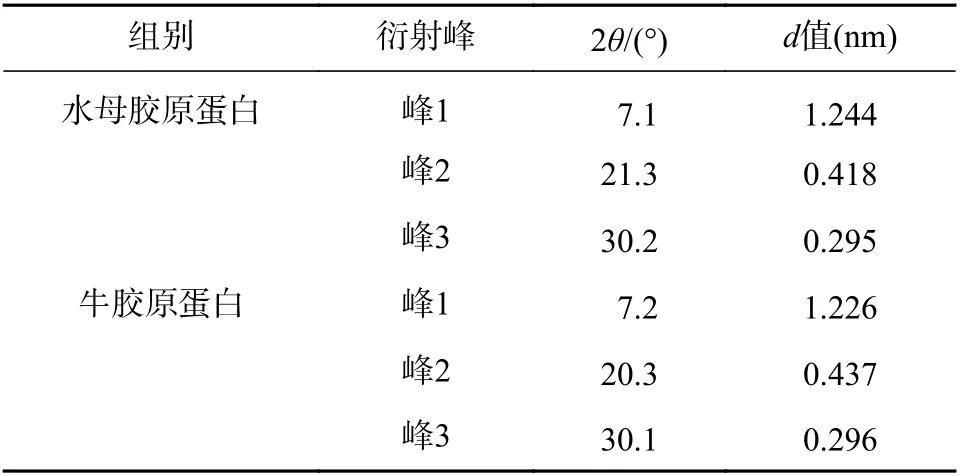
表3 胶原蛋白 X 射线衍射峰对应的 d 值
从图6 可见,水母胶原蛋白酰胺A 吸收峰为3 288 cm-1,和 Rastian 等[12]检测的酰胺 A(3 292 cm-1)吸收峰接近,表明氢键存在于胶原蛋白结构中。胶原蛋白分子中CH2基团的不对称伸缩振动产生了酰胺B 特征吸收峰[13-14],水母胶原蛋白的酰胺B 在2 933 cm-1处,和牛胶原蛋白的酰胺 B(2 936 cm-1)吸收峰类似。作为蛋白质二级结构变化的特征区域——酰胺Ⅰ带(1 625~1 690 cm-1),是由蛋白质肽链骨架的C=O 伸缩振动产生[15],水母胶原蛋白的酰胺I 带出现在1 641 cm-1。水母胶原蛋白酰胺II 带吸收峰出现在1 543 cm-1,在胶原蛋白酰胺II 带(1 500~1 600 cm-1)的范围内,可能是 C—N 键的伸缩振动和N—H 弯曲振动产生。水母胶原蛋白酰胺Ш位于1 236 cm-1处,主要是脯氨酸侧链和甘氨酸骨架的—CH2摇摆振动产生,提示所提取的水母胶原蛋白三螺旋结构完整性较好。

图6 胶原蛋白的红外光谱

图5 胶原蛋白紫外光谱
3.8 天狼星红法检测胶原蛋白
电泳图谱表明提取的水母胶原蛋白达到电泳纯(95%)。文献报道[16-18]天狼星红染料与胶原蛋白中的特征性结构Gly-X-Y 结合,可以使用天狼星红染料对胶原蛋白进行快速检测。本实验测得每100 mg 冻干的水母胶原蛋白样品中含有胶原蛋白96.85 mg,其纯度为96.85%。
3.9 氨基酸组成分析
如表4 所示,水母胶原蛋白的氨基酸组成中,甘氨酸占34.8%,与云南深水鲷鱼皮胶原蛋白甘氨酸含量(35%)接近,比热带淡水鲤鱼鳞中胶原蛋白甘氨酸含量(30.6%)高[19]。水母的胶原蛋白中羟脯氨酸占6.3%,脯氨酸占8.2%,亚氨酸比例为14.5%。其脯氨酸羟基化度(羟脯氨酸含量/亚氨酸含量)为43.68%,比牛胶原蛋白标准品的羟基化度(39.92%)和Zhang 等[7]提取的水母胶原蛋白的羟基化度(32.2%)都高。据文献报道[20],羟基化度越高,胶原蛋白的三螺旋结构越稳定。检测结果中还发现蛋氨酸、酪氨酸和组氨酸的含量比较低,缺乏色氨酸,这些都符合I 型胶原蛋白的特点[21]。
3.10 胶原蛋白的溶解性
从图7A 可见,当NaCl 浓度在0.5~0.8 mol/L时,水母胶原蛋白相对溶解度比较稳定,保持着最大值。其原因可能是低浓度的盐离子可以与胶原蛋白分子结合,使得胶原蛋白分子带有更多的电荷,相互排斥,溶解度较大。当NaCl 浓度达到0.9 mol/L时,水母胶原蛋白的溶解度急剧下降,相对溶解度不到23%,当NaCl 浓度超过1.0 mol/L 后,其相对溶解度在15%左右。可能因为NaCl 的浓度较高时,极性较强的盐离子夺走了胶原蛋白结合的水分子,破坏了其周围的水化膜,盐析作用显现出来,溶解度下降。

表4 二种胶原蛋白中不同氨基酸组分的百分比
从图7B 可见,当溶液的pH 在3~5 时,水母胶原蛋白的相对溶解度比较大,维持在80%左右。其中pH 为4 时,溶解度最大,与海参胶原蛋白的溶解性类似[3]。当pH 在6~8 时,胶原蛋白的相对溶解度维持在较低值,尤以pH 7 时溶解度最小,此时就是胶原蛋白的等电点。当pH 超过8 后,胶原蛋白溶液的溶解度又有所上升。
4 讨论
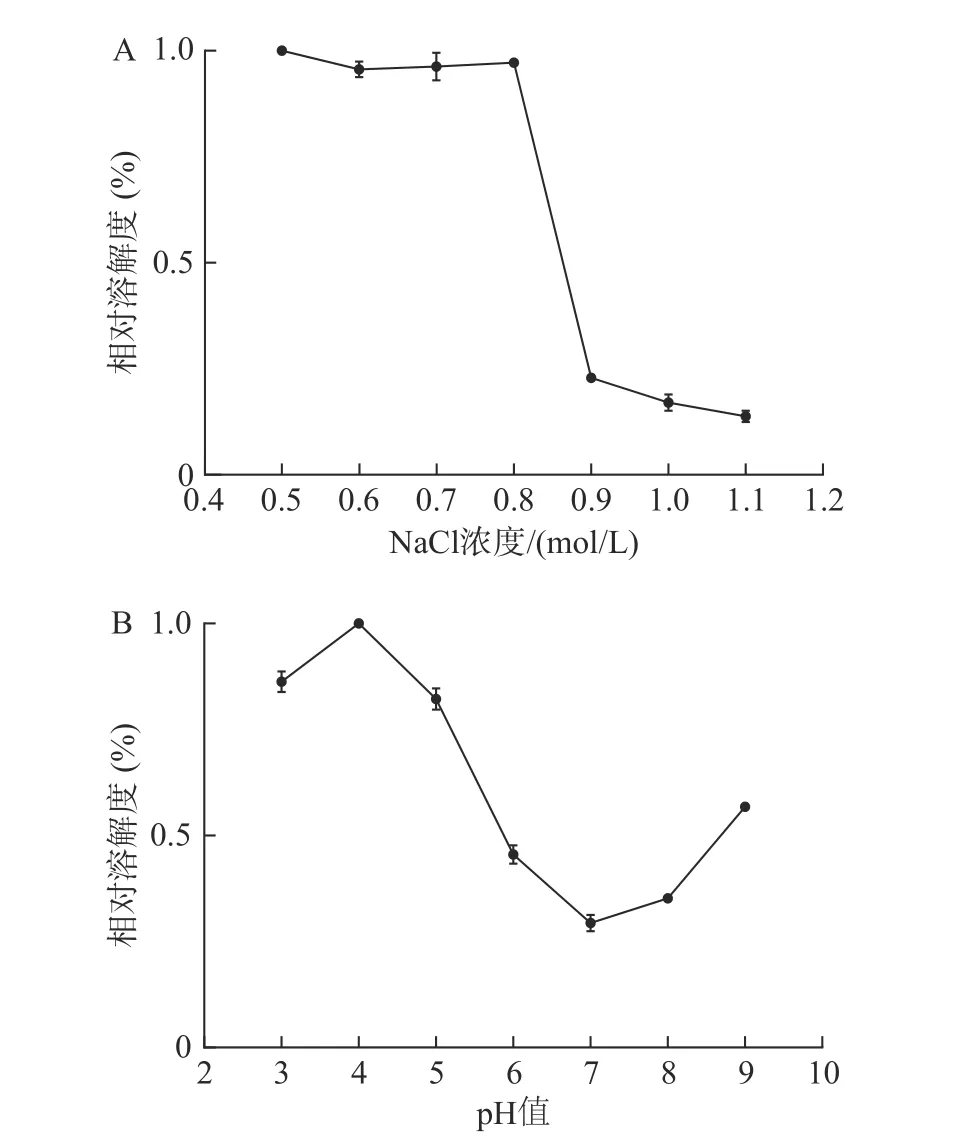
图7 水母胶原蛋白在不同 pH 值及NaCl 浓度条件下溶解度特性
本实验通过单因素分析和正交实验优化了水母胶原蛋白的提取条件,确定最适条件为:乙酸0.4 mol/L、料液比1∶2 g/mL、胃蛋白酶0.3%、反应72 h。水母胶原蛋白的纯化方法优化为0.9 mol/L-0.9 mol/L-0.9 mol/L NaCl 盐析和分子量10 万超滤的组合方法。相比阳离子交换层析法和Sephacryl S-100 凝胶过滤纯化方法,超滤不仅可以去除盐分和杂蛋白,还能快速富集胶原蛋白,缩短提取时间。
纯化的水母胶原蛋白通过天狼星红法检测其纯度为97%,高于从其他多种海洋生物提取的I 型胶原蛋白纯度[22-23]。本实验中越前水母胶原蛋白干重得率为33% 左右,相比于水母Chrysaora quinquecirrha 胶原蛋白提取得率(1.2%干重)显著提高[24]。凝胶电泳显示提取的水母胶原蛋白构型可能是 (α1)3,α1链分子量约为 13 万和 10 万以下基本没有杂条带,比Jankangram 等[25]提取的水母胶原蛋白纯度更高。在氨基酸组成分析中,越前水母胶原蛋白甘氨酸占34.82%,羟脯氨酸占6.33%,脯氨酸占8.16%,没有检测到色氨酸。以上结果均表明水母胶原蛋白符合I 型胶原蛋白的特点。光谱分析发现,分离纯化过程中水母胶原蛋白三螺旋结构保存较好。溶解度试验表明其在pH=4 时溶解性最佳,当NaCl 浓度升高至0.9 mol/L 时溶解度快速下降。
总之,本研究通过优化提取纯化过程,缩短了水母胶原蛋白制备时间,提高了所得胶原蛋白的纯度,且水母胶原蛋白三螺旋结构保持完整,与牛I 型胶原蛋白特征相似度很高,提示水母胶原蛋白可望成为哺乳动物胶原蛋白的替代品。鉴于水母胶原蛋白具有资源丰富、提取方便、生物相容性好等优点,可望成为生物医药、食品、化妆品等多领域的理想生物材料,具有良好的应用前景。

