去势小鼠血清和脑组织中抑制素B的含量及分布变化
辛玲,赵海豹,周越,侯丽
(国家卫生健康委科学技术研究所,北京 100081)
哺乳动物的性腺细胞是抑制素B(Inhibin B,INH-B)分泌产生的主要来源,其分子包含α和β(B型)两个亚单位,通过二硫键结合成αβB形式[1]。动物体内存在INH-B的多种亚基形式,但只有两者结合在一起才有生物活性,其含量变化随年龄有一定的起伏。我们前期研究发现,INH-B在小鼠睾丸和脑组织中均含量丰富,尤其睾丸中的INH-B水平与小鼠周龄有一定的相关性,并且α、βB两个亚基抗体识别蛋白条带在不同周龄不同组织中的分布存在差异[2],激发我们对脑组织中亚基来源及变化的研究兴趣。本研究通过分析去势小鼠与正常对照小鼠的血清和脑组织匀浆上清中INH-B水平变化以及脑组织中INH-B亚基定位分布差异,进一步了解INH-B分子的分泌来源,为生殖性腺轴中的INH-B分子调控提供实验基础。
材料和方法
一、实验材料
1.实验动物:4周龄SPF级雄性C57BL/6小鼠24只,其中去势小鼠(睾丸切除)12只,正常小鼠12只,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2016-0006)。小鼠在可控的条件下给与充足的水和食物,自由进食,光照时间8:00~20:00,温度为24℃±1℃。本研究获得国家卫生健康委科学技术研究所动物伦理委员会批准。
2.主要试剂:兔多克隆抗体Anti-inhibin beta B抗体(NBP2-16966,Novus,美国);兔单克隆抗体Anti-inhibin alpha抗体(ab216969,Abcam,英国);荧光(CY3)标记羊抗兔IgG(BA1032,武汉博士德生物);浓缩型正常山羊封闭血清(AR1009,武汉博士德生物);DAPI(C1002,碧云天);抗荧光淬灭封片剂(0100-01,Southernbiotech,美国);Inhibin B 定量检测试剂盒(ELISA法)(KR-INH B-001,广州康润科技)。
3.主要仪器:匀浆仪(IKAT25 digital ULTRA-TURRAX,美国),酶标仪(Wellscan MK 3,Thermo Fisher,美国),奥林巴斯BX53型生物显微镜(日本)。
二、实验方法
1.小鼠脑组织灌注及处理:两组小鼠分别在8周龄及12周龄时,通过腹腔注射10%水合氯醛(0.1 ml/只)麻醉状态下进行解剖处理。完全麻醉后,小鼠固定在解剖板上,打开胸腔暴露心脏,将连接生理盐水的输液器穿刺插入心尖搏动处,调整液体速度50滴/min,在心脏右心耳处用眼科剪剪一小口,并迅速收集流出的血液于1.5 ml的离心管中,置于冰上。待右心房流出的液体清亮且肝脏颜色变白时更换为4%多聚甲醛进行灌注,观察小鼠状态,尾部伸直变僵硬表明灌注成功,随即断颈后取出脑组织置于4%多聚甲醛保存液中进行固定。
2.脑组织蛋白提取及血液处理:仅经过上一步骤生理盐水灌注处理的小鼠,取出脑组织并称重,放于2 ml的离心管中,置于冰上。按重量∶体积=1 g∶1 ml的比例加入组织裂解液,在冰浴条件下经高速匀浆器进行组织匀浆,匀浆混合液12 000g离心15 min,吸取上清液,分装保存在-20℃中备用。收集的小鼠血液在4℃条件下 2 000g离心15 min,吸取上层血清保存在-20℃中备用。
3.小鼠血清及脑组织中INH-B蛋白含量测定:取25 μl的血清或者脑组织匀浆上清液加入酶标板中,参照Inhibin B ELISA试剂盒中的操作说明进行,显色后加入终止液,30 min内用酶标仪测定450 nm处的OD值,利用试剂盒中的A~F号标准品绘制标准浓度曲线计算样品中的INH-B蛋白浓度。
4.免疫荧光:脑组织常规石蜡包埋切片。切片脱蜡后加适量的0.01 mol/L枸橼酸缓冲液(pH 6.0)修复液采用微波进行抗原修复10~15 min,PBS 冲洗3次,每次3 min,滴加稀释好的山羊血清封闭30 min,甩去多余液体,滴加稀释好的一抗(1∶100稀释)于4℃湿盒中孵育过夜。PBST冲洗一抗孵育后的切片3次,每次3 min,吸水纸擦干切片后滴加稀释好的荧光二抗(1∶100稀释),湿盒中37℃孵育1 h,结束后PBST冲洗4次,每次3 min。滴加DAPI避光孵育5 min,对标本进行染核,PBST冲洗4次,每次3 min,洗去多余的DAPI,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察并进行切片的全景扫描,CaseViewer 2.0软件处理分析图像。
三、统计学处理
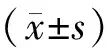
结 果
一、去势小鼠血清及脑组织中INH-B含量的变化
ELISA检测血清及脑组织匀浆上清中INH-B蛋白水平的实验发现,去势4周后小鼠血清中的INH-B水平急剧下降,在酶标仪读数时,去势小鼠血清孔读数接近空白对照,根据INH-B浓度标准曲线计算出各个样本中INH-B的浓度值,显示数值均已低于检测下限值(4 pg/ml)。统计软件计算后,去势组小鼠8周龄(去势4周)和12周龄(去势8周)血清中INH-B水平分别为(3.86±0.55) pg/ml和(3.58±0.71)pg/ml,远远低于对照组同周龄小鼠的(17.73±0.89) pg/ml和(17.18±0.90) pg/ml,差异均有统计学意义(P<0.01);但同组小鼠两个时间点血清INH-B水平比较,差异无统计学意义(P>0.05)(图1)。
与对照组比较,*P<0.01图1 小鼠去势后血清INH-B水平变化
去势组小鼠8周龄(去势4周)和12周龄(去势8周)脑组织匀浆上清中INH-B的浓度分别为(126.0±16.8)pg/ml和(121.0±15.7)pg/ml,而对照组同周龄水平分别为(1 374±69) pg/ml和(1 304±93)pg/ml,统计结果显示,小鼠去势后脑组织中INH-B水平显著下降(P<0.05),但没有出现血清INH-B水平接近检测下限的现象(图2)。

与对照组比较,*P<0.05图2 小鼠去势后脑组织INH-B水平变化
二、去势小鼠脑组织中INH-B亚基分布变化
通过免疫荧光分别对两组小鼠脑组织进行INH-B的α和βB亚基分布检测,结果显示两个亚基分子在脑组织中广泛分布,去势组脑组织中的整体荧光强度显著下降,与ELISA定量检测结果相一致,而在分布区域上没有明显不同(图3)。
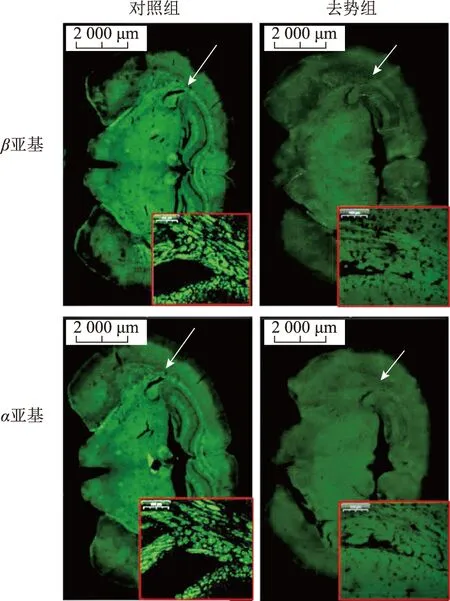
局部放大图为箭头指示区域图3 小鼠脑组织中INH-B亚基的免疫荧光结果图
讨 论
抑制素(INH)首次发现是在1932年,有INH-A和INH-B两种分子形式,最初以为是雄性动物睾丸产生的一种非甾体类激素,可调节促性腺激素的分泌,并于1985年以后陆续从猪卵泡液、牛卵巢滤泡液以及羊睾丸液中分离并得到鉴定[3]。INH-B是由α和βB亚基通过二硫键连接形成的异源二聚体分子,属于转化生长因子β(TGF-β)超家族成员,同家族相近的分子还有活化素(Activin,ACT)。ACT和INH在调节卵泡刺激素(FSH)分泌上具有相反的作用,ACT-INH-卵泡抑素系统在调节FSH-LH分泌上发挥重要作用,通过内分泌以及自分泌或者旁分泌形式参与到体内众多的生殖生理调控中,也是下丘脑-垂体-性腺轴调控机制研究的一个新热点[4-8]。
雄性性腺细胞是INH-B的产生来源,血液中INH-B的水平反映了睾丸功能[9]。动物实验显示,给去势大鼠皮下注射正常雄性精浆可以明显降低血中的FSH,而注射无精子症患者精浆后血中FSH水平无明显变化,表明INH-B的入血是通过细胞分泌到曲精小管管腔液中来实现的。INH-B的分泌调节主要受Sertoli cell影响[10]。性腺切除术后,体内血循环的INH水平会迅速下降。Scarlet等[11]对不同程度去势公牛血清中性腺激素水平变化的研究发现,对成年公牛进行不同形式的去势处理后,正常组公牛和阴囊部分切除组公牛血清中INH-A水平显著高于去势组(睾丸切除组及Burdizzo夹去势组),但在处理后的不同时间点上INH-A水平变化无显著性差异。本实验中,小鼠去势4周后,血清中INH-B水平急剧下降,下降至化验的最低检测阈值,显著低于同周龄正常组小鼠血清水平,但与去势8周小鼠血清INH-B水平无显著性差异,结果与前述研究报道一致。也证明了雄性动物血液循环中的INH-B主要来源于睾丸组织。
雄性动物的INH-B分泌入血后有广泛的组织分布,遍及整个生殖性腺轴[12-13]。我们前期的研究结果显示,在小鼠脑组织中INH-B含量丰富[2],而不同周龄段间的水平无显著性差异。关于INH-B转运入脑存在一个分子拆分再组装的机制假说[14],即以亚单位小分子状态转运至脑组织内后再在某些因子作用下组装成完整的二聚体形式。本研究中成年正常组小鼠脑组织中INH-B含量及变化情况均与以往研究一致,去势组小鼠脑组织中INH-B含量也是呈现显著性下降,表明脑组织中INH-B分子不能排除也来源于睾丸。另外去势小鼠脑组织中INH-B蛋白水平没有下降到接近于无的状态,可能还是与脑组织对INH-B有一定的富集、储存现象有关。
基于以往对INH-B来源及分泌的研究,我们初始推测雄性小鼠切除睾丸后,脑组织中INH-B的分布有显著变化。本实验免疫荧光结果显示,睾丸切除小鼠脑组织中α和βB亚基的分布与正常对照小鼠相比,荧光信号强度显著减弱,而区域分布并无明显不同,但α和βB亚基两者的信号强度不完全一致。免疫荧光实验中抗体是针对单个亚基的抗体,识别整个家族中的同一游离亚基以及亚基的前体等不同形式。研究报道显示,与INH功能相反的ACT,来源于性腺外的多种组织,如脑、肝脏、肾脏及胎盘等,在性腺器官切除后,其水平可保持不变或稍有下降[8]。INH-B与ACT-B有共同的βB亚基;有学者用免疫组化方法研究INH亚单位的免疫反应性时表明,各亚单位均有表达,分布于神经元细胞、神经纤维及神经核,α亚基的反应强度差[13,15],也在一定程度上解释了本实验中两个亚基免疫荧光的检测结果。ELISA实验检测具有活性的完整二聚体INH-B分子,检测时信号被放大,灵敏度要高于免疫荧光检测。另外本实验中出现α和βB亚基免疫荧光信号强度不一致的现象,除了基于INH-B亚基分子结构特性的缘故外,也可能与INH-B合成、组装、分泌及到达靶器官位置有关。整体而言,去势小鼠体内的INH-B可维持一个极低水平的状态,表明雄性小鼠INH-B主要来源于睾丸,也提示可能存在着睾丸外来源INH-B。
本实验在前期研究基础上,进一步了解INH-B分子的分泌来源,分析了去势小鼠与正常对照小鼠的INH-B血清和脑组织匀浆上清中水平差异以及脑组织中亚基定位分布变化,对小鼠脑组织中INH-B的来源及亚基变化进行了初步的研究探索。但本研究中对小鼠去势后观察检测时间点的设置上不够精细,观察时间间隔过长而总时间略短;另外在验证组织定位变化时忽略了同家族中相同亚基或者相似亚基的影响。因此睾丸去势对脑组织中INH-B的表达及分布的影响仍然需要深入研究,或许INH-B在脑组织中的特异抗体是一个研究切入点。

