重组人促红细胞生成素治疗新生儿缺氧缺血性脑病的效果分析
朱 萍 李德亮 张伟业
南阳市中心医院,河南 南阳 473000
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指在孕妇待产及分娩期间胎儿在母体内因脐带、羊水异常等各种原因造成宫内窘迫,进而导致缺血缺氧引起的脑部病变,也常见于出生后的窒息缺氧引起的脑损伤[1-3]。该病是新生儿科临床常见病,多见于足月儿,但也可出现于早产儿,是导致新生儿时期死亡的主要杀手和造成婴幼儿时期生长发育障碍的主要原因,严重影响新生儿的远期预后[4-6]。因此,早诊断、早治疗对患儿救治成功率和康复率具有重要意义。目前临床对新生儿HIE的诊断方法除根据具有明显的围生期窒息史且见于生后12 h或24 h内出现异常神经症状,如意识障碍、肌张力改变及原始反射异常等临床表征进行诊断外[7-9],影像学技术已经成为新生儿HIE诊断的常用方法,其更有利于临床有效揭示病理和及时掌握病程及治疗进展,如计算机断层扫描显像(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)等影像学技术。CT和MRI在诊断新生儿HIE时各有优缺点和侧重点,目前将CT与MRI联合诊断HIE的应用价值已经被医学界所重视,并得到多数临床医生的肯定,将两种方法联合应用可以弥补相互的不足,进一步提高诊断准确率[10-13]。新生儿HIE早期治疗方法主要有对症支持、高压氧及亚低温等。对症支持即“三支持、三对症”,是综合措施疗法,而高压氧与亚低温疗法在新生儿HIE治疗中有异曲同工之处,目的均在于促进有氧代谢或抑制异常代谢,以减少有害代谢产物,如儿茶酚胺等毒性物质损伤脑组织,通过保护血脑屏障以降低颅内压和减轻脑水肿,从而促进脑细胞及神经功能修复等[14-17]。
目前新生儿HIE尚缺乏有效对症治疗的药物,中国仓鼠卵巢细胞(Chinese hamsters ovary,CHO)系表达的重组人促红细胞生成素(recombinant human erythropoietine,rHu-EPO)被发现在人体或受试动物模型中具有调控造血的功能,即通过促进骨髓红系细胞的分化和增殖,从而使得造血功能和贫血症状得到恢复和改善,其在新生儿临床常见病治疗中早期被用来防治早产儿贫血,后来亦被证实其对HIE患儿神经有保护作用[18-22]。为观察rHu-EPO对新生儿HIE早期干预的效果和评价其对患儿神经生长发育的影响,南阳市中心医院结合实际接诊的病例情况在遵循一般治疗方案前提下采用rHu-EPO治疗新生儿HIE。
1 资料与方法
1.1一般资料选择2016-09—2018-08南阳市中心医院收治的HIE患儿,入选标准均遵循新生儿HIE的诊断标准[23]。(1)符合中度-重度HIE诊断及分型标准;(2)胎龄≥37周的足月儿;(3)入院时间<72 h;(4)出生时体质量≥2 500 g;(5)无严重心脑、气管及肺等先天性发育畸形;(6)无染色体及先天性代谢性疾病;(7)无大量颅内出血;(8)无严重感染及呼吸困难等疾病。选择符合上述条件的50例患儿随机分成对照组25例和试验组25例,2组患儿在性别、胎龄、体质量、HIE分度及分娩方式等方面差异无统计学意义(P>0.05)。
1.2治疗方法2组患儿在出生当日的治疗开始阶段根据新生儿HIE治疗指南方案进行对症支持的常规治疗,包括予以营养脑细胞药物和高压氧治疗等早期干预及康复治疗措施。试验组在上述常规治疗基础上的第3天予以rHu-EPO治疗,400 IU/kg,首次为皮下注射,后改为静脉注射,2天1次,每周3次,连续4周。
1.3疗效评价2组在出生后第7天、第14天及第28天分别进行新生儿行为神经测定(neonatal behaviral neurological assessment,NBNA),该评分涵盖了行为能力、主动肌张力、被动肌张力、原始反射及一般状况等5大列项20小分项内容,满分40分,以分值35划界评定归属正常或者异常,即评分≥35分为正常,评分<35分为异常[24]。患儿治疗3个月后返院复诊,根据中国婴幼儿智能发育量表(CDCC)对2组复诊患儿分别进行智能发育指数(MDI)和运动发育指数(PDI)的测定,即MDI和PDI评分均>90分为正常,70~90分属于边缘状态,<70分视为异常[25]。

2 结果
2.1rHu-EPO对HIE患儿的近期疗效分析经rHu-EPO治疗后,试验组3次的NBNA评分均明显高于对照组,差异有统计学意义(P<0.01)。见表1。
2.2rHu-EPO对HIE患儿生长发育的影响对照组MDI、PDI评分均低于试验组,差异有统计学意义(Z=17.286,P<0.05),根据复诊和随访未发现与rHu-EPO相关的不良反应,无短期危害和风险。见表2。
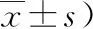
表1 2组疗程内3次NBNA评分比较 (分,

表2 2组治疗3个月后的智能测试评分比较 [n(%)]
3 讨论
新生儿HIE为临床中高发病症,其临床主要症状可表现为兴奋或迟钝、昏迷或惊厥、肌张力改变、意识障碍、神经反射异常等,是导致新生儿死亡的主要原因之一,调查显示约25%的存活患儿存在智力障碍、癫痫、脑瘫等神经系统后遗症[26-28]。新生儿HIE的发生与孕妇自身贫血、妊娠期高血压、糖尿病、心肺疾病、临产期羊水中度及重度污染、胎盘前置或早剥、胎儿脐带绕颈或过度扭转甚至打结以及产程异常等一系列围生因素密切相关,具有发病危急且机制复杂的特征,因此有效预防、及时诊断和积极治疗是关键[29-31]。新生儿HIE治疗方案至今仍未完整统一,现行均强调综合支持疗法,临床对围生期新生儿HIE亦缺乏特效对症的药物,近年来用于临床研究和早期干预性治疗的药物主要有神经节苷脂、纳洛酮、脑苷肌肽、地塞米松、苯巴比妥、神经生长因子、rHu-EPO、丹参及川芎注射液等,其中rHu-EPO应用于HIE治疗一直为医学界所关注[32]。促红细胞生成素(EPO)是一种具有生物活性的内源性糖蛋白激素,具有刺激和促进红细胞生成的作用,又称红细胞刺激因子、促红素,早已有外源性rHu-EPO用于临床中各种原因引起的贫血治疗。
随着近二十年来研究的不断深入,EPO的这种“非造血”作用已逐渐被阐明,同时基于脑损伤模型的研究表明EPO亦被证实具有神经营养及神经保护作用。研究发现人体神经系统的很多组织和细胞(如脊髓、神经元、神经胶质细胞、血管内皮细胞和海马细胞等)都存在EPO及EPOR受体的表达,同时这种内源性表达量可受缺氧刺激调控,亦可被低血糖、氧化应激所诱导。研究已证实静脉或腹腔注射EPO后脑脊液中EPO浓度明显升高,且与血浓度相关,表明EPO自身能通过血脑屏障,同时由于新生儿血脑屏障发育不完善,再加上血脑屏障受损,也导致其通透性增加,可见外源性rHu-EPO应用于临床治疗HIE具备了有效的通道条件。随着rHu-EPO逐渐应用于临床实践,其应用越来越广泛,尤其是rHu-EPO联合其他药物的疗法用于新生儿HIE及早产儿贫血治疗获得更为满意的疗效。EL-LAHONY等[33]采用rHu-EPO联合铁、维生素E和叶酸治疗早产儿贫血,表明rHu-EPO可促进红细胞生成,并显著减少患儿输血的需要。研究表明rHu-EPO与神经节苷脂联合用药可以明显改善HIE患儿的神经行为和中枢神经系统功能,具有良好的临床疗效,且安全性较高,基于rHu-EPO的神经保护作用采用这种联合用药疗法具有较高的临床应用价值。本研究也证实rHu-EPO对新生儿HIE具有显著疗效,经rHu-EPO治疗后试验组NBNA评分均明显高于对照组(P<0.01)。
EPO对HIE神经保护作用机制十分复杂,基于已有研究主要包括:(1)拮抗谷氨酸兴奋毒性作用;(2)通过抑制炎症相关因子生成而具有抗炎作用;(3)通过调控NO表现出抗氧化作用;(4)通过维持神经细胞生存表现出抗凋亡作用;(5)通过与血管内皮生长因子互作促进脑血管生成作用;(6)通过增加神经营养因子的生成起到神经重构作用;(7)通过促进少突胶质前体细胞的分化和成熟以减少白质损伤;(8)通过影响钙离子振动频率进而改变谷氨酸盐受体的传导来改善脑水肿。本研究中对照组MDI、PDI评分均低于试验组(P<0.05),说明rHu-EPO具有神经保护和恢复作用,由此可推测rHu-EPO应用于新生儿HIE的临床治疗将有助于患儿远期的生长发育,根据复诊和随访情况,本文所报告病例在治疗和观察期内均未发现与rHu-EPO相关的不良反应,无短期危害和风险。
本研究探讨了新生儿HIE应用rHu-EPO治疗的短期疗效,并预见了远期预后,表明rHu-EPO可有效减轻HIE患儿神经细胞损害,并促进神经功能恢复,改善认知障碍及行为异常,rHu-EPO对HIE患儿的生长发育有利无害。本次研究不足之处在于受样本量的限制本治疗方案仅进行了单一恒定剂量的短期给药治疗,而联合用药、纵向不同剂量给药、治疗周期及远期影响等方面还需进一步探索。

