长链非编码RNA调控心肌细胞肥大的研究进展
崔艺萌,陈 瑜,张 腾
心肌细胞肥大是心肌肥厚的主要病理学基础[1],是一种由心脏压力负荷过重或心肌损伤引起的代偿性或失代偿性病理改变[2],而心肌肥厚作为肥厚性心肌病、高血压心脏病和缺血性心脏病等心血管疾病的共同病理改变,已成为诱发心力衰竭的一个重要因素[3-4]。心肌细胞是心脏损伤的直接靶细胞,可能成为心脏疾病治疗的重要潜在靶点之一。相关研究显示,非编码RNA(non-coding RNAs,ncRNAs)在心肌细胞肥大过程中具有重要的调控作用[5],但调控心肌细胞肥大的相关机制需进一步研究。
ncRNAs是一类不编码蛋白质但具有重要生物学功能的RNA分子,覆盖98%以上的人类基因组[6]。根据ncRNAs长度分为微小RNA(microRNAs,miRNAs)、长链非编码RNA(long non-coding RNAs,lncRNAs)和环状RNA(circular RNAs,circRNAs)。近年来,关于心肌细胞肥大的研究越来越多,但相关分子调控机制尚未明确。现综述lncRNAs调控心肌细胞肥大的研究进展。
1 lncRNAs概述
lncRNAs是一种不具备编码蛋白质能力的内源性RNA分子,通常长度>200个核苷酸,多数情况下不编码蛋白质,是ncRNAs中广泛的亚群,通过转录前、转录及转录后水平和翻译水平在生理病理过程中发挥调控作用。过去的几十年,miRNAs结构和功能被广泛研究,而lncRNAs相较于miRNAs,具有较低的保守性,调控基因形式多样,导致人们对lncRNAs认识及研究受到较大的限制。
根据染色体与编码基因的相对位置将lncRNAs分为以下几类:反义型(antisense lncRNAs)、内含子型(intronic lncRNAs)、反向型(divergent lncRNAs)、基因间型(intergenic lncRNAs)、启动子上游型(promoter upstream lncRNAs)、启动子型(promoter-associated lncRNAs)、转录起始位点型(transcription start site-associated lncRNAs)[7-8]。根据分子作用机制将其分为4种类型[9]。①调控下游基因转录(signals):作为转录活性的分子信号或指示剂,lncRNAs表达可对相关基因进行空间和时间地调控。②分子阻断剂(decoys):作为分子阻断剂,lncRNAs与转录因子或其他蛋白结合从而阻断分子作用或信号通路,进而调控下游基因转录。另一种阻断机制是通过竞争性内源RNA(competitive endogenous RNAs,ceRNAs)机制,作为miRNAs的分子海绵,以竞争性方式结合miRNAs,进而影响miRNAs对下游靶基因的调控。③lncRNAs与蛋白结合(guides):lncRNAs与蛋白结合指导核糖体蛋白复合物定位至特定目标。④中心平台(scaffolds):作为“中心平台”,多个相关转录因子均可结合在lncRNAs分子上,多条信号通路同时被激活,实现不同信号通路之间的信息交流。
lncRNAs上的互补位点使他们能识别并结合到mRNA、miRNAs甚至其他lncRNAs,并作为调节高度特异性的传感器。lncRNAs可折叠为复杂的二级结构,与多种蛋白质结合。这种结构决定lncRNAs调控的多样性,通过多种途径在转录前、转录及转录后和翻译水平调控基因的表达[10-11]。最初lncRNAs认为是“进化垃圾”,相关研究证据表明其具有调控心脏相关分子机制的能力,可参与心脏发育至成熟阶段的一系列疾病[12],成为参与调控心肌细胞部分生理及病理过程的关键因子。
2 心肌细胞肥大相关过程
病理性心肌细胞肥大分为代偿性肥大和失代偿性肥大,当肥厚性应激作用持续存在时,心肌细胞从代偿性肥大转变为失代偿性肥大,影响心脏收缩功能。心肌细胞肥大过程中,心肌细胞形态、大小及功能改变,表现为心肌细胞体积增大、蛋白合成总量增加及胎儿基因重新表达,这种变化在心肌细胞代偿性肥大过程中发挥着重要的保护作用[13],而在心肌细胞失代偿期这些病理改变进一步加重心力衰竭发生,并成为心肌细胞肥大的相关评价指标。这一病理过程可能存在能量代谢障碍[14]、氧化应激、炎症、钙离子失调[15]及细胞凋亡与衰老[16]等相关机制参与,同时受到多种复杂信号通路调控[17]。相关研究表明,参与调控心肌细胞肥大的主要信号通路包括丝裂原活化蛋白激酶MAPK信号通路、CaN-NFAT信号通路、PI3K-AKT/PKB-mTOR信号通路及染色质重塑的去乙酰化酶信号通路等[18]。lncRNAs可直接或间接激活这些信号通路,但具体调控机制尚未明确。
3 心肌细胞肥大相关lncRNAs
在心肌肥大病理过程中lncRNAs通过转录前、转录及转录后和翻译水平调控相关基因的表达,在该病理过程中发挥主要作用。详见图1。
3.1 转录前水平调控 染色质重塑是染色质结构的动态修饰,其中组蛋白修饰、DNA修饰等参与调控染色质的重塑过程。这些结构变化是影响基因转录的关键因素之一。有研究表明,lncRNAs通过直接与组蛋白和DNA修饰酶相互作用的共价修饰和依赖ATP调控染色质重塑的非共价调控参与染色质的重塑过程[19]。
3.1.1 共价修饰 基因组功能在染色质水平上受到表观遗传修饰的高度调控,其中组蛋白赖氨酸甲基化和乙酰化对调控基因组结构、基因组稳定性和基因表达关键蛋白复合物的聚集至关重要[20]。多梳抑制性复合体2(polycomb repressive complex 2,PRC2)具有组蛋白甲基转移酶活性,主要作用于赖氨酸27上的组蛋白H3甲基化(histone H3 lysine 27 methylation,H3K27me3)[21]。PRC2作为lncRNAs的已知分子靶点[22],在心肌肥厚发生发展中发挥重要的调节作用。Wang等[23]研究发现,心肌肥厚相关表观遗传调节因子(cardiac-hypertrophy-associated epigenetic regulator,Chaer),可能通过直接与PRC2催化亚基相互作用,抑制心肌肥大相关基因启动子区组蛋白H3K27甲基化,促进心肌细胞肥大。Xing等[24]研究证实,肌钙蛋白可诱导心肌细胞肥大,促进胎儿基因表达。有研究发现,编码调控心脏收缩蛋白Myh7基因位点上肌球蛋白重链RNA转录本lncRNA Mhrt与肌钙蛋白有直接靶向关系,并在心肌细胞肥大过程中形成一个循环调控[25]。一方面,lncRNA Mhrt通过影响组蛋白去乙酰化酶5(histone deacetylase 5,HDAC5)对肌钙蛋白的去乙酰化作用抑制心肌细胞肥大;另一方面,肌钙蛋白通过与lncRNA Mhrt启动子上的两个结合位点结合直接激活lncRNA Mhrt转录,在心肌细胞肥大病理过程中发挥重要作用。
3.1.2 ATP依赖的非共价调控 lncRNA Mhrt作为染色质重塑的一个例子,在病理重塑中可抑制心肌细胞肥大。有研究表明,一种“lncRNAs-染色质”相互作用机制可能导致心力衰竭发生[26]。Brg1是一种被压力激活的色素重塑因子,导致异常基因的表达和心肌病的发生。该研究明确了一种具有心脏保护作用的lncRNA Mhrt,定义了一种新型针对ATP依赖性染色质重塑因子的靶向机制,lncRNA Mhrt通过拮抗Brg1表达抑制心肌细胞肥大。从新的角度揭示了lncRNAs与染色质的相互作用机制,其在心肌肥厚和心力衰竭过程中起到的重要作用,并为lncRNAs与染色质的相互作用建立了新型模式。
3.2 转录及转录后水平调控 lncRNAs可在转录水平通过顺式作用元件如(启动子、增强子、沉默子和绝缘子)调控转录起始的DNA序列。Viereck等[27]通过全基因组lncRNA表达谱分析研究发现,心肌营养相关转录本(cardiac hypertrophy-associated transcript,Chast)是促进心肌细胞肥大的lncRNA。lncRNA Chast在主动脉缩窄手术小鼠、主动脉瓣狭窄病人和肥大刺激下人胚胎干细胞来源的心肌细胞表达均显著上调,可能通过顺式作用负向调控自噬因子Plekhm1表达,进而抑制心肌细胞自噬并促进心肌细胞肥大,该研究表明促肥大转录因子NFAT与编码lncRNA Chast基因位点结合,促进lncRNA Chast表达。详见图1、图2。
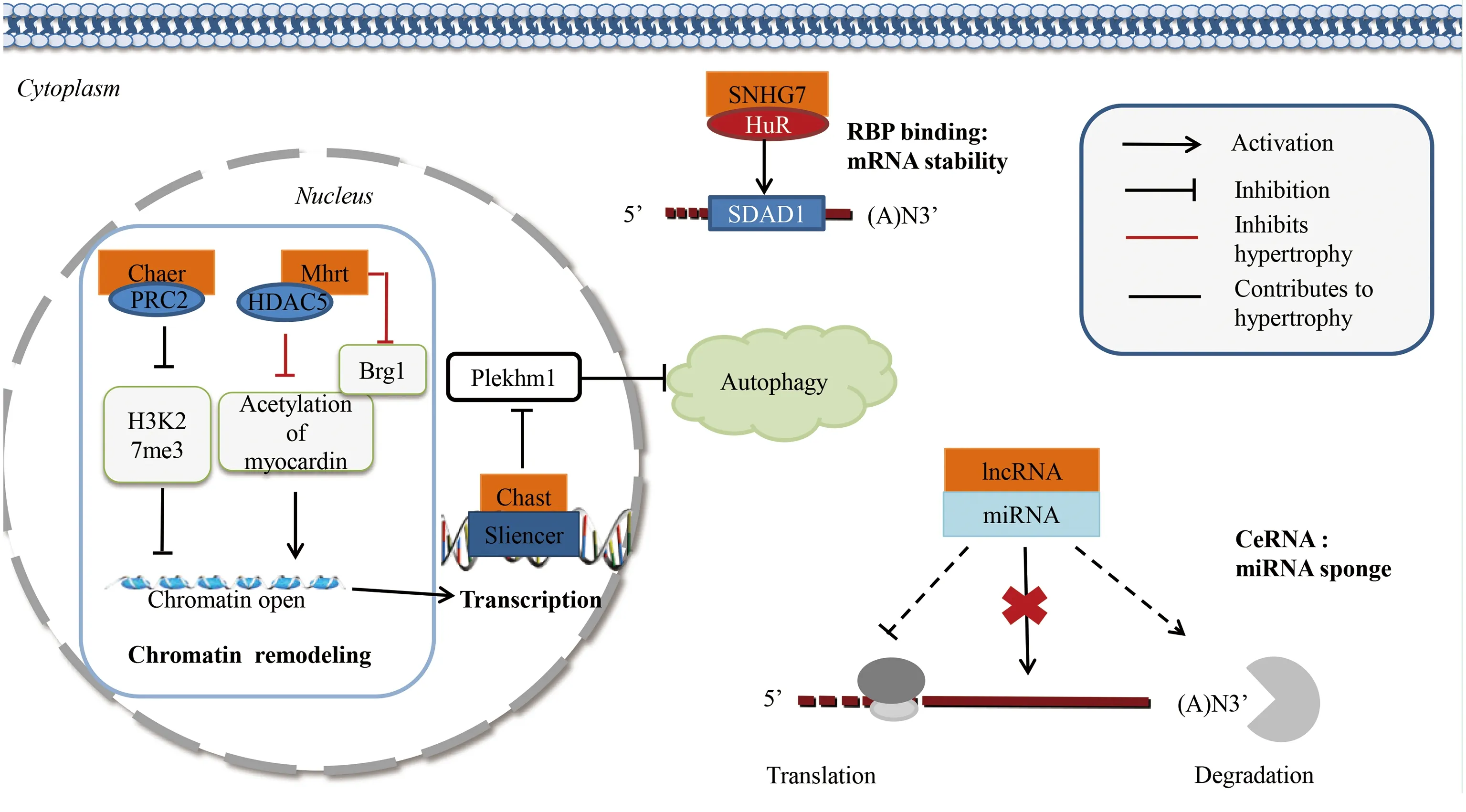
图1 心肌细胞肥大与lncRNAs (① PRC2:polycomb repressive complex 2,多梳抑制性复合体2;②Me3:histone methylation,组蛋白三甲基化;③HDAC5:histone deacetylase 5,组蛋白去乙酰化酶5;④RBP:RNA binding protein,RNA结合蛋白)
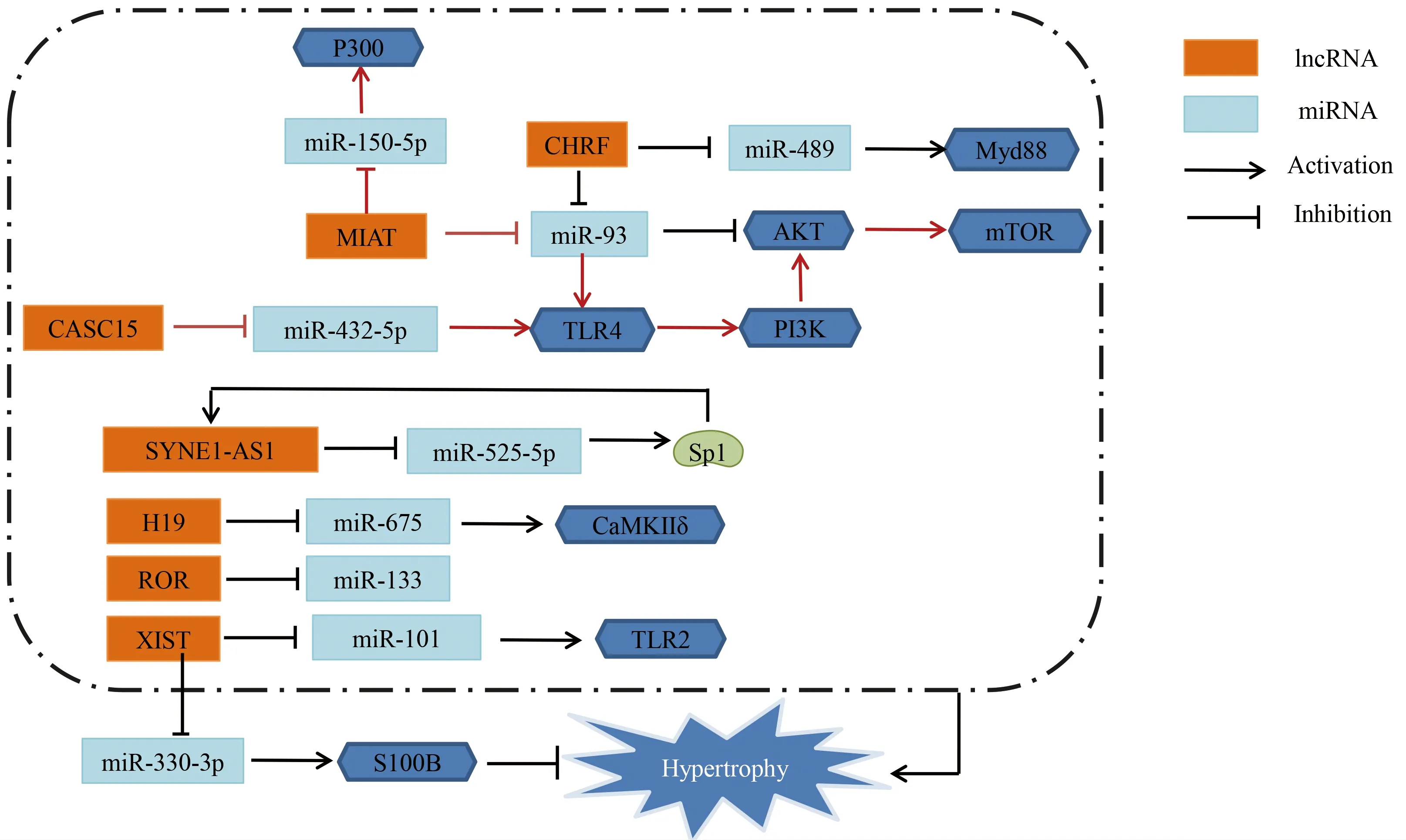
图2 ceRNA机制
lncRNAs在转录后水平通过与RNA结合蛋白(RNA binding protein,RBP)相互作用调控mRNA稳定性。RBP在细胞质中与单链或双链RNA结合,稳定mRNA表达。lncRNA SNHG7已明确为人类癌症中的致癌基因[28-29],SDAD1在几种癌症中证实具有促癌作用[30-31]。有研究发现,lncRNA SNHG7和SDAD1在血管紧张素Ⅱ(AngⅡ)诱导的原代乳鼠心肌细胞肥大模型中表达上调,证实了lncRNA SNHG7可能通过与RNA结合蛋白HuR相互作用进而稳定SDAD1 mRNA表达,促进心肌肥大,作为促心肌细胞肥大的一个新型调控因子[32]。
3.3 翻译水平调控 CeRNA机制是一种RNA之间的调控机制,包含生物体内复杂的转录调控网络中除miRNAs外的众多RNA分子,包括mRNA、lncRNAs、circRNAs等,均存在与miRNAs结合的位点,在细胞中起到miRNAs海绵的作用,进而解除miRNAs对靶基因的抑制作用[33]。
3.3.1 促心肌细胞肥大 已有研究表明,心脏肥厚相关因子(CHRF)作为miR-489的分子海绵,抑制miR-489表达,进而上调其下游靶点Myd88的表达促进心肌细胞肥大[34]。Myd88作为核转录因子-κB(NF-κB)的下游效应因子,Myd88敲除不仅可减缓心肌细胞肥大,还可减轻心肌纤维化和心脏相关炎症反应。新近研究表明,miR-93通过上调Akt3表达水平抑制心肌细胞肥大,而lncRNA CHRF可作为miR-93分子海绵,通过调控miR-93/Akt3轴促进心肌细胞肥大[35]。Liu等[36]研究发现,miR-675过表达可抑制心肌细胞肥大。lncRNA H19可竞争性结合miR-675,下调心肌细胞miR-675的表达,该研究证实CaMKⅡδ是miR-675直接的下游靶点,提示lncRNA H19可能靶向miR-675上调CaMKⅡδ的表达促进心肌细胞肥大。lncRNA ROR通过负向调控miR-133表达促进心肌细胞肥大[37]。
相关研究发现,lncRNA心肌梗死相关转录本(MIAT)沉默导致ISO诱导的心肌细胞心房利钠肽(atrial natriuretic peptide,ANP)表达下调,显著上调miR-150表达,从而降低原代乳鼠心肌细胞P300表达[38]。lncRNA MIAT促心肌细胞肥大可能通过lncRNA MIAT/miR-150-5p轴靶向P300发挥作用。有文献报道,AngⅡ诱导的体外心肌细胞肥大模型中lncRNA MIAT表达上调,而miR-93表达下调,lncRNA MIAT作为miR-93的分子海绵抑制心肌细胞miR-93表达,进而上调miR-93靶点toll样受体4(toll-like receptor 4,TLR4)表达[39]。lncRNA MIAT可能通过miR-93/TLR4轴激活PI3K/Akt/mTOR信号通路促进AngⅡ诱导心肌细胞肥大的病理进程。Toll样受体作为心肌细胞肥大进程的重要靶点之一,受到多分子调控作用。Li等[40]研究表明,lncRNA CASC15被转录因子VDR激活,通过竞争性结合miR-432-5p上调TLR4表达从而诱导心肌细胞肥大。
Wang等[41]研究发现,lncRNA SYNE1反义RNA1(SYNE1-AS1)敲除可减轻心肌细胞肥大表型,其作用机制可能通过作为miR-525-5p的分子海绵正向调控Sp1转录因子(Sp1 transcription factor,Sp1)表达促进心肌细胞肥大。Sp1能激活lncRNAs SYNE1-AS1转录。因此,lncRNA SYNE1-AS1促心肌细胞肥大的机制可能通过miR-525-5p/Sp1轴及Sp1和lncRNA SYNE1-AS1形成反馈调节机制进行动发挥作用。
3.3.2 双向调节作用 Xiao等[42]研究发现,在PE诱导的体外心肌肥大模型和TAC诱导的体内心肌肥厚模型中,lncRNA XIST表达均显著升高。采用荧光素酶报告基因测定法和RNA免疫沉淀法研究XIST、miR-101、toll样受体2(toll-like receptor 2,TLR2)之间的靶向关系;结果表明,TLR2是miR-101的下游靶点,lncRNA XIST直接靶向结合miR-101。结果证实lncRNA XIST促心肌细胞肥大作用可能是通过靶向miR-101进而调控TLR2表达实现的。有研究表明,lncRNA XIST过表达可能减缓心肌肥厚进程,其主要作用机制是lncRNA XIST通过与miR-330-3p的互补位点结合促进S100B表达,从而发挥对心肌细胞肥大的保护作用[43]。
4 小 结
目前研究发现lncRNAs有很多不同的分子机制,但关于lncRNAs的研究处于初级阶段,现阶段研究多数以ceRNAs机制对其功能进行阐释。lncRNAs作为近年来的研究热点,一是与编码蛋白基因相比,lncRNAs具有较低的保守性,研究lncRNAs技术和方法需进一步改进;二是根据lncRNAs结构特点,lncRNAs作用靶点广泛,调控机制复杂,仍需进一步探索。关于lncRNAs功能及其调控网络的研究,不仅在揭示心肌细胞肥大的复杂机制中发挥重要作用,还可能为心脏疾病的治疗提供新的潜在靶点。

