石墨烯对氧化应激引起的毛细胞损伤的保护作用研究
董健菲陆玲林川耀刘勇周函朱成文潘明洁唐明亮高下*
1南京大学医学院附属鼓楼医院耳鼻咽喉头颈外科,江苏省医学重点学科(南京 210008)
2南京大学医学院附属鼓楼医院耳鼻咽喉研究所(南京 210008)
3南京大学医学院附属鼓楼医院中心实验室(南京 210008)
4东南大学生命科学院(南京 210096)
各种原因导致的听力下降,是引起言语交流困难的主要原因,大大降低了耳聋患者的生活质量[1]。根据WHO统计2005年全球听力障碍人数为2.78亿,占全球人口的4.6%。耳聋已成为影响社会政治和经济的全球性健康问题。
由内耳缺血、缺氧、噪声和耳毒性药物等引起的耳蜗毛细胞损伤与氧自由基的产生密切相关[2-6]。细胞在进行有氧呼吸时,线粒体内氧分子通过质子耦合和电子转移等过程被还原生成水,反应过程中产生的能量用于合成三磷酸腺苷(ATP)。其中约1~2%的氧分子未彻底被还原,形成超氧阴离子自由基(·O2-)、羟基自由基(·OH)、单线态氧(1O2)和过氧化氢(H202)等ROS。活性氧积聚会导致氧化与抗氧化系统之间的平衡失调,破坏细胞膜,改变细胞通透性,引起DNA损伤,导致蛋白酶失活和脂肪过氧化等效应,进而诱发细胞炎症,甚至凋亡等[7]。目前,大多数理论认为内耳听觉相关毛细胞线粒体的代谢过程中产生的ROS增多,超出自身的清除能力,造成上述细胞内DNA、蛋白质氧化损伤和脂质过氧化,从而导致毛细胞损伤[8]。与此同时,ROS还可作为细胞内信使激活一系列细胞转导通路。直接诱导内耳毛细胞凋亡,最终导致听力损失[9]。
氧化应激损伤一直以来是耳科学研究中的热点问题,尽管降低内耳中ROS的水平、减轻氧化应激反应是目前治疗耳聋的重要手段,但目前还没有找到能有效减轻氧化应激的方法。本文拟研究CVD法制备的石墨烯对于氧化应激损伤后类毛细胞系的保护作用及可能的机制。CVD法是使用含碳化合物作碳源,碳源在高温下裂解后,与基底相互作用后在其表面生长形成石墨烯。它是目前最具前瞻性、成本低、易于制备大面积高质量石墨烯的方法。CVD法可用于生产具有单一结晶度的石墨烯,并且可以很容易应用于实际生产[10]。
Lasocka等人研究发现CVD法制备的石墨烯薄膜对L929成纤维细胞没有细胞毒性,且可以增加L929成纤维细胞的粘附力[11]。有文献报道,石墨烯特殊的理化性质决定了它具有一定的吸附能力,能够清除一定的ROS[12],从而减轻细胞的氧化应激。但目前还没有文献报道石墨烯对氧化应激引起的听觉毛细胞损伤具有保护作用,且其作用机制也尚不清楚。因此,本文拟通过cck-8检测法、免疫荧光检测法、流式分析法、TUNNEL检测法等研究石墨烯对氧化应激引起的听觉毛细胞损伤的保护作用及其具体机制,但本次实验为体外基础研究,将来能否将石墨烯应用于临床,还需要更多的体内研究进行验证,本研究仅能为治疗和预防耳聋提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 所用材料
本研究应用的石墨烯材料购买自南京牧科纳米有限公司,是采用CVD(化学气相沉淀法)制备的二维石墨烯材料。该石墨烯的制备是在Cu(铜基)上进行的。具体的制备方法见图1、2。

图1 铜基石墨烯转移流程示意图Fig.1 Schematic diagram of transfer process of copper-based graphene

图2 上图中是将二维石墨烯转移到衬底材料SiO2上,本研究是将二维石墨烯转移到衬底材料TCPs(TC玻片)上。Fig.2 In the above figure,2D graphene is transferred to the SiO2-based material.But in this study,2D graphene is transferred to the TCPs(TC-treated coverslips).
1.1.2 实验细胞
采用HEI-OC1细胞系(House Ear Institute-Organ of Corti 1),该细胞系作为体外耳蜗毛细胞研究的模型系统,可以表达多种毛细胞marker,包括钙结合蛋白、钙调蛋白、Math1、Myosin7a、Prestin等[13]。
1.1.3 主要试剂
H2O2、氨苄青霉素购于Sigma公司;DMEM培养基购于维森特公司;胎牛血清购于Gibco公司;胰蛋白酶购于Invitrogen公司;cck-8试剂盒购于同仁公司;兔抗myosin7a单克隆抗体购于Proteus Bioscience公司;DAPI、DCFH-DA购于Solarbio公司;Mito-sox购于Life公司;TUNNEL试剂盒购于Vazyme公司;HEI-OC1细胞系完全培养基(50ml):DMEM 45ml;10%FBS 5ml;100mg/ml AMP(氨苄青霉素)50μl。
1.2 实验方法
1.2.1 石墨烯材料的处理
二维石墨烯在超净台中紫外照射24h。用75%乙醇浸泡24h。用ddH2O浸泡12h。用完全培养基浸泡二维石墨烯,置于37℃、5%CO2饱和水汽恒温培养箱中孵育过夜。
1.2.2 cck-8检测法
分别在24孔皿中加入5片2D-G和5片TCPs,以此作为实验组和对照组,处理材料。每孔接种4x104/ml的细胞悬液500μl。置于 37℃、5%CO2饱和水汽恒温培养箱中孵育24h。然后每孔分别加入 500μmol/l、750μmol/l、1mmol/l、2mmol/l、5mmol/l的H2O2,置于培养箱中分别孵育4h和12h。每孔中分别加入10%的cck-8试剂,轻轻摇匀,37℃,避光孵育1h。将24孔皿中的培养基吸出,按照不同H2O2浓度将其转移至96孔皿。将96孔皿置于酶标仪中,检测每孔的OD值。
1.2.3 免疫荧光法
分别在24孔皿中加入TCPs和2D-G,以此作为实验组和对照组,处理材料。每孔接种8x104/ml的细胞悬液500μL。细胞培养24h后加不同浓度H2O2作用4/12h鉴定毛细胞标记物Myosin 7a(1:1000稀释)的表达。细胞培养后加500μmol/l H2O2处理4h检测细胞内和线粒体内ROS(DCFH-DA/MitoSOX 1:1000稀释)水平。
1.2.4 流式分析法
分别在6孔皿中加入3片2D-G/孔和3片TCPs/孔,以此作为实验组和对照组,处理材料。每孔接种1×105/ml的细胞悬液1mL。细胞培养24小时后加500μmol/L H2O2处理,培养箱中避光孵育4h。用无菌1×PBS洗一遍。分别将配好的DCFH-DA(1:1000)/MitoSOX(1:1000)混合培养基加入到样品孔,每孔1ml。置于培养箱中避光孵育30/10分钟。用DMEM/PBS洗三遍。每孔加入1mL 0.25%Trypsin,置于培养箱中孵育5分钟。体视显微镜下观察细胞消化情况,待贴壁细胞成团漂起时,加入1mL完全培养基,终止消化。1000转每分钟(rpm),离心5分钟。弃上清,每管加入300μL 1×PBS,用移液枪吹打均匀。然后将细胞混悬液转移到流式专用管。上机,分析。(注:整个操作过程中注意避光)
1.2.5 TUNNEL检测法
分别在24孔皿中加入2D-G和TCPs,以此作为实验组和对照组,处理材料。每孔接种8×104/ml的细胞悬液500μL。细胞培养24小时后加500μmol/L H2O2处理,培养箱中避光孵育4h。用无菌1×PBS洗一遍。然后加入4%PFA,常温固定1h。弃4%PFA,然后用PBST 5分钟/次,洗三遍。每孔加入1mL Blocking medium,常温孵育1h。将TUNNEL试剂盒中的5×buffer用ddH2O稀释为1×buffer,覆盖过细胞,室温放置30分钟。配制TdT缓冲液:5×buffer 10μl;FITC Mixture 5μl;TdT Enzyme 1μl;ddH2O 34μl;Total 50μl。去除1xbuffer,将TdT缓冲液覆盖细胞,置于培养箱中分别避光孵育1h。弃缓冲液,1xPBS清洗两次,每次洗5分钟。加入配好的 DAPI(DAPI:PBT-2=1:1000)染色液,室温孵育30-60分钟。1xPBS清洗三次,每次5分钟。每片表面滴加6μl DAKO封片液,然后用指甲油封片。Confocal拍照。(注:整个封片过程中注意避光)
1.3 统计方法
本研究使用GraphPad Prism6.02软件进行统计分析和绘图,所有实验数据以,用于不同浓度H2O2处理后实验组与对照组间细胞存活率的比较采用双因素方差分析,组间比较采用Sidak’s检验。两组间的活性氧水平和凋亡水平的比较采用t检验。P<0.05为组间差异具有统计学意义,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
2 结果
2.1 石墨烯能够显著提高短期氧化应激后耳蜗毛细胞系HEI-OC1细胞的存活率
不同浓度H2O2处理4h后,2D-G组(二维石墨烯组,即实验组)与TCPs组(TC玻片,即对照组)的细胞存活率采用双因素方差统计分析得出H2O2、材料及两者结合对细胞存活率均有影响(F=703.1,P<0.0001;F=41.39,P<0.0001;F=2.936,P=0.0225),且差异具有统计学意义,需进行两两比较。组间比较用Sidak’s检验,发现细胞存活率在 500μmol/L(P<0.05)、750μmol/L(P<0.05)、1mmol/L(P<0.01)H2O2浓度下提高,差异有统计学意义。其中500μmol/L和750μmol/L H2O2浓度下细胞存活率维持在80%以上,1mmol/L浓度下细胞存活率维持在60%以上(图3)。图4为不同浓度H2O2处理4h后,HEI-OC1细胞数目随H2O2浓度的提高而减少,但实验组的细胞数目较对照组多的免疫荧光图。

图3 H2O2处理4h后,2D-G(二维石墨烯)和TCPs(TC玻片)上HEI-OC1细胞的存活率(CCK-8检测法)Fig.3 The survival rate of HEI-OC1 cell grown on 2D-G and TCPs after H2O2treatment for 4h(CCK-8 test)

图4 H2O2处理4h后,2D-G(二维石墨烯)和TCPs(TC玻片)上HEI-OC1细胞的存活情况(40x激光共聚焦显微镜)Fig.4 The survival of HEI-OC1 cell grown on 2D-G and TCPs after H2O2treatment for 4h(40x laser confocal microscope)
2.2 石墨烯能够显著提高较长时间氧化应激后耳蜗毛细胞系HEI-OC1细胞的存活率
不同浓度H2O2处理12h后,2D-G组与TCPs组的细胞存活率采用双因素方差统计分析得出H2O2、材料及两者结合对细胞存活率均有影响(F=1815,P<0.0001;F=212.8,P<0.0001;F=2.954,P=0.0044),且差异具有统计学意义,需进行两两比较。组间比较用Sidak’s检验,发现细胞存活率在500μmol/L(P<0.0001)、750μmol/L(P<0.001)H2O2浓度下提高,差异有统计学意义。其中500μmol/L浓度下细胞存活率维持在80%左右,750μmol/L H2O2浓度下细胞存活率维持在60%以上(图5)。图6为不同浓度H2O2处理12h后,HEI-OC1细胞数目随H2O2浓度的提高而减少,但实验组的细胞数目较对照组多的免疫荧光图。

图5 H2O2处理12h后,2D-G(二维石墨烯)和TCPs(TC玻片)上HEI-OC1细胞的存活率Fig.5 The survival rate of HEI-OC1 cell grown on 2D-G and TCPs after H2O2treatment for 12h(cck-8 test)
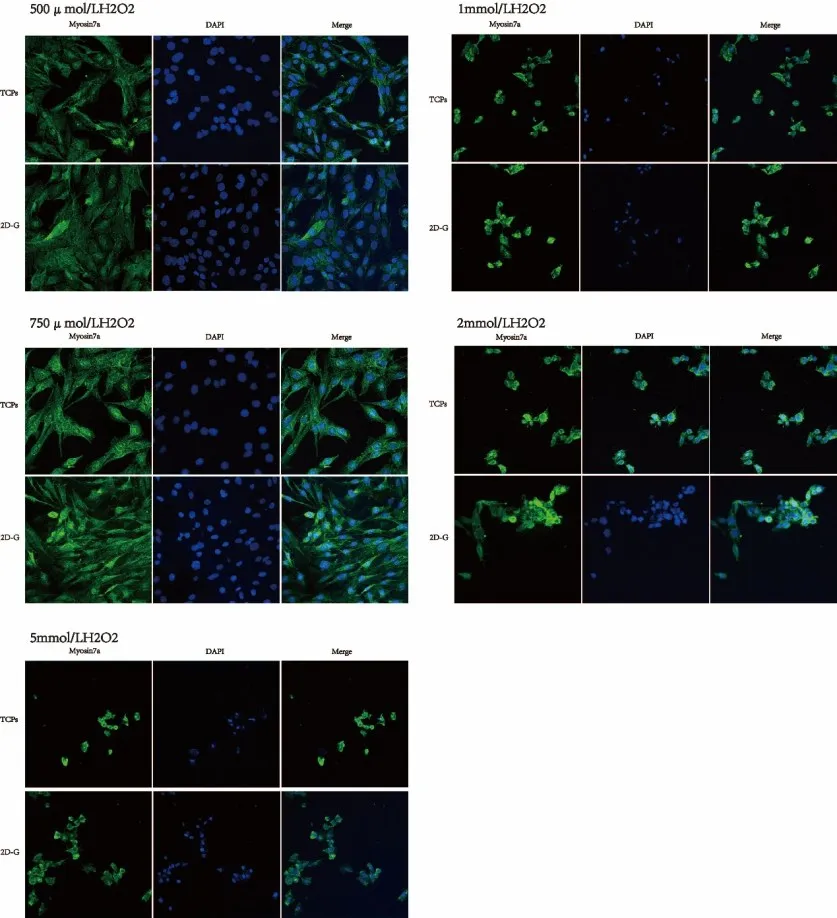
图6 H2O2处理12h后,2D-G(二维石墨烯)和TCPs(TC玻片)上HEI-OC1细胞的存活情况(40x)Fig.6 The survival of HEI-OC1 cell grown on 2D-G and TCPs after H2O2treatment for 12h(40x)
根据以上的实验结果,我们选取500μmol/L的H2O2浓度作为较适浓度,4h作为较适处理时间,用于后续实验。
2.3 石墨烯能够显著降低氧化应激后耳蜗毛细胞系HEI-OC1细胞内及线粒体内的ROS水平
2.3.1 石墨烯能够显著降低氧化应激后耳蜗毛细胞系HEI-OC1细胞内的ROS水平
用500μmol/L H2O2处理4h后,2D-G组与TCPs组细胞内总体ROS水平免疫荧光强度(,n=5)分别为36.73±1.398,48.97±3.614。实验组细胞内总体ROS水平低于对照组P<0.05,差异有统计学意义(图7)。流式分析表明细胞内总体ROS水平荧光强度(,n=3)分别为248.7±2.333,932.7±14.75,实验组细胞内荧光强度低于对照组P<0.0001,差异有统计学意义(图8)。

图7 H2O2处理后,石墨烯组与对照组HEI-OC1细胞内总体ROS水平比较(40x激光共聚焦显微镜)(±s,n=5)Fig.7 Comparison of the overall intracellular ROS levels of HEI-OC1 between the graphene group and the control group after H2O2treatment(40x laser confocal microscope)(±s,n=5)

图8 H2O2处理后,流式分析石墨烯组与对照组细胞内的总体ROS水平(±s,n=3)Fig.8 Flow analysis of total ROS levels in cells of the graphene group and the control group after H2O2treatment(±s,n=3)
2.3.2 石墨烯能够显著降低氧化应激后耳蜗毛细胞系HEI-OC1线粒体内的ROS水平
2D-G组与TCPs组线粒体内ROS水平免疫荧光强度(,n=6)分别为 32.77±2.180,43.67±3.175。实验组线粒体内ROS水平低于对照组P<0.05,差异有统计学意义(图9)。流式分析表明线粒体内ROS水平荧光强度(,n=3)分别为1457±15.18,1537±19.55,实验组线粒体内ROS水平低于对照组P<0.05,差异有统计学意义(图10)。

图9 H2O2处理后,石墨烯组与对照组HEI-OC1细胞线粒体内ROS水平比较(40x)(±s,n=6)Fig.9 Comparison of mitochondrial ROS levels in HEI-OC1 cells between the graphene group and the control group after H2O2treatment(40x)(±s,n=6)

图10 H2O2处理后,流式分析石墨烯组与对照组细胞线粒体内的ROS水平(±s,n=3)Fig.10 Flow analysis of ROS levels in mitochondria of cells in the graphene group and the control group after H2O2treatment(±s,n=3)
2.4 石墨烯能够显著降低氧化应激后耳蜗毛细胞系HEI-OC1细胞的凋亡水平
用500μmol/L H2O2处理4h后,石墨烯组与对照组的细胞凋亡率(,n=6)分别为0.1799±0.01753,0.3320±0.05193,石墨烯组细胞凋亡率低于对照组P<0.05,差异有统计学意义(图11)。

图11 H2O2处理后,石墨烯组与对照组HEI-OC1细胞凋亡水平的比较(40x)(±s,n=6)Fig.11 Comparison of apoptosis levels of HEI-OC1 cells in the graphene group and the control group after H2O2treatment(40x laser confocal microscope)(±s,n=6)
3 讨论
H2O2损伤后HEI-OC1细胞存活率和活性氧检测的实验已经证实石墨烯能够清除HEI-OC1细胞胞质及线粒体内的ROS,提高细胞的存活率。石墨烯自2004年被Andre Geim和Konstantin Novoselov首次发现后便引发研究热潮,国内外都报道了许多石墨烯在生物医学基础研究和应用方面的工作。石墨烯是碳原子以sp2杂化轨道形成的六角蜂窝晶格的二维结构,由于其具有独特的物化性质,例如:高比表面积、高电荷迁移率、良好的机械强度等,已经在药物运输[14]、生物分析[15]、干细胞工程[16]及肿瘤治疗[17]等生物医学领域表现出很大的潜力。石墨烯作为一类新型的抗氧化剂,其拥有物理屏蔽作用和超高的表面积,具有清除自由基的作用[18]。
随后我们进行了H2O2损伤后HEI-OC1细胞凋亡率检测的实验,结果表明石墨烯能够减轻氧化应激引起的HEI-OC1细胞凋亡。在生理和病理状态下,活性氧在诱导细胞凋亡方面都发挥着重要作用[19]。既往研究表明,氧化应激可以通过激活外源性细胞死亡受体和内源性线粒体细胞凋亡通路来引发凋亡[20]。ROS主要通过两种途径来诱导毛细胞凋亡,即通过Caspase诱导的程序性细胞死亡[21]和活化MAPK/JNK信号通路引发凋亡[22,23]。ROS水平的提高和随后凋亡的发生参与了耳聋病理的发展[24]。
我们大胆的猜想,能否将石墨烯材料通过圆窗给药的方式注射到耳蜗内。但用于本次研究的石墨烯为二维固体石墨烯,故通过圆窗给药注射到耳蜗仍有很大的难度。石墨烯与水凝胶的复合材料为有效解决这一难题提供了新的思路,目前有较多关于石墨烯衍生物与水凝胶组成的复合材料用于疾病治疗的模型。如石墨烯-氧化物(GO)增强聚合物水凝胶(GPH)作为有前途的栓塞剂,能够使用经导管动脉栓塞(TAE)技术来治疗脑血管疾病和恶性肿瘤[25]。Arghya Paul等人开发了一种可注射且具有生物相容性的水凝胶,该凝胶可以有效地递送GO和血管内皮生长因子165(VEGF)促血管生成基因的纳米复合物,用于心肌治疗[26]。在最新的研究中,Cosimo Ligorio等人利用GO作为纳米填料来设计混合可注射3D支架,以输送髓核细胞(NPC)用于椎间盘再生。因此,这些杂化水凝胶具有作为可注射支架用于髓核细胞体内递送的巨大潜力[27]。
有文献报道,石墨烯及其家族根据层数,横向尺寸可分为潜在的可吸入和不可吸入两种类型。大多数横向尺寸大于20μm的商业化的几层石墨烯仍处于可吸入区域(空气动力学直径(Daa)<5μm),因为它们超薄,但在肺部沉积后可能无法有效清除。沉积在鼻咽和气管支气管中的可吸入石墨烯颗粒可以在短时间内被该部位的粘膜纤毛通过“粘膜自动扶梯”途径清除。沉积在肺泡内的可吸入石墨烯颗粒可以通过特殊细胞-肺泡巨噬细胞转运至淋巴结进行清除,但过程需要数月至数年时间。然而巨噬细胞成功吞噬板状石墨烯颗粒并保留足够的运动清除能力的研究尚待进一步进行[28]。腺嘌呤二核苷酸氧化酶(通常缩写为NOX)是在吞噬细胞中表达的多蛋白复合物,可催化超氧化物的产生。反过来,超氧化物歧化形成过氧化氢,髓过氧化物酶(MPO)催化次氯酸的形成,次氯酸是具有杀微生物作用的可自由扩散的氧化剂,髓过氧化物酶和次氯酸都可以降解碳基纳米材料。此外,诱导型一氧化氮合酶(iNOS)产生的过氧化氢和一氧化氮反应形成过氧亚硝酸盐,可以消化巨噬细胞中的纳米材料[29]。
目前有关石墨烯毒性机制的研究主要集中于线粒体损伤、DNA损伤、炎性反应、凋亡等终点及氧化应激参与的复杂信号通路。但不同石墨烯纳米材料的浓度、层数、尺寸、形态、表面结构和官能团、进入机体途径、存在部位等对石墨烯的生物毒性影响差别较大。目前大部分文章都是关于石墨烯短暂停留机体的毒性研究,如果石墨烯长期滞留机体组织内是否危害健康还有待进一步研究[30]。
综上所述,本研究中石墨烯可能是通过清除细胞外ROS浓度来降低细胞胞质及线粒体内的氧化应激水平,从而减轻细胞凋亡,进而发挥保护毛细胞的作用。

