紫花苜蓿转录因子基因MsAP2的克隆及转化
石欣玥 尚骁尧 周玲芳 张铁军 晁跃辉
(北京林业大学草业与草原学院,北京100083)
紫花苜蓿是一种优良的多年生豆科植物,含有丰富的营养物质,并且生长适应性强,在我国种植范围广泛,紫花苜蓿因其自身的优良品质已成为首选牧草品种,其生长品质和产量决定了苜蓿饲料的价格,影响着畜牧业的发展,因此,培育出高产优质的紫花苜蓿新品种是我国科研育种工作者一直以来追求的目标。
AP2/ERF(APETALA2/ethylene responsive factor)是植物体中的一类转录因子家族,通过调控与植物器官分化形成相关的基因表达而调控器官的发育,1994年,Jofuku等[1]首次从拟南芥中发现并分离出AP2/ERF基因,该基因参与调控拟南芥花器官的生成和种子的形成。GmRAV是AP2/ERF转录因子家族AP2亚族中RAV家族的同源转录因子基因,通过在烟草中过表达GmRAV,发现转GmRAV烟草的生长发育和器官形成明显受到抑制作用,与野生型相比,植株矮化严重,叶片变小变薄更幼嫩,根的伸长程度变短,根系变得更短和细弱,叶片中的叶绿素含量明显降低,光合速率明显下降。并且对转GmRAV大豆植株根茎叶的生长也均表现出不同程度的抑制作用[2]。AP2/ERF转录因子参与不同的激素信号转导途径,调控植物激素的合成与运输。番茄SlAP2a能够抑制乙烯合成,使果实延迟成熟,在SlAP2a缺失突变体中,乙烯含量增加,果实提前成熟,此外,该基因还参与调控番茄中胡萝卜素的合成,使成熟果实颜色为橙色[3]。AP2/ERF转录因子中的ERF基因参与乙烯的反馈调节,乙烯能够诱导番茄LeERF2的表达,转LeERF2番茄中乙烯含量增加,而转入反义LeERF2番茄中的乙烯含量则显著减少[4-5]。通过对9株不同ERF家族基因的转基因大豆进行脱落酸处理,发现在处理后2-24 h时,这些植株的基因相对表达量均呈不同程度的上调趋势,表明ERF基因家族在脱落酸的信号调控网络中起作用[6]。Aya等[7]研究发现外施生长素后,水稻AP2/ERF转录因子调控smos1表达,使水稻器官大小和形态发生改变,而smos1功能缺失突变体的器官均变小,表明AP2/ERF转录因子在水稻中响应生长素信号,调控相关基因表达使器官发生相应的改变。Rashotte等[8]研究表明拟南芥AP2/ERF转录因子家族成员CBFs对植物叶片的发育起调控作用,并参与调控细胞分裂素中许多响应基因的表达,认为CBFs是细胞分裂素应答因子,调节细胞分裂素功能反应。
AP2/ERF转录因子在植物的生长发育进程中扮演着关键角色,发挥重要作用,但在紫花苜蓿中对MsAP2的功能性研究鲜见报道。
本研究利用RT-PCR技术克隆MsAP2,并将其转入紫花苜蓿,获得转基因植株,对转基因植株进行内源激素的测定(脱落酸、细胞分裂素、生长素和赤霉素)和表型鉴定,初步分析MsAP2的功能,为后续深入探究MsAP2在紫花苜蓿中的功能和探究MsAP2的信号转导网络提供理论指导和材料基础,也为紫花苜蓿生物技术育种提供一定的参考和借鉴。
1 材料与方法
1.1 材料
紫花苜蓿为北京林业大学草坪研究所保存的中苜1号,取单株长势良好的紫花苜蓿进行扦插,以扦插后生长4周的苜蓿为试验材料,排除不同紫花苜蓿植株基因组差异对试验造成的影响。农杆菌菌株为EHA105、植物表达载体为3302-3flag均保存于北京林业大学草坪研究所实验室。
1.2 方法
1.2.1 引物设计 依据公布的同源物种蒺藜苜蓿的MsAP2序列(XM_013593972.3),利用Primer Premier 5.0软件设计引物(表1)。

表1 所用引物的序列Table 1 Primer sequence
1.2.2 MsAP2的克隆 选取生长状态良好的紫花苜蓿叶片,利用植物总RNA提取试剂盒提取总RNA,使用反转录试剂盒反转录成cDNA。以cDNA为模板,利用引物MsAP2-f、MsAP2-r进行PCR扩增,反应程序为 95℃ 10 min ;95℃ 30 s,55℃ 30 s,72℃1 min,30个循环;72℃ 5 min,4℃保温。PCR产物经1%琼脂糖凝胶电泳检测后,纯化回收,然后与克隆载体pMD19-T连接(16℃ 30 min),转化。利用引物M13f、M13r进行菌体PCR检测,筛选阳性菌株送至睿博生物公司测序。
1.2.3 MsAP2植物表达载体的构建 将检测合格的含有重组克隆载体pMD19-AP2的质粒,用引物3302-AP2-f和3302-AP2-r进行扩增,与经Nco I酶切的植物表达载体3302-3flag进行连接(50℃ 15 min)、转化。利用引物3302-f、Nos181-r进行PCR检测,选取阳性菌株送至睿博生物技术公司进行测序。
1.2.4 农杆菌转化 提取3302-3flag-AP2的质粒,使用CaCl2冻融法将其转化至根癌农杆菌EHA105感受态细胞中,使之表达,并将菌液涂布在YEB固体培养基(含有50 mg/L卡那霉素、50 mg/L利福平)上,28℃过夜培养,利用引物3302-f和Nos181-r对菌落进行PCR鉴定,筛选阳性菌株送去睿博生物技术公司进行进一步测序鉴定。
1.2.5 紫花苜蓿的转化 选取扦插后长势一致的紫花苜蓿叶片进行灭菌处理,并浸泡在无菌水中,后续侵染使用。将检测合格的阳性农杆菌菌株在YEB固体培养基(含有50 mg/L卡那霉素、50 mg/L利福平)上划线活化,28℃过夜培养,挑取单菌落放入100 mL YEB液体培养基中扩大培养,然后富集菌体,使用Ms-COLQ培养液对菌体进行重悬浮至菌液的OD600=0.4-0.6。将处理好的叶片放入重悬后的菌液中,抽真空3 min后,100 r/min低速震荡1 h,使叶片充分被菌液侵染。然后将已侵染完全的叶片放在Ms-CO固体培养基上,24℃避光培养3 d,将外植体转移至Ms-YD培养基中进行愈伤组织的抗性筛选培养,避光培养5周后,再将其转移至Ms-SY培养基,光照下(光照16 h/黑暗8 h,温度24℃,光照强度60 lx)进行生芽培养5-6周,将芽长2 cm左右的外植体转移至Ms-SG培养基上进行生根培养,待根系生长足够发达后转移至无菌土壤中使植株继续生长,紫花苜蓿遗传转化过程中所用到的培养基配方见表2。
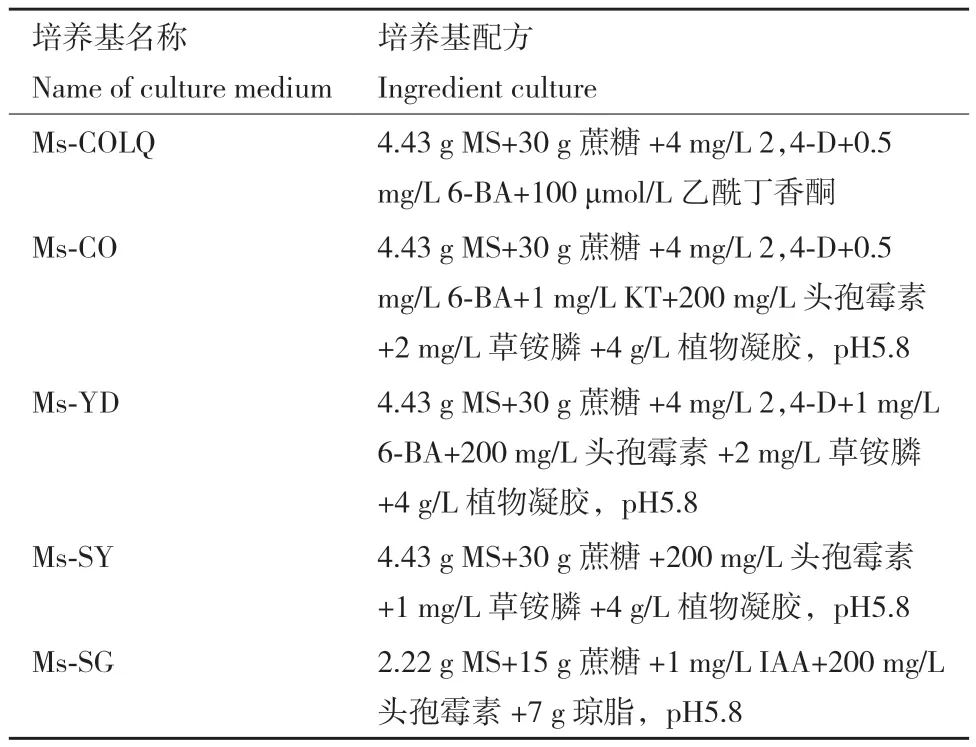
表2 紫花苜蓿遗传转化培养基成分Table 2 A variety of culture medium in the genetic transformation experiment of M. sativa
1.2.6 转基因植株的检测 对再生紫花苜蓿植株进行阳性检测,分别从DAN,RNA和蛋白质水平进行鉴定,检测MsAP2基因是否成功插入紫花苜蓿基因组,并根据蛋白质免疫印迹杂交结果初步分析MsAP2基因蛋白。
采用植物基因组总DNA提取试剂盒提取再生紫花苜蓿植株和野生型的基因组DNA,利用引物3302-f和Nos181-r进行阳性检测,对能够扩增出目的DNA的紫花苜蓿植株提取RNA,利用引物AP2-RT-f和AP2-RT-r进行RT-PCR检测,对能扩增出目的条带的紫花苜蓿植株标记为转基因植株。提取转基因植株和野生型的根系蛋白质,对转基因植株进行蛋白质免疫印迹杂交试验[9-10]。
1.2.7 转基因植株的表达分析 分别提取转基因植株和野生型叶片的RNA,以MsActin为内参基因,利用引物 AP2-RT-f、AP2-RT-r、actin-f、actin-r进行荧光定量PCR扩增,每个样品进行3个技术重复。利用2-ΔΔCt法[11]分析数据。
1.2.8 转基因植株的内源激素测定 测定转MsAP2紫花苜蓿植株和野生型植株的内源激素脱落酸(ABA)、细胞分裂素(玉米素ZR)、生长素(IAA)、赤霉素(GA3)含量[12-13]。
1.2.9 转基因植株的表型分析 对转MsAP2紫花苜蓿和野生型植株进行表型分析,统计转基因植株和野生型的分枝数,记录生长情况、叶片形态,发现在组织培养阶段转基因植株与野生型相比生根情况就出现差异,针对转MsAP2紫花苜蓿和野生型植株的生根能力做进一步的试验,来探究MsAP2基因表达对植株生根能力的影响,所以对转基因植株和野生型使用霍格兰溶液进行水培试验研究其生根能力的变化。
1.2.10 数据分析 利用Excel软件作图,运用SPSS 22.0软件进行单因素方差分析和LSD法多重比较。
2 结果
2.1 MsAP2的克隆
以紫花苜蓿cDNA为模板,MsAP2-f、MsAP2-r为引物进行PCR扩增,获得条带清晰、符合目的基因片段大小的条带(图1),初步判断MsAP2克隆成功。经测序,表明MsAP2克隆成功。
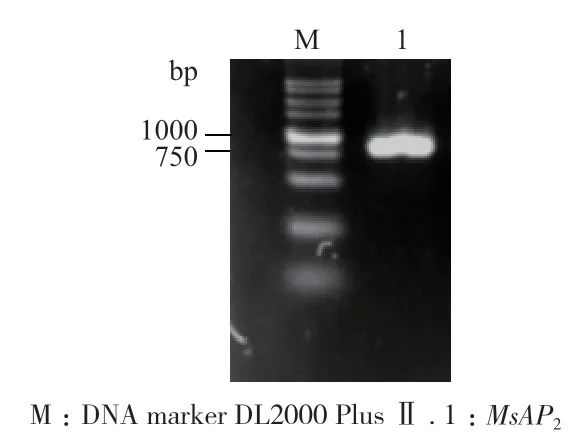
图1 MsAP2的克隆Fig.1 Cloning of MsAP2
2.2 MsAP2植物表达载体构建及农杆菌转化
将经NocⅠ酶切后的MsAP2克隆载体和3302-3flag载体连接、转化,筛选阳性菌株进行PCR检测,结果显示,有3个单菌落在800 bp左右为单一且清晰条带(图2),符合预期大小,经生物公司测序,结果比对正确,表明植物表达载体构建成功,将其命名为3302-3flag-AP2载体。
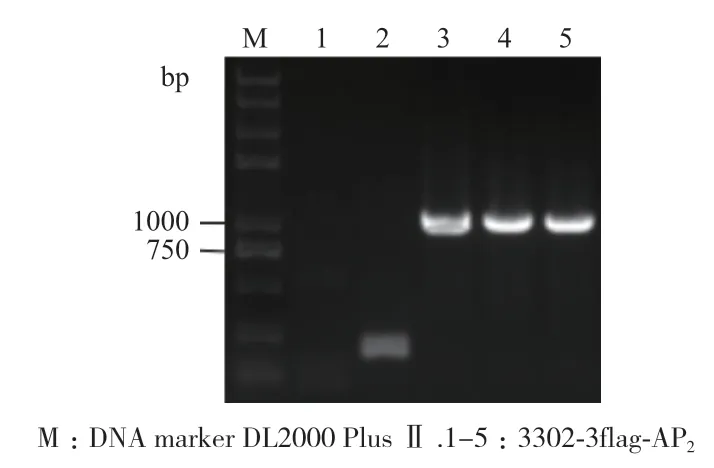
图2 3302-3flag-AP2转大肠杆菌Fig. 2 3302-3flag-AP2 transferred to E. coli
将3302-3flag-AP2载体转化至根癌农杆菌EHA105感受态细胞中,经抗生素筛序后,进行PCR检测,获得符合目的基因大小的条带(图3),表明3302-3flag-AP2植物表达载体已成功转化至农杆菌中。

图3 3302-3flag-AP2转农杆菌Fig.3 3302-3flag-AP2 transferred to Agrobacterium
2.3 紫花苜蓿的遗传转化
将经过农杆菌侵染的外植体在Ms-CO培养基上共培养3 d(图4-A),然后经头孢水溶液和无菌水洗去多余的农杆菌,放在Ms-YD筛选培养基中继续培养进行外植体的脱分化,生长5周后,经过抗性筛选后得到具有抗性的浅黄绿色愈伤组织(图4-B),将愈伤组织转移至Ms-SY生芽培养基中,经过3周的生芽培养后,愈伤组织上生长出绿色的嫩芽(图4-C),将嫩芽及时拔下使其与愈伤组织分离,将绿芽继续放在Ms-SY 生芽培养基中培养,培养3周左右后(图4-D),将嫩芽长2 cm左右,根长1 cm左右的愈伤转移至Ms-SG生根培养基中进行生根培养(图4-E),培养4周后将根系发达的幼苗移栽至无菌土壤中继续培养,6周后获得完整再生植株(图4-F)。

图4 MsAP2对紫花苜蓿的遗传转化过程Fig.4 MsAP2 genetic transformation to M. sativa
2.4 转基因植株的检测
经遗传转化体系共得到7株再生植株,提取再生植株紫花苜蓿叶片的总DNA,以DNA为模板进行PCR检测,结果(图5)表明,在5株再生苜蓿中扩增出符合目的基因大小的条带,初步判断目的基因MsAP2已经插入到这5株紫花苜蓿的基因组DNA中。对DNA检测呈阳性的植株进行RT-PCR检测,结果(图6)显示,有4株能够扩增出目的基因大小条带,表明MsAP2已经在紫花苜蓿植株中成功转录表达。
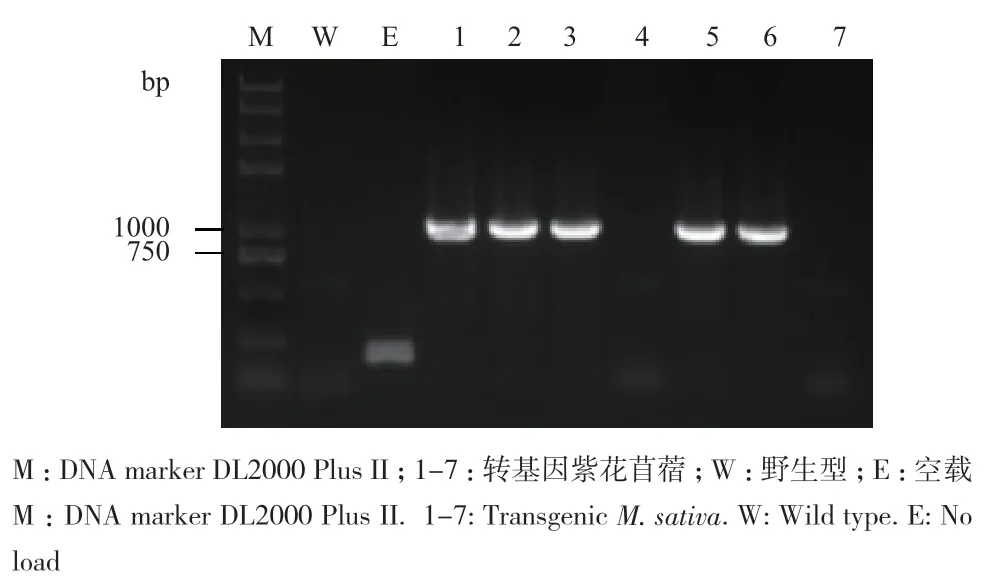
图5 转基因紫花苜蓿DNA检测Fig. 5 DNA detection of transgenic M. sativa
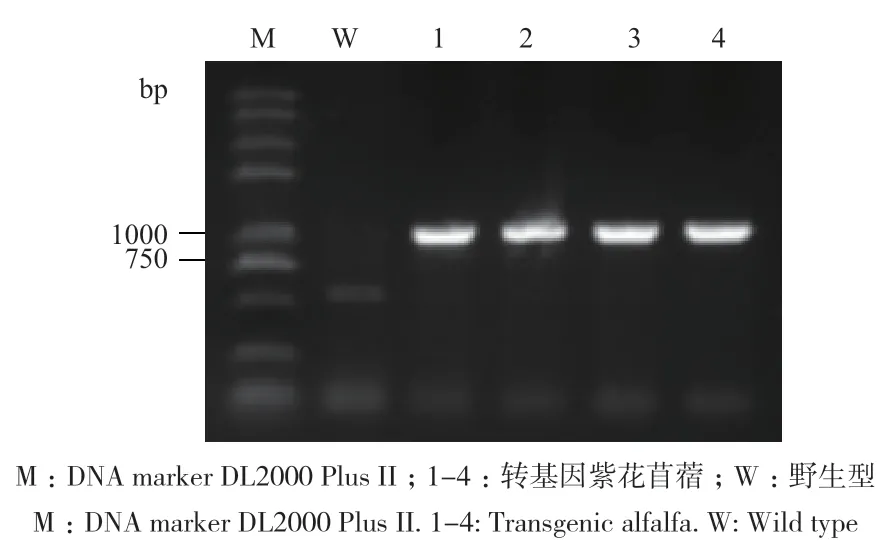
图6 转基因紫花苜蓿的RT-PCR检测Fig.6 RT-PCR detection of transgenic M. sativa
通过对转基因植株进行蛋白免疫印迹杂交试验,获得一条清晰且单一的蛋白质条带,大小约为35 kD,而野生型植株则没有条带(图7),表明MsAP2在紫花苜蓿中能够成功翻译出蛋白质,并且蛋白质分子量约为35 kD。

图7 转基因紫花苜蓿的蛋白质检测Fig.7 Protein detection of transgenic M. sativa
2.5 转基因植株的基因表达分析
对转MsAP2紫花苜蓿和野生型植株进行MsAP2表达量的分析。结果(图8)表明,转基因植株AP2-2、AP2-3和AP2-4的MsAP2相对表达量显著高于野生型(P<0.05)。AP2-1的基因表达量最低,且显著低于野生型,说明转入的外源MsAP2抑制了AP2-1内源MsAP2的表达且转入的外源MsAP2的表达量也很低,所以AP2-1显著低于野生型(P<0.05),而转入外源MsAP2对AP2-2、AP2-3和AP2-4植株的内源MsAP2表达未见抑制作用,同时外源基因表达量增加,所以显著高于野生型(P<0.05),其中转基因植株AP2-3的基因表达量为最高水平。

图8 转基因紫花苜蓿的MsAP2相对表达量Fig.8 Relative expression of MsAP2 gene of transgenic M.sativa
2.6 转基因植株的激素含量
通过对转MsAP2植株和野生型植株利用酶联免疫法测量植物内源激素含量,结果表明,除AP2-1外,其他转基因植株生长素含量均显著高于野生型,AP2-3转基因植株生长素含量最高,为211.62 ng/g·fw,AP2-1转基因植株含量最低,为93.61 ng/g·fw;转基因植株的玉米素含量整体呈下降趋势,且显著低于野生型,AP2-3转基因植株较野生型无显著差异(P<0.05);转基因植株的脱落酸含量呈上升趋势,显著高于野生型植株(P<0.05);除AP2-3外,其他转基因植株的赤霉素含量均呈下降趋势,显著低于野生型(图9)。

图9 转基因紫花苜蓿激素含量Fig.9 Plant hormone contents of transgenic M. sativa
2.7 转基因植株的表型分析
通过比较转基因植株与野生型表型,发现转基因植株AP2-1的分枝数显著增多,而转基因植株AP2-3的分枝数明显减少(图10),结合MsAP2相对表达量,可知转基因植株AP2-1的MsAP2表达量最低,转基因植株AP2-3的MsAP2表达量最高,推测MsAP2的表达可能抑制了紫花苜蓿分枝相关基因的表达,从而使分枝数减少,MsAP2对紫花苜蓿分枝数起到了负调控的作用从而间接影响了植株生物量的变化。

图10 转基因植株与野生型对比Fig.10 Comparison of transgenic and wild-type plants
同野生型相比,转基因植株普遍呈现早衰现象(图11),转基因植株的叶片大小和形状也发生改变,野生型叶片为正常的长卵形且先端锐尖或钝圆,而转基因植株叶片为卵圆形且叶片先端向内凹陷(图 12)。

图11 转MsAP2植株与野生型植株Fig.11 MsAP2 transgenic plants and wild-type plants

图12 转基因植株与野生型叶片对比Fig.12 Comparison of transgenic and wild-type leaves
转基因植株从组织培养阶段就表现出生根缓慢的现象,通过进一步的霍格兰水培试验,结果表明,转基因植株较野生型相比根系的再生速度变慢,生根能力受到抑制,其中转基因植株AP2-1受抑制作用明显,且根系的生长发育存在缺陷,抑制主根生长主根变短且更细弱无侧根生长(图13)。结合转MsAP2植株的激素含量来看,转基因植株的脱落酸含量整体呈上升趋势会抑制细胞的分裂和生长所以导致植株整体生根缓慢,转基因植株AP2-1的生长素含量显著低于其他转基因植株,综合脱落酸和生长素的含量变化,转基因植株生根受到抑制作用,且转基因植株AP2-1受抑制作用明显。

图13 转基因植株与野生型根系对比Fig.13 Comparison of transgenic and wild-type roots
3 讨论
在紫花苜蓿的遗传转化过程中,及时调整组织培养各阶段培养基的生长素和细胞分裂素配比使之更适合不同阶段的生长需要,有研究表明在一定浓度范围内,随着2,4-D和6-BA的浓度增加,出愈率和诱导率呈增加的趋势,2,4-D的诱导发芽率明显优于6-BA[14],本研究也加入了2,4-D和6-BA,通过对激素浓度进行梯度试验,在1 L MS培养基中加入4 mg的2,4-D和1 mg的6-BA时最适合紫花苜蓿的愈伤组织培养。在培养基中加入适当的KT和2,4-D能够促进胚性愈伤组织诱导率、使愈伤组织出现的时间提前[15],本试验在遗传转化过程中经过多次探索试验,在加入1 mg的KT时,不仅胚性愈伤组织诱导率增加,愈伤组织的诱导发芽率也得到了提高,这为后面的植株生长提供了良好的材料基础,最终顺利得到转MsAP2植株。
转GmRAV基因烟草植株的生长发育受到严重抑制作用,与野生型相比植株矮化严重,叶片变小变薄更幼嫩,根的伸长程度变短,根系变得更短和细弱,叶片中的叶绿素含量明显降低,光合速率明显下降[2],叶片是植物光合作用的主要场所,是植物合成有机物的场所,植物的光合作用减弱会显著降低植物对有机物的积累从而影响植物的生命活动及生长发育进程,如器官的发育,从而导致叶片的发育存在缺陷,对于MsAP2表达对紫花苜蓿叶绿素含量变化以及对光合速率的影响还需对转MsAP2紫花苜蓿做进一步的试验来探究。
转基因植株普遍早衰,根系再生能力减弱,生长受抑制且转基因植株AP2-1的根系生长受到严重抑制。转基因植株的生长素和脱落酸含量上升,其中1号植株的生长素含量低于其他转基因植株。生长素是植物体中的一类天然内源激素,能够参与调控植物的生长发育如器官的发育、种子萌发、维管束发育、根系生长,抑制侧芽生长等,有研究表明高浓度的生长素有利于根原基的形成,促进根系的生长[16-18]。脱落酸可以使植物叶片变黄并加速其衰老脱落,诱导衰老基因表达[19-20]。转MsAP2植株的脱落酸含量普遍升高,植株整体呈现早衰趋势,而生长素含量过高也会加速植株的衰老进程。转基因植株AP2-3的赤霉素和生长素含量显著高于转基因植株AP2-1,赤霉素是植物体内的一种重要植物激素,促进细胞分裂与伸长,尤其对茎等营养器官的纵向生长具有明显的促进作用,而生长素也可以促进植物茎节间的伸长[21-22]。
本试验通过RT-PCR技术克隆出MsAP2,通过农杆菌介导法利用转基因技术转入本体紫花苜蓿中,通过遗传转化体系组织培养技术得到转基因植株,初步探究紫花苜蓿中MsAP2的功能,目前还不清楚MsAP2是如何参与调控作用于紫花苜蓿的,且植物单一性状变化可能是由于植物体内多种基因共同调节起作用的结果,所以准确鉴定MsAP2在紫花苜蓿中的功能还需要对转基因植株进行下一步的试验来分析和验证。本试验为后续MsAP2在紫花苜蓿中的研究提供了理论指导和材料基础,也为利用分子育种技术改良苜蓿性状提供了参考价值。
4 结论
成功获得了转MsAP2紫花苜蓿植株,在对转基因植株进行分析研究发现,MsAP2能够加快转基因紫花苜蓿的生长进程使植株早衰,改变叶片的大小和形态,抑制根系再生,是紫花苜蓿分枝数的负作用因子,对生长素和脱落酸的合成与运输起到促进作用,调节植物体内的赤霉素和玉米素核苷的含量变化。