不同栽培基质诱导对香菇液体发酵产漆酶活性的影响
熊雪 李鹏 张贵合 向准 陶文广 周光燕 和耀威
(1. 贵州省生物研究所,贵阳 550009;2. 贵州农业职业学院,贵阳 551400)
香菇(Lentinula edodes)是世界上第二大食用菌类别[1],因其独特的鲜香口感,丰富的维生素和氨基酸,并皆具多种保健功能一直被大众喜爱[2],市场价值极高。尤其在“十三五”期间,聚焦国内“脱贫攻坚”、“产业扶贫”等政策,食用菌产业被列为脱贫主导产业大力发展之后,香菇作为我国生产区域最广、总产最高、影响最大的菇类,也随之成为南北方贫困地区实施产业精准扶贫的主导产业,其栽培规模更是成倍增长。据调查,作为西南山区贫困代表的贵州省,2018年香菇总产量已达42.4万t,占贵州省食用菌总产量的47%。现被贵州引种栽培的香菇品种繁多,但较为适宜贵州山区气候的品种且栽培面积较广的有香菇808及庆科系列香菇,如庆科212、庆科R20等。
香菇在自然界中是一类重要的白腐真菌,广泛的分布在林区落叶阔叶树的腐木上,具有较强的木质纤维素降解能力。漆酶作为主要的木质素降解酶,参与香菇生长发育的每一个阶段[3],在一定程度上可以反映为菌株生长和菌丝对基质的利用率[4]。在现行国家行业标准中,香菇菌棒以木屑为主,麦麸、玉米芯或棉籽壳等为辅进行不同比例搭配而成,不同的菌棒配方香菇的产量和品质差异较大[5-7]。故本文选用贵州主栽品种香菇808、庆科R20以及贵州特有马桑香菇为研究对象,初步研究了香菇菌株间的区别性差异,并以香菇袋料栽培常用基质麦麸、玉米芯和青杠木屑、马桑木屑为诱导基质进行液体发酵培养,初步探讨香菇不同菌株产漆酶能力,旨在得到高产漆酶的栽培基质,从而为提高和改善香菇的产量和品质奠定理论基础,助推贵州香菇产业振兴。
1 材料与方法
1.1 材料
马桑香菇、香菇808及庆科R20菌株由贵州省食用菌工程技术研究中心提供,现保存于贵州省生物研究所。
1.2 方法
1.2.1 培养基 固体活化培养基:马铃薯(去皮)200 g,葡萄糖 20 g,KH2PO43 g,MgSO4·7H2O 1.5 g,维生素B110 mg,琼脂粉20 g,去离子水1 L,pH自然。
PDA培养基:马铃薯(去皮)200 g,葡萄糖20 g,琼脂粉20 g,去离子水1 L,pH自然。
种子液培养基:马铃薯(去皮)200 g,葡萄糖20 g、酵母膏10 g,定容至1 L,121℃灭菌30 min。
诱导培养基:以葡萄糖10 g,蛋白胨2 g、MgSO4·7H2O 0.5 g、K2HPO4·3H2O 1 g、KH2PO40.46 g,定容至1 L,为基础培养基。分别于100 mL基础培养基中加入3 g孔径粒度为20-60目的马桑木屑(BM+MS)、青杠木屑(BM+QG)、玉米芯(BM+YMX)、麦麸(BM+MF)诱导物,121℃灭菌30 min。
1.2.2 香菇菌株间的区别性鉴定 将保存的马桑香菇、香菇808、庆科R20分别接种于活化培养基上,25℃恒温活化8 d,备用。
(1)拮抗试验。接种组合为2组。第一组:同种供检菌种,于同一PDA平板上各接种1个接种块;第二组:3种供检菌种,于同一PDA平板上各接种1个接种块,每组3个重复,分别进行对峙培养。
(2)建立香菇系统发育树。采取购买的生工生物工程(上海)股份有限公司Ezup柱式真菌基因组DNA抽提试剂盒提取分离纯化3种香菇菌株基因组DNA,提取之后的DNA选用真菌通用引 物(ITS1:TCCGTAGGTGAACCTGCGG;ITS4:TCCTCCGCTTATTGATATGC)进行PCR扩增。采用25 μL的PCR反应体系:基因组DNA(基因组20-50 ng/μL)0.5 μL ;10×buffer( 含 Mg2+);dNTP(各 2.5 mmol/L)1 μL;Taq酶 0.2 μL;正向引物 F(10 μmol/L)0.5 μL ;反 向 引 物 R(10 μmol/L)0.5 μL;加去离子水至25 μL。反应程序为94℃预变性4 min,94℃变性45个循环,55℃退火45个循环,72℃延伸1 min,30个循环,72℃延伸8 min,4℃终止反应保存。扩增得到的PCR产物经1.0%琼脂糖电泳检测扩增结果后,送生工生物工程(上海)股份有限公司测序,测序后登陆GenBank对比,通过BLAST对测序结果进行比对分析,下载最相近菌株的ITS rDNA序列,并构建系统发育树。
(3)不同温度生长速度测定。按照国家农业部颁布的中国人民共和国农业行业标准NY/T 2560-2014《 植物新品种特异性、一致性和稳定性测试指南 香菇》中香菇菌丝生长阶段的测定方法对3种香菇菌株菌丝进行不同温度生长测试。
取3种香菇备用活化平板,使用打孔器打取直径5 mm接种物,接种于PDA平板上,分别置于10、15、20、25、30℃下培养,观察菌丝生长情况。菌丝生长速度测定采用“十”字交叉法,从菌丝萌发开始,每24 h测量一次,同时记录菌丝萌发时间,菌丝日均生长速度以吃料后菌落平均每日直径增长量统计。菌丝铺满平板时,观察记录菌落的菌丝形态、色泽、菌落形状、菌丝长势和边缘特征等,用“+”、“-”表示菌丝的长势,“+”越多表示菌丝生长得越好、越健壮、均匀,“-”表示菌丝不生长。
1.2.3 液体发酵培养及漆酶活测定方法 取备用活化平板,使用打孔器打取直径5 mm接种物,每100 mL种子培养基中无菌条件下放入5个接种物,25℃、150 r/min摇床避光培养。8 d后取匀浆机将三角瓶内的菌丝球搅拌30 s使其成均质体。分别向100 mL含不同基质培养料的诱导培养基(BM+MS、BM+QG、BM+YMX、BM+MF)中加入3 mL搅拌均匀的香菇均质体,于25℃、150 r/min摇床避光培养,每个处理3个重复。
发酵液经双层滤纸抽滤后,并于5℃低温条件下12 000 r/min离心20 min,上清液即为粗酶液。
漆酶活性的测定:3 mL反应体系中含1 mL 1 mmol/L 2,2′-连氮 - 双(3-乙基苯并噻唑 -6-磺酸)[2,2′-azino-bis(3-ethylbenzthiazoline-6-sulphonicacid),ABTS]底物、1.9 mL 50 mmol/L醋酸-醋酸钠缓冲液(pH 4.2)和100 μL适当稀释的酶液,于420 nm处测定5 min内的吸光值变化。定义每分钟转化1 μmol ABTS所需的酶量为一个活性单位(U)。ABTS在420 nm处摩尔吸光系数为3.6×104L(/mol·cm)。从培养后第2天开始测定其漆酶活性,连续测至培养12 d。
1.2.4 数据处理 利用EXCEL和SPSS 18.0对所得数据进行整理,并进行显著性分析和双因素方差检验(two-way ANOVA)。
2 结果
2.1 香菇菌株间的区别性鉴定
2.1.1 拮抗试验 拮抗是检测自身同其他种间是否有差异的传统手段,亲缘关系较近的菌株之间无拮抗或拮抗不明显,而亲缘关系较为疏远、不同遗传背景的菌株之间则拮抗作用十分明显[8-9]。由表1和图1可知,马桑香菇、香菇808、庆科R20菌株自身均无拮抗反应,马桑香菇同庆科R20和香菇808之间存在明显的色素沉淀和拮抗沟,说明马桑香菇同庆科R20和香菇808之间拮抗作用明显,即马桑香菇菌株同庆科R20和香菇808菌株间存在差异。而庆科R20和香菇808之间虽然存在沟型,但并无明显色素产生,说明庆科R20和香菇808间拮抗作用不明显。
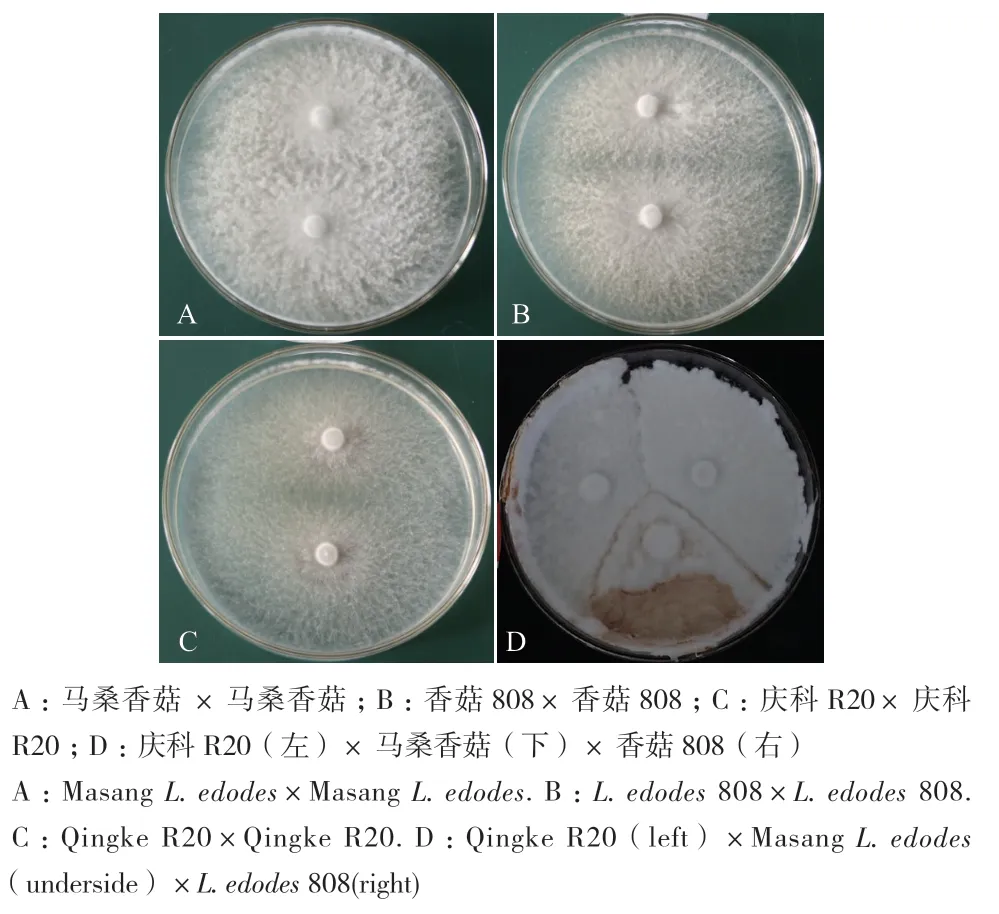
图1 3种香菇拮抗反应Fig. 1 Antagonistic reaction of 3 kinds of L. edodes strain
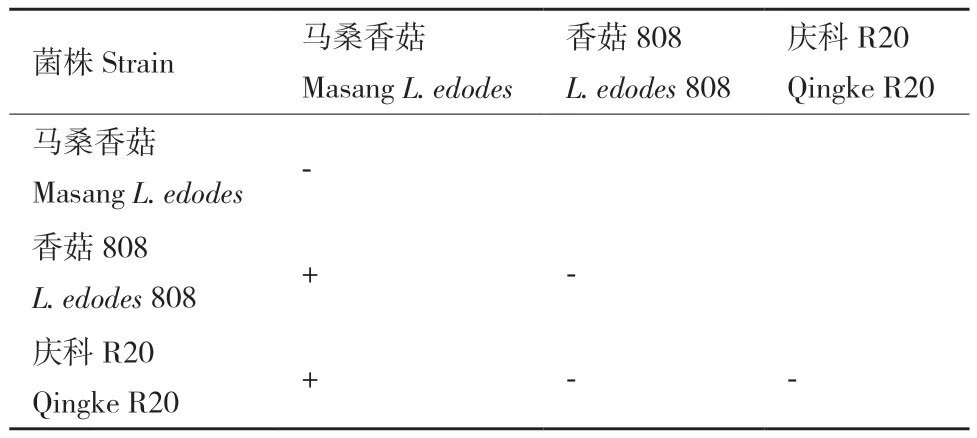
表1 3种香菇拮抗试验对比Table 1 Antagonistic reaction of 3 kinds of L. edodes strain
2.1.2 建立香菇系统发育树 3种香菇菌株的DNA提取结果见图2。由图2可知,香菇菌株DNA条带清晰,DNA的浓度、纯度以及产率均比较高,可用于PCR扩增。
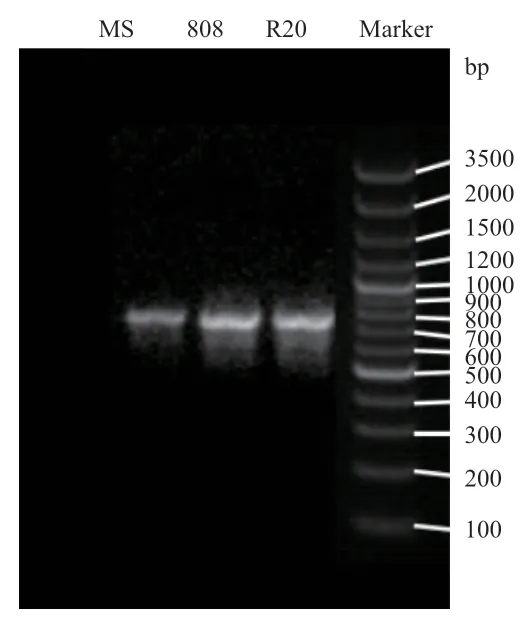
图2 3种香菇菌株rDNA ITS区段的PCR产物Fig. 2 PCR products of the rDNA ITS segments of the 3 kinds of L. edodes strain
经PCR扩增和序列测定,结果显示3种香菇菌株rDNA ITS区段长度均在700-800 bp之间,且所得序列经Blast搜索,击中结果均为Lentanula edodes,下载其相近序列10条,并结合香菇属下其他种rDNA序列:Lentinula aciculospora、L. boryana、L. lateritia、L. madagasiksrensis、L. novaezelandiae、L.raphanica(每种随机挑选2条),共同构建系统发育树(图3)。系统发育树表明,3种供试菌株均为有机香菇Lentanula edodes,与其他香菇属下种有本源差异,且3种香菇分别为有机香菇下的不同分支,且分支较远,说明菌株间有差异。
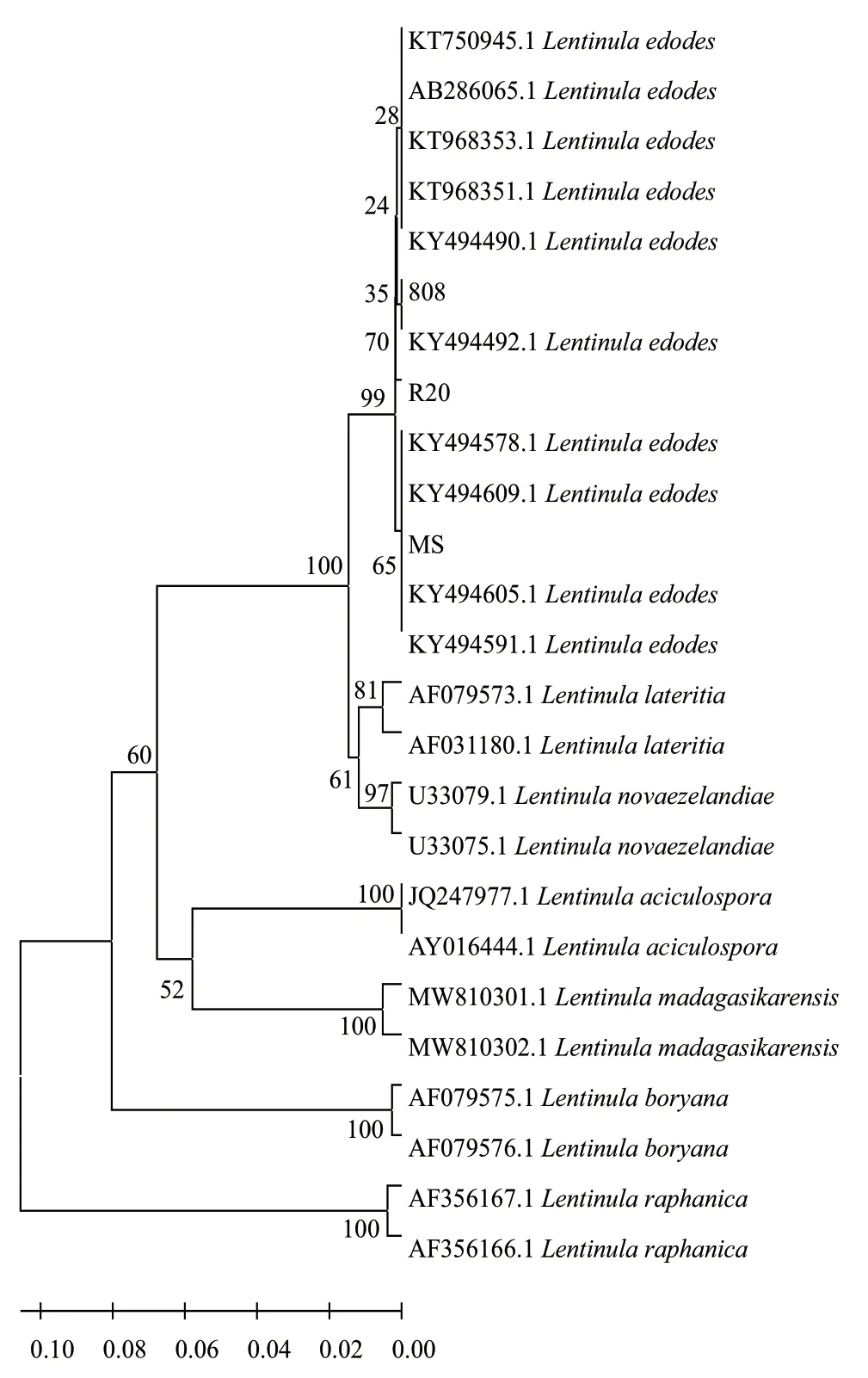
图3 基于ITS序列构建的香菇系统发育树Fig. 3 Phylogenetic tree of L. edodes constructed based on ITS sequence
2.1.3 不同温度条件对3种香菇生长的影响 结合表2和图4可知,在所设温度范围内,供试马桑香菇、香菇808和庆科R20菌株菌落均呈绒毛状白色圆形菌落,其日均生长速度随温度升高均呈先增后减的趋势,且在P<0.05水平上有差异,峰值均在25℃条件下,分别为0.89、0.85和0.89 cm/d。
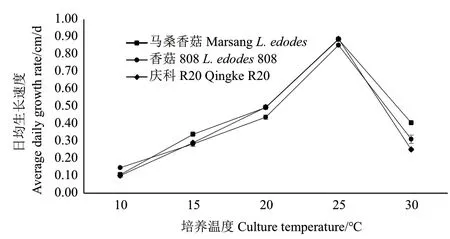
图4 不同温度条件下香菇菌丝日均生长速度Fig. 4 Average daily growth rate of L. edodes under different temperature conditions

表2 不同温度条件对3种香菇菌株生长的影响Table 2 Effects of different temperature conditions on the growths of 3 kinds of L. edodes strain
马桑香菇在所设温度范围内菌丝日均生长速度依次为 25℃>20℃>30℃>15℃>10℃,且在 15-30℃下菌落长势较好,其中20-25℃下最佳。说明马桑香菇菌丝适宜温度范围较广,最适温度为25℃,且中低温较中高温条件下菌丝生长更好。香菇808在所设温度范围内菌丝日均生长速度依次为 25℃>20℃>30℃>15℃>10℃,且在 20-30℃下菌落长势较好,其中25-30℃下最佳。说明香菇808菌丝适宜温度范围较广,最适温度为25℃,且中高温条件下菌落长势较好。庆科R20在所设温度范围内菌丝日均生长速度依次为25℃>20℃>15℃>30℃>10℃,且在 15-25℃下菌落长势较好,最佳为25℃,且该温度下菌丝生长也最快。说明庆科R20最适温度为25℃,且中低温条件较中高温条件生长更好且更快。
综上,说明3种香菇菌株菌丝生长速度受温度影响较大,但菌落长势受温度影响较小,且虽然不同菌株的最适温度均为25℃,但对中高温和中低温有不同的倾向性。
2.2 不同香菇菌株对漆酶活性的影响
双因素方差检验结果显示,香菇不同菌株在不同培养基中的产漆酶能力各不相同,且在整个培养过程中,香菇液体产漆酶活性受菌株遗传差异和不同栽培基质的影响均为极显著(P<0.001)。
由表3、图5可知,连续12 d培养中,同一诱导培养基上3种香菇菌株液体产漆酶活性有差异,且菌株对香菇液体产漆酶活性皆具有极显著的影响(P<0.001)。

图5 3种香菇菌株在不同诱导培养基上液体发酵产漆酶活性对比Fig.5 Comparison of the laccase production activities of 3 kinds of L. edodes strains in liquid fermentation on different induction media
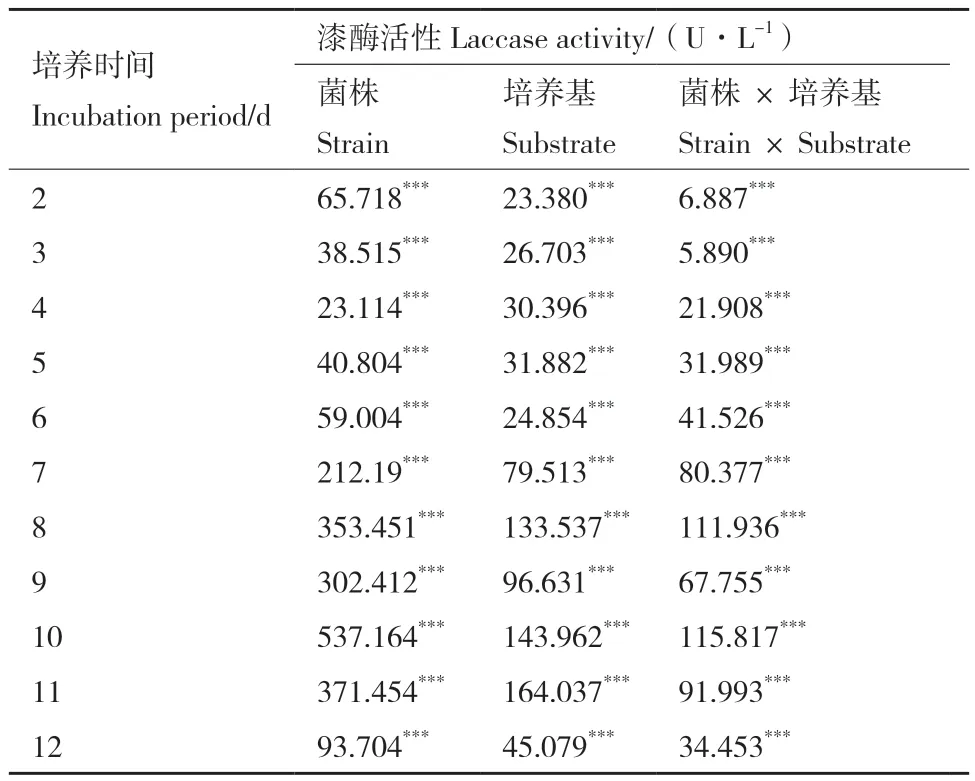
表3 4种栽培基质对不同香菇漆酶活性的影响Table 3 Effects of 4 cultivation substrates on the laccase activities of different L. edodes
整个培养过程中,不同菌株在相同的培养基上产漆酶活性有差异,所有菌株在连续培养12 d的漆酶活性变化趋势均为先升后降,且培养前期活性较低,后期漆酶旺盛。具体表现为培养期前6 d,在所有诱导培养基中,菌株香菇808和马桑香菇均能检测到相对较弱的漆酶活性,但不稳定,且呈波浪状上升;而庆科R20仅在含玉米芯(BM+YMX)、麦麸(BM+MF)诱导培养基中能检测到较弱的漆酶活性,而在含马桑木屑(BM+MS)诱导培养基中,前6 d均未能检测到漆酶活性,在含青杠木屑(BM+QG)诱导培养基中,直至第6天才检测出微弱的漆酶活性,平均酶活仅为0.16 U/L。
而对整个培养期而言,香菇808产漆酶能力在含马桑木屑(BM+MS)、青杠木屑(BM+QG)及玉米芯(BM+YMX)的诱导培养基上较马桑香菇和庆科R20具有明显优势,其漆酶活性最大分别达到238.64、288.94和464.06 U/L,且该峰值分别出现在第8天、第10天和第9天。此外,在BM+MS培养基上,庆科R20产酶能力最低,酶活性峰值出现在第11天,达41.75 U/L;在BM+YMX培养基上,所有菌株产漆酶能力均较高,其中最低的是马桑香菇,酶活性峰值达237.15 U/L,也于培养第11天出现;而在BM+QG培养基上,马桑香菇菌株较庆科R20先检测到酶活,但培养8 d后,产酶能力开始略低于庆科R20,最大酶活仅为22.08 U/L比庆科R20峰值(35.82 U/L)低13.74 U/L。在BM+MF培养基中,庆科R20较其他2种菌株产漆酶优势明显,并于培养第10天达到峰值,酶活达265.07 U/L;香菇808产酶能力略低于庆科R20,最大酶活峰值于培养第9天出现,酶活达205.44 U/L;马桑香产酶能力最低,但在培养第6-10天之间快升快降,酶活峰值出现在第8天,达161.83 U/L。
综上可知,诱导基质相同时,不同香菇菌株液体产漆酶的能力强弱不同,相对菌株马桑香菇和庆科R20,香菇808在含马桑木屑、青杠木屑及玉米芯的诱导培养基中液体产漆酶能力最强;而基质麦麸对庆科R20的诱导力更强;马桑木屑对马桑香菇的诱导力仅低于香菇808,青杠木屑诱导下,马桑香菇和庆科R20的产酶能力相当,说明菌株的遗传差异对漆酶活性大小有影响,同双因素方差检验结果一致。
2.3 不同栽培基质对香菇产漆酶活性的影响
由表3、图6可知,连续12 d培养中,在4种诱导培养基上同一菌株液体产漆酶活性有差异,且培养基对香菇液体产漆酶活性皆具有极显著的影响(P<0.001)。整个培养过程中,菌株马桑香菇、香菇808和庆科R20在4种不同诱导培养基发酵产漆酶活性均随培养时间呈现先增后降的趋势,但出现达到峰值的时间有差异,主要集中在第8-11天之间。
在不同培养阶段,4种栽培基质诱导对马桑香菇产漆酶能力强弱不同,BM+MS、BM+QG培养下,马桑香菇酶活峰值出现在培养后期(第10天),酶活性分别为108.61和22.08 U/L,且整个培养过程马桑木屑均表现出强于青杠木屑的诱导力。4种基质中,以BM+MF培养下马桑香菇漆酶活性变化最为剧烈,且酶活峰值最高,出现在培养中期(第8天),值为161.83 U/L,且在7-9 d酶活远高于BM+MS培养。而在BM+YMX培养下前10 d,马桑香菇漆酶活性均较BM+MS、BM+MF培养基低,在第10天后其活性远高于BM+MF培养基,第11天后略高于BM+MS培养基,酶活峰值出现在培养后期(第11天),酶活为117.81 U/L。
菌株香菇808在整个培养过程中其诱导产漆酶活性表现出明显优势的是BM+YMX培养基,其变化峰值出现在第9天,活性为464.06 U/L。而整个培养期,香菇808在培养基BM+MS、BM+QG及BM+MF培养下的产漆酶能力变化趋势相互交错(图6),其酶活峰值分别出现在培养期第8、9和10天,酶活分别为238.64、205.44和288.94 U/L;且在培养前9 d,培养基BM+MS诱导力优势明显,培养基BM+QG诱导力最低,培养9 d后,培养基BM+QG诱导力优势明显,培养基BM+MS最低。
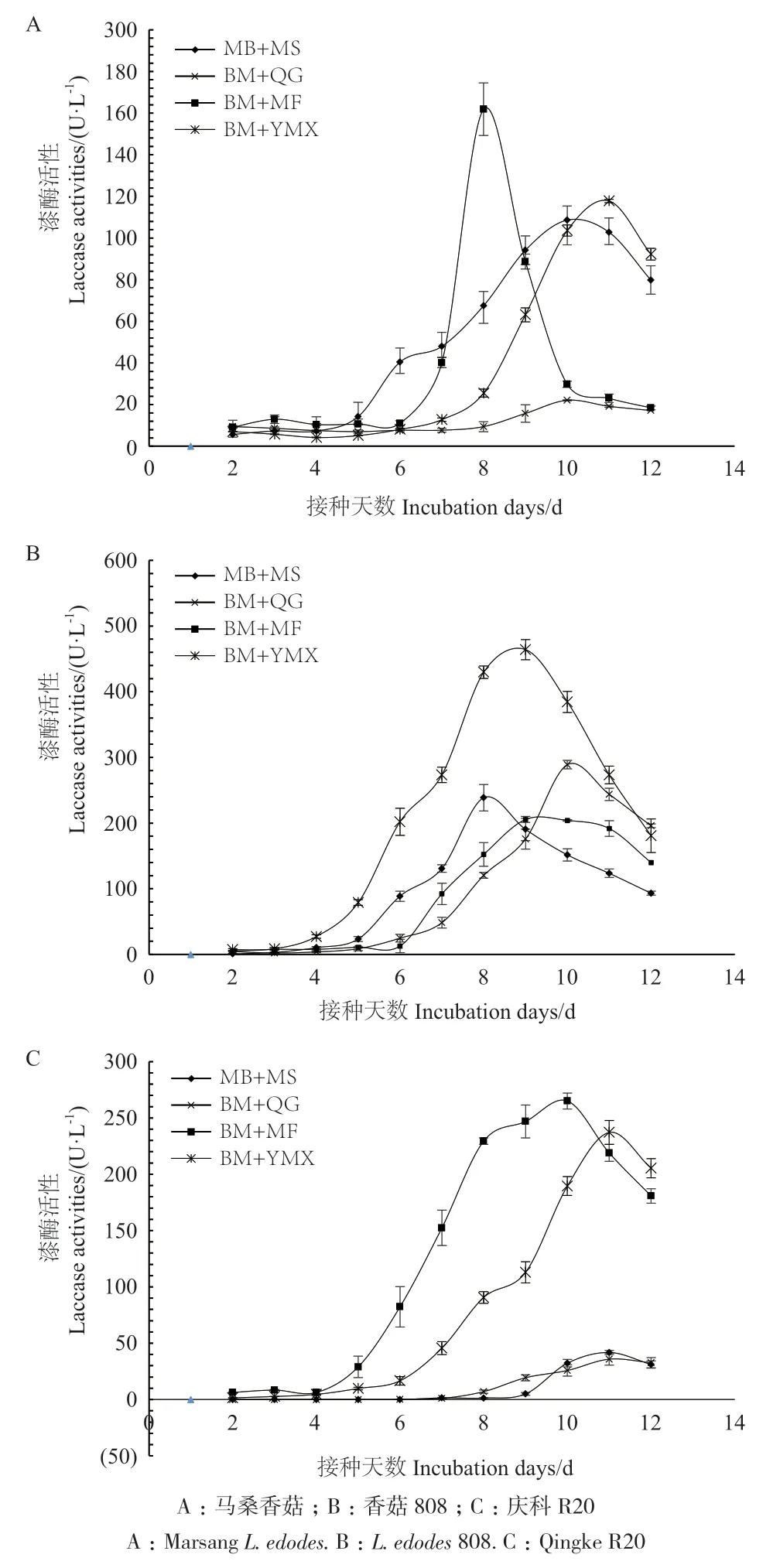
图6 不同栽培基质对香菇液体发酵产漆酶活性的影响Fig.6 Effects of different cultivation substrates on laccase production activities of different L. edodes strains
培养过程中,菌株庆科R20在BM+MF培养基产漆酶活性较其他培养基优势明显,其次为BM+YMX培养基,其最高酶活性分别为265.07和237.15 U/L。BM+QG和BM+MS分别于培养第6天和第7天后方才检测出微弱的漆酶活性,且整个培养期两种培养基的最高酶活仅为35.82和41.75 U/L。
综上可知,同一菌株在受到不同的栽培基质诱导时,液体产漆酶活性有差异。4种栽培基质中,除青杠木屑外,其他基质均对马桑香菇产漆酶有较强的诱导力,且基质麦麸对诱导马桑香菇产漆酶的时间最为集中且反应迅速,但高水平诱导力更持久的是马桑木屑,而基质玉米芯对香菇808的产漆酶诱导力最强,麦麸对庆科R20产漆酶的诱导力麦麸最强。这表明,栽培基质的差异能直接影响菌株漆酶的分泌情况,同双因素方差检验结果一致。
3 讨论
漆酶是一种含铜的多酚氧化酶,主要存在于植物和真菌中,其中植物漆酶主要参与形成木质素,而真菌漆酶的作用则是降解木质素[10],也是分解木质素的三大酶类中最具代表性的酶类[11-12]。漆酶在食用菌生产中可以直接反映木质素降减情况[13],间接反映食用菌菌丝活力、产量和品质[14-16]。本试验以贵州香菇主栽品种香菇808、庆科R20以及贵州特有马桑香菇为研究对象,初步研究了香菇菌株间的区别性差异及不同栽培基质诱导下3种香菇液体发酵产漆酶活性连续12 d的变化。研究表明马桑香菇、香菇808和庆科R20虽均同为香菇属的下属分支,但菌株间是有区别的,存在一定种源差异。此外,香菇液体产漆酶活性受菌株遗传差异和不同诱导培养基的影响均为极显著,但各处理漆酶整体变化规律均呈现先升后降的趋势。这说明菌株和诱导物的差异仅对漆酶活性大小有影响,但不改变漆酶的变化规律。这一结果在诸多漆酶变化研究中均有体现[17-19]。
3种菌株在培养初期所有处理检测到的酶活性均较低,庆科R20在两种木屑诱导培养基上甚至无法检测到漆酶活性,这除了同菌株间的遗传差异有关外,很大因素可能是因为香菇菌丝在生长过程中对营养物质吸收顺序有一定选择性造成的。一般来说,香菇菌丝吸收营养物质时,会将淀粉、纤维素、半纤维素先降解吸收,最后才降解木质素[3,20-21]。香菇808作为开发较为成熟且全国栽种广泛的香菇品种,在含马桑木屑、青杠木屑及玉米芯的诱导培养基中液体产漆酶能力均是最强,其中以玉米芯诱导力最强,且在含麦麸的诱导培养基上产酶能力也仅低于庆科R20,这说明香菇808对4种基质木质素都有较强的降解能力。庆科R20是低温型香菇品种,在含麦麸、玉米芯的培养基上产漆酶能力明显优于两种木屑培养基,其中基质麦麸对其产漆酶诱导力最强。在以往香菇漆酶的研究中,明确指出漆酶参与香菇生长发育的每一个阶段,是香菇生长关键酶,其活性越高,香菇转色时间越早,出菇时间也越早,并且其活性与香菇产量呈显著正相关[3,14]。这表明香菇808、庆科R20在制种过程中用马桑木屑或青杠木屑作原料时,香菇808应比庆科R20长势更佳,但添加玉米芯或麦麸,都是能促进两种香菇菌丝对木质素的降解吸收的。而马桑香菇菌株是由生长于马桑树上的贵州特有野生香菇选育而来的,其味道比一般香菇更鲜香,营养价值也更为丰富[22-23],但目前栽培上不管是椴木栽培还是袋料栽培,其主要原料均基于马桑木材。本文所选4种基质中,除青杠木屑外,其他基质均对马桑香菇产漆酶有较强的诱导力,且基质麦麸对诱导马桑香菇产漆酶的时间最为集中且反应迅速,但高水平诱导力更持久的是马桑木屑,这说明,马桑香菇对马桑木屑具有一定的偏好性,栽培基质中适当添加可以提高菌丝体的生长速度和产量,这与徐彦军等的研究结果一致[24]。而基质麦麸和玉米芯对马桑香菇产漆酶的诱导力同马桑木屑差距不大,理论上是可以适量增加这些基质在配方中的占比,从而减少马桑香菇产业发展对马桑木材带来的用料压力的,但具体用量比例需进一步研究。
4 结论
马桑香菇、香菇808和庆科R20虽均同为香菇属的下属分支,但菌株间存在一定种源差异。此外,香菇液体产漆酶活性受菌株遗传差异和不同诱导培养基的影响均为极显著。香菇808在含玉米芯、马桑木屑及青杠木屑的诱导培养基中液体产漆酶能力均为最强,最大酶活分别为464.06、238.64、288.94 U/L。而麦麸对庆科R20的诱导力更强,最大酶活达265.07 U/L;麦麸对诱导马桑香菇产漆酶能力短时间内最强,最大酶活达161.83 U/L,但高水平诱导力更持久的是马桑木屑,最大酶活达108.61 U/L。综上,从产漆酶水平上看,香菇808、庆科R20和马桑香菇对4种基质木质素降解吸收能力差异较大,最佳基质分别为玉米芯、麦麸和马桑木屑。