基于铂纳米团簇的生物传感研究进展
王鹏飞 杨敏 朱龙佼 许文涛
(中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083)
近年来,由几到几百个贵金属原子(如Au、Ag和Pt等)组成的贵金属纳米团簇(metal nanoclusters,M NCs)得到了越来越多的重视。当尺寸接近电子的费米波长(即<2 nm)时,M NCs由于量子限制,连续态密度分解为离散的能级[1],从而表现出类似于离散的分子特征[2]。因此,M NCs展示出与其他纳米材料截然不同的独特的光、电和化学性质[3]。在众多金属纳米团簇之中,铂纳米团簇(platinum metal nanoclusters,Pt NCs)由于其出色的反应活性、光学特性、催化活性、导电性和生物相容性等,被广泛应用于生物传感和医学成像。
尽管Huang等[4]已经在2019年综述了Pt NCs在合成、物理和化学性质、生物成像和癌症治疗方面的应用,但有关新兴的生物传感器方面的应用还未涉及。因此,在这篇综述中,我们概述了Pt NCs的合成、性质及其近几年中在传感应用中的最新进展。首先,我们总结了不同配体合成Pt NCs的方法及其理化特性。在此基础上,我们进一步强调了近年来基于Pt NCs的荧光生物传感器、纳米酶生物传感器,电化学传感领域以及生物成像等方面的进展,并对Pt NCs目前存在的不足及未来的发展趋势进行展望,以期为研究者提供借鉴。
1 铂纳米簇的合成
在过去的几十年中,包括聚合物,蛋白质和肽以及DNA在内的各种模板已被用于合成Pt NCs,它们不仅充当Pt NCs形成和稳定的支架,而且还提供了合成基于Pt NCs纳米复合材料的条件。此外,Pt NCs的大小,结构和特性与模板和环境高度相关,因此可以调整合成的模板和环境来调整Pt NCs的理化特性。
常用的模板通过以下3种主要方式赋予Pt NCs新的独特功能或特定结构:(1)降低表面能,以防止NCs通过静电相互作用,化学键合和空间位阻效应聚集;(2)准确控制Pt NCs的大小,分散性和形态,这将深刻影响其固有功能;(3)对Pt NCs的表面进行装饰和修饰,以赋予一些反应性官能团,以实现进一步的应用。理想的模板总是包含富电子原子(例如N、P、S和O)或某些官能团(如-COOH、-NH2、-OH和-SH)。为了更好地理解Pt NCs的形成和特性,我们在这里讨论了影响其形态和功能的不同模板。
1.1 以聚合物为模板合成
在过去的几十年中,具有丰富羧基的聚合物在模板辅助合成M NCs中显示出巨大潜力。多种聚合物已被用作支架来制备Pt NCs,如聚(2-羟乙基-2-巯基乙基天冬酰胺)(poly(2-hydroxyethyl-2-mercaptoethyl aspartamide),PHMA)[5], 阳 离 子 聚合物聚乙烯亚胺(polyethyleneimine,PEI)[6]。此外,具有特殊结构的高分子聚合物如树枝状大分子同样具有优异的性质可作为NCs的合成模板。由于具有均匀的结构和从溶液中螯合金属离子的能力,树枝状大分子可以提供预定的形成环境,以精确控制NCs的大小和形态,已被广泛用作制备MNCs的有前途的模板[7]。如苯偶氮次甲基树枝状大分子[8],聚酰胺树状大分子[9],聚酰胺-胺型树枝状高分子(polyamidoamine dendrimer,PAMAM)[10]等。
1.2 以蛋白质和肽为模板合成
由于具有丰富巯基,氨基和羧基的蛋白质可以为金属离子提供许多结合位点,蛋白质作为模板辅助合成M NCs(如Au、Ag和Pt NCs)中受到了广泛的关注。受具有蛋白质模板的M NCs优异的光物理性质和潜在应用的推动,已开发出各种蛋白质来合成荧光Pt NCs。例如,牛血清白蛋白(bovine albumin,BSA)[11],溶菌酶(Lys)[12],以其他蛋白如鸡蛋清(chicken egg white,CEW),四结构域成人血红蛋白(hemoglobin,HGB)为模板合成的Pt NCs同样具有理想的效果。与蛋白质模板化的M NCs相比,肽具有结构简单且分子量小的优势,被肽稳定的Pt NCs不仅具有良好的生物相容性和高生物活性,而且在合成过程中还表现出每种特定氨基酸的重要作用。例如,Yuan等[13]报道了在CTAB的支持下,将预先合成的谷胱甘肽(glutathione,GSH)保护的Pt NPs转移到有机溶剂中,然后形成荧光小的Pt NCs。
1.3 以脱氧核糖核酸(DNA)为模板合成
由于DNA带负电荷的骨架和氮化的核碱基,可以通过简单的静电相互作用或配位相互作用为金属离子提供大量的结合位点[14]。因此,以 DNA作为配体模板可以合成具有高稳定性、生物相容性、特异性和过氧化物酶活性的DNA功能化的纳米材料。目前以DNA为模板合成的金属纳米材料(如金、银和铜等)在生物传感、生物成像及生物医学等领域具有广泛的应用。虽然,以DNA为模板直接合成DNA-Pt NCs未见报道,但Higuchi等[15]首先合成了基于过氧化物酶模拟的DNA-Pt复合物,但未对其Pt复合物的形貌做具体描述。在此前研究的基础上,考虑到杂化双金属纳米材料的优势,Zheng等[16]开发了一种简便的一步法,通过DNA模板法生产Ag/Pt双金属纳米团簇,他们选择了预先优化的富含C的DNA作为合成模板,该模板已被用于模板化合成荧光Ag NCs。由于胞嘧啶碱基对Ag(I)具有很强的亲和力,因此在被NaBH4还原后,Ag(I)可以优先与富含C的DNA相互作用并形成Ag NCs。然后,Pt(0)的生长将由 Ag NCs表面上的 Ag(0)和 Pt(II)之间的电置换反应来引发,并通过用NaBH4还原而继续进行。由于封装在DNA基质中,因此可以在几纳米尺度上很好地控制沉积的Pt NCs的生长。与之前的研究相比,它们的合成不需要额外的表面活性剂或高温处理。除了单链DNA,双链[17-18]或者三链[19]DNA模板也能合成具有特殊功能的DNA双金属纳米簇。
2 铂纳米簇的性质
2.1 催化性质
人造酶作为天然酶的替代品,具有无标记的结构、高效,出色的稳定性和较低的成本等优势。近年来,已经合成了多种纳米材料,如碳纳米材料、贵金属纳米颗粒、金属氧化物纳米材料和其他复合材料等作为人工酶催化剂(纳米酶),并主要表现出过氧化物酶样活性的显着性质。铂金属纳米材料由于其相较于其他金属纳米材料(如金、银纳米材料)更高的催化活性,成为人造酶中的佼佼者,并吸引了越来越多的关注。
对于铂基催化剂的催化强度有两种常见观点。一种是尺寸对能力的影响:最初的研究表明接近2 nm 的Pt NPs处于催化性能的极限[20]。后来,一系列的研究证明了小于2 nm的Pt NCs能够表现出更好的催化性能[21],其催化活性可以强于普通Pt基催化剂几十倍[22]。另一种是结构对其能力的影响,常见观点认为,具有高对称性的Pt NCs的某些形态(如拓扑幻数结构)可以表现出更高的催化能力[20]。然而,Imaoka等[23]发现与具有高对称性的拓扑稳定的Pt13相比,变形结构的Pt12具有双重催化活性。这是由于具有较少内部Pt-Pt键数量的Pt12的对称性较低以及Pt12的结构转变使尺寸进一步减小造成的。
据报道,基于铂的双金属或杂化纳米结构具有更高的稳定性和催化活性[24]。迄今为止,已经制备了具有各种形貌和尺寸的Pt纳米材料,以获得具有更高催化活性的氧化酶模拟物。此外,具有优异的电导率Pt NCs多被用作电极催化剂[25],已被广泛用于开发具有更高电催化活性的新型电极材料[26]以及具有成本效益的质子交换膜燃料电池[4,27-28]。
2.2 荧光性质
M NCs的应用在很大程度上取决于它们的光学特性,并且有大量研究报告了NCs的独特光学现象。例如,稳态吸收和荧光,温度依赖性荧光,超快荧光和瞬态吸收,荧光增强以及电化学发光[29]。不同的铂的大小和形貌对其荧光的影响起着至关重要的作用,通常,Pt NCs特有的尺寸依赖性荧光是由最高占据分子轨道(highest occupied molecular,HOMO)和最低未占据分子轨道(lowest unoccupied molecular orbital,LUMO)之间的电子跃迁产生的。不同配体保护的Pt NCs具有不同的荧光性质,Pt NCs的发射波长可以从可见光到近红外,但大多集中于蓝、绿和黄光的荧光上。除了表面配体、pH、Pt前体与还原剂的摩尔比等反应条件的改变也会明显影响荧光Pt NCs的发射波长。例如,Huang等[30]发现Pt NCs@PEI的大小和荧光特性与由Pt NCs形成的腔紧密相关,发射波长在酸性条件下会转变为更长的波长(无荧光),在碱性条件下会转变为较短的波长(黄色荧光),当处于中性条件时,发射波长略微移至575 nm。另外,通过调节Pt离子与还原剂L-抗坏血酸(L-AA)的摩尔比,可以制备从发射蓝光到发射黄光的不同发射波长的荧光Pt NCs。蓝色(1∶5),绿色(1∶20)和黄色发光(1∶25)[31](表 1)。
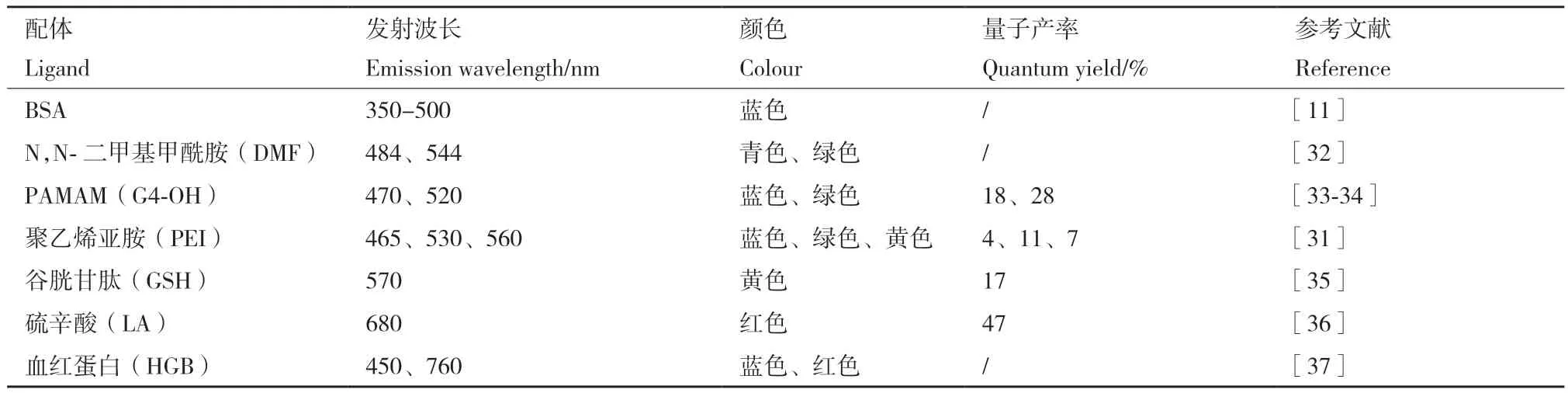
表1 不同配体对荧光Pt NCs的影响Table 1 Influence of different ligands on fluorescent Pt NCs
2.3 其他性质
除了光学和催化性能外,Pt NCs还具有独特的物理特性,如磁性属性[38]和热特性[39]。Ahmadi等[40]证实了Pt NCs中配位不足的原子之间的键长短引起核心电子的局部致密化和量子俘获,使原本导电的电子极化并导致结合能移动,说明了Pt NCs具有有趣的磁性属性。此外,Lee等[41]通过分子动力学(molecular dynamics,MD)模拟结合嵌入式原子方案,研究了各种温度条件下Ptn NCs(n = 38、147、309和561个原子)的相稳定性,揭示了不同原子数Pt NCs依赖温度的构象变化。
3 基于铂纳米簇的生物传感技术
3.1 基于Pt NCs纳米酶的生物传感器
基于Pt NCs纳米酶的生物传感器可根据信号输出方式分为比色生物传感器和电化学生物传感器。比色生物传感器主要利用具有类过氧化物酶性质的Pt NCs纳米酶催化底物如TMB氧化变色产生的颜色变化为信号输出方式为基本策略制造的传感器。电化学生物传感器,主要利用Pt NCs纳米酶优良的电导率产生的电催化作用及良好的生物相容性可有效促进生物材料,如DNA的负载而制造的电化学生物传感器。迄今为止,基于Pt NCs催化剂的传感器应用已有多篇研究,我们在这里主要讨论上述两种类型的传感策略。
3.1.1 基于Pt NCs纳米酶的比色生物传感器 人造酶,由于其无标记的结构,高效,出色的稳定性和较低的成本,已被合成并广泛应用于生物传感器。近年来,已经制备了具有各种形状和尺寸的Pt纳米材料,以获得具有更高催化活性的氧化酶模拟物。例如,Feng等[42]报道了一种新颖而简单的策略,可通过一锅合成路线生产具有可调的Au/Pt摩尔比的金/铂双金属纳米簇(Au/Pt NCs)。通过使用TMB作为显影剂检测葡萄糖基质,可以通过Au/Pt NCs-葡萄糖氧化酶(NCs-glucose oxidase,GOx)级联催化系统对葡萄糖进行灵敏和高选择性的比色检测。不仅用于肉眼直观检测葡萄糖,而且用于可靠且方便的定量,范围为5-55 μmol/L,LOD为2.4 μmol/L。除了双金属或多金属杂化,Pt NCs包裹在其他金属材料表面以提高稳定性和催化活性也有了大量研究。例如,Zheng等[43]开发了一种基于多孔金@铂纳米催化剂(Au@Pt NCs)和无源三维(3D)微混合器的灵敏光学生物传感器,用于快速检测鼠伤寒沙门氏菌。可在1 h内检测到沙门氏菌,浓度范围为1.8×101-1.8×107CFU/mL,LOD为17 CFU/mL;
除了上述的比色检测策略外,以DNA为模板或者靶标的生物传感器也逐渐引起了越来越多的关注:Higuchi等[15]首先基于过氧化物酶模拟的DNA-Pt复合物建立了凝血酶的比色生物测定法,该方法对凝血酶的LOD 为 0.4 μmol/L。Zheng等[16]改进了前人的合成方法,开发了一种简单的一步法,以单链DNA为模板来合成Ag/Pt双金属纳米簇(DNA-Ag/Pt NCs),这也是第一次提出了DNA-Ag/Pt NCs的概念,并开发了一种无标记的比色适体传感器,将凝血酶的LOD降低到2.6 nmol/L。Fu等[44]用柠檬酸钠代替磷酸盐缓冲液,大大缩短了系统的反应时间,优化了DNA-Ag/Pt NCs的合成方案。有趣的是,仍然可以获得相同的Ag/Pt双金属纳米簇。他们利用无标记技术的催化性能构建了用于检测VEGF鳞片胶泥的电化学适体传感器,在优化的实验条件下,线性范围为6.0-20 pmol/L,LOD为4.6 pmol/L。
研究发现将Hg0和Hg2+整合到DNA-Ag/Pt NCs中会导致DNA-Ag/Pt NCs聚集并降低DNA-Ag/Pt NCs表面上Pt2+的含量,最终抑制了它们的催化活性。基于此,Wu等[45]开发了Hg2+的比色检测方法。基于相同的原理,Kermani等[17]开发了用于DNAMTase活性检测的比色测定法,LOD为0.05 U/mL。
3.1.2 基于Pt NCs纳米酶的电化学生物传感器 作为一种流行的分析方法,就高度敏感的电化学生物传感器的合理设计而言,电极材料和信号输出是两个关键因素。具有独特的表面活性和光电性能以及良好的生物相容性的Pt NCs可以用于使电极界面功能化,或用作实现生物标记物高度灵敏检测的特定信号输出。Pt NCs的存在可以改善生物传感器的电导率和性能特征,并增加其他生物材料的负载。
由于单Pt电催化剂的稳定性差,成本高昂,Pt基双金属合金代替了单元素Pt不仅可以减少Pt的消耗,而且还通过利用两者之间的协同作用来提高催化活性。Pajooheshpour等[46]报道了由BSA模板化的Au-Pt双金属纳米簇(Au-Pt@BSA/GCE)和石墨烯纳米带(graphene nanoribbons,GNRs)组成的新传感层,用于快速,高选择性和灵敏地检测二嗪农,该策略的LOD低至0.002 μmol/L。通过将Pt和Sn纳米颗粒均匀装饰在TiO2纳米棒(Pt-Sn@TiO2)表面,Li等[47]开发了一种基于双信号放大策略(包括Pt-Sn@TiO2复合材料和核酸外切酶辅助的靶标回收)的检测方案,LOD为(0.02±0.004 5)nmol/L。
然而,由于这些小Pt NCs在连续工作条件下容易聚集并且易于从金属氧化物载体上脱离,因此电催化活性通常会下降,这归因于Pt NCs的接触部分较小,与金属氧化物基质接触且微弱。它们之间的物理或电子交互。因此,增强Pt/金属氧化物纳米杂化物的稳定性对于保持其高电催化活性非常重要,这是构建用于灵敏检测的电化学传感器的关键因素。Lu[48]成功设计并合成了一种新型且稳定的Pt NCs。通过在碱性溶液中脱AlCoPt三元合金来掺杂CoO(Pt/CoO)。在脱合金过程中,Al迅速溶解,其余的Co原子在金属/电解质界面处被氧化。同时,Pt原子扩散形成掺杂在具有匹配原子结构的CoO晶格中的Pt NCs,因此它们自动形成相互稳定的纳米结构。通过在玻璃碳电极(glassy carbon electrode,GCE)上修饰Pt/CoO纳米杂化物来制造用于亚硝酸盐检测的新型电化学传感器,LOD为0.067 μmol/L。
3.2 基于荧光Pt NCs的生物传感器
尽管Pt NCs或纳米颗粒凭借其催化活性已被广泛用于传感应用中,但很少有文献报道将Pt NCs用作化学传感的荧光探针。可以通过与荧光Pt NCs混合引起的荧光猝灭来检测目标。荧光猝灭通常通过动态或静态猝灭的机制发生。动态猝灭仅影响荧光团的激发态,因此没有预测吸收光谱的变化。与动态猝灭不同,静态猝灭发生在分子形成基态复合物时。例如,George等[49]合成了由N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)分子稳定的Pt NCs,并将其用作荧光探针,用于选择性检测水性介质中的 Fe3+。Fe3+通过DMF中酰胺键的羰基氧原子配位形成加合物,引起静态猝灭。Huang等[31]使用PEI作为稳定配体,使用环保型L-AA作为还原剂,制备的不同颜色的荧光Pt NCs在500 nmol/L的LOD下对Co2+敏感。Xu等[50]用BSA作稳定剂合成的荧光Pt NCs可用于S2-的检测,检测范围在50-1 000 μmol/L,LOD 为 50.0 μmol/L。
此外,可以用荧光NCs标记的免疫探针进行灵敏双重检测,从而通过荧光和元素质谱法测定生物分子。Lores-Padín等[51]报道了Pt NCs在免疫球蛋白E(IgE)竞争性免疫分析中作为双峰标记物的用途。荧光免疫测定IgE的LOD为0.6 ng/mL。电感耦合等离子体质谱法(ICP-MS)的LOD低至0.08 ng/mL。
3.3 生物成像
到目前为止,高荧光的金和银纳米簇(Au NCs和Ag NCs)在活细胞的生物成像中已经有许多研究。近年来,有关荧光Pt NCs在生物医学应用中也引起越来越多的关注。先前报道的一些研究表明,荧光Pt NCs发射波长主要集中在蓝色和绿色区域,仅涉及单个发射波长。较长波长的荧光具有较少的自发荧光和更高的临床安全性,这表明不同的颜色可以扩大应用范围,这使得Pt NCs对生物传感和生物成像研究具有吸引力。Tanaka等[33]通过使用PAMAM作为模板合成了发射蓝色和绿色[34]荧光的Pt NCs,并成功实现了对Hela细胞的生物成像。此外,Xin和 Huang等[52]使用荧光Pt NCs对造血K562和BV173细胞,NSCLC A549细胞和HepG2细胞等不同种类的肿瘤进行了生物成像,证明了荧光Pt NCs作为优选的荧光团的潜力。
Pt NCs@PEI易于与抗CXCR4抗体偶联以产生Pt NCs@PEI(anti-CXCR4-Ab)偶联物,该偶联物已成功地用于对同时被DAPI染色HeLa细胞膜的细胞核进行生物成像[30]。这些Pt NCs@PEI即使在较长的温育时间下也表现出较低的细胞毒性和更好的生物相容性。与常规荧光团(有机染料和Qdots)相比,Pt NCs@PEI具有水溶性,超细尺寸和非常低的细胞毒性的优势,这表明它们作为安全,无毒的荧光造影剂的潜力。Tanaka等[33]使用具有长链结构的Pt NCs生物纳米探针开发了一种在细胞水平上对HER2进行高度灵敏光学成像的平台。它使用发射光(Ex/Em=535/630 nm)以增强组织穿透力并减少从组织散射的背景噪声,因此可以观察到细胞深层的解剖特征。
4 总结与展望
Pt NCs作为新一代的纳米材料由于其独特的光学特性和复杂的表面化学特性在生物传感及生物成像方面开辟了新的道路。尽管近年来Pt NCs的应用有了很大的进展,但在更广泛的应用之前,仍有一些具有挑战性的问题需要解决。
在合成模板方面,目前合成的模板包括树枝状大分子在内的聚合物配体及生物大分子。与有机小分子相比,聚合物具有更容易改性、更好的控制能力和较低的毒性,使其成为合成M NCs的首选。但是大支架的主要缺点是既难以从溶液中的NCs中除去剩余的游离模板,又难以将NCs与大支架隔离。另外,当使用树枝状大分子或其他聚合物作为模板时,已经观察到反应空白经常发出明显的荧光。因此,合成易于分离和纯化荧光的Pt NCs仍然是一大挑战。此外,生物大分子模板,如DNA、蛋白质、寡核苷酸和酶,是制造医用和生物金属纳米材料的常用材料。相比之下,由于DNA具有相对更高的生理稳定性和可预先设计的结构,使用DNA为模板合成的金属纳米簇具有体积小、毒性低、易于组装以及优秀的生物相容性等优点,目前DNA模板化的金属纳米团簇,如DNA/Au NCs,DNA/Ag NCs等在生物成像,环境检测,临床诊断和治疗领域已经得到了广泛的探索和利用。尽管有一些DNA杂化铂纳米簇的少数报道,但是,显然有关DNA铂纳米簇的生物学应用还有待开发,可预见在未来DNA-Pt NCs会在生物成像、抗菌及癌症治疗方面会出现更多令人鼓舞的成果。
在检测应用中,我们总结了Pt NCs广泛应用于荧光传感、电化学等具有低检出限的传感器中的策略,并指出Pt NCs可以用作人造酶,以替代新型比色和荧光生物传感器中昂贵且敏感的HRP和CAT,并开发新型的裸眼诊断方法。这是一个特别有趣的领域,因为Pt NCs的极高催化效率及其在各种条件(包括pH和温度)下的稳定性可以促进超灵敏,低成本和便携式检测的发展,该检测策略使得传感器在室温下长时间(几个月)保存,并且在没有温度控制或仪器要求的情况下在专门实验室外进行成为了可能。
在细胞毒性方面,目前的研究表明大部分Pt NCs是适用于活细胞长期成像的无害荧光探针。但由于复杂环境的稳定性和活细胞的毒性,Pt NCs在体内系统的应用仍然受到限制,亟需对其在细胞和动物中的毒性和稳定性进行系统和全面的评估。总体而言,Pt NCs在生物传感器的新兴应用领域正在快速增长,并且有可能为分析科学的发展做出巨大贡献。