五种检测嵌合抗原受体表达方法的比较
王欢禹 常昊宛 章崇祺 金卫林 魏芳
(上海交通大学生命科学技术学院,上海 200240)
嵌合抗原受体T细胞治疗(chimeric antigen receptor T cell therapy,CAR T cell therapy)是目前较为有效的肿瘤免疫治疗方法,主要是通过慢病毒等方式改造病人外周血中分离的T细胞,获得表达特异性嵌合抗原受体(chimeric antigen receptor,CAR)的T细胞,从而实现对肿瘤的特异性治疗[1]。嵌合抗原受体是将识别肿瘤相关抗原(tumor-associated antigen,TAA)的单链抗体(single chain antibody fragment,scFv)、跨细胞膜锚定序列以及T细胞的活化序列在体外进行基因重组而成的人工融合基因。它能够将抗体对肿瘤抗原的高亲和性和T淋巴细胞的杀伤机制相结合,使其能特异性地识别和杀伤肿瘤细胞[2]。与T细胞抗原受体(T cell receptor,TCR)不同,CAR可以不依赖于主要组织相容性复合体(major histocompatibility complex,MHC)的识别,高度特异性地靶向抗原[3]。迄今为止,CAR T细胞在血液恶性肿瘤的治疗疗效显著。2017年8月,FDA批准使用靶向CD19的CAR(Kymriah)治疗小儿复发或难治性急性淋巴细胞白血病(ALL);同年10月,FDA批准了另一种靶向CD19的CAR(Yescarta)用于治疗成人复发或难治性大B细胞淋巴瘤。此外,欧洲药品管理局(EMA)也于2018年6月批准了这两种药物的使用。然而对实体瘤的CAR T细胞治疗的疗效尚待进一步的研究及提高[4],而决定这一疗法成功与否的关键因素之一就是选择合适的肿瘤标志性抗原为靶点。目前在实体瘤中在实验及临床前对多个靶点开发相应的靶向CAR T治疗[5-6]。随着人们对不同肿瘤类型的更深入了解,更多靶向肿瘤特异抗原的CAR T也在不断涌现。这些靶向肿瘤特异的标志性抗原的新型CAR-T细胞,需要使用敏感的CAR分子检测方法对CAR-T细胞染色及鉴定以确定其有效性。
当前最常见的CAR分子检测方法包括荧光染色流式细胞检测[7]、与CAR蛋白共表达的荧光蛋白流式细胞检测[8]、qPCR检测CAR载体在基因组中整合的频率等[9]。但这3类检测方法之间的敏感性和适用性的系统性比较研究目前尚不多见。同时对处于研发阶段的新型CAR分子中单链可变区部分的轻链重链排布的顺序和靶向同一位点的不同CAR分子是否会对不同检测方法的结果有所影响,以及检测方法的选择还需在同一水平进行试验,提供系统化的参考。
因此,本文使用多种CAR分子(包括正在研发阶段的4种新型CAR分子)对这些方法之间的敏感性和适用性进行比较。对6种分别靶向多种肿瘤过表达的间皮素(mesothelin)及肝细胞生长因 子 受 体(mesenchymal-epithelial transition factor,MET),胶质瘤中高表达的异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)广谱点突变蛋白[10](IDH1 R132H)(基于靶向同一位点R132H两种不同scFv序列),以及原发性渗出性淋巴瘤(primary effusion lymphoma,PEL)过表达的 IL-4Rα[11-12](包含同一scFV的轻重链不同排列顺序,即HL代表N端-重链-轻链-C端,LH代表N端-轻链-重链-C端)的CAR分子在Jurkat细胞的表达水平逐一评估,为后续新型CAR分子鉴定提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞株、菌株和质粒 大肠杆菌感受态菌株Stbl3;人外周血T淋巴细胞Jurkat细胞系;慢病毒表达质粒和慢病毒包装质粒均由本实验室保存。
1.1.2 试剂及仪器 去内毒素质粒中提试剂盒购自Omega公司;胎牛血清购自Biological Industries公司;RPMI 1640细胞培养基和Opti-MEM购自Thermo Fisher Scientific 公司 ;BamH I、Xba I、Sal I、Avr II和T4 DNA连接酶购自NEB公司;Biotin-protein L购自金斯瑞生物科技有限公司;Biotin-SP Goat Anti-Mouse IgG、Biotin-SP Rabbit Anti-Human IgG购自美国Jackson ImmunoResearch公司;PE-Streptavidin购自BD公司;DNA纯化回收试剂盒购自天根生化科技有限公司;BSA购自生工生物;引物合成和测序由北京擎科生物科技有限公司上海分公司完成;实验所需的主要仪器包括CO2细胞培养箱、C6流式细胞仪、qPCR仪、低温冷冻离心机、摇床等。
1.2 方法
1.2.1 六种新型CAR分子表达载体构建 构建Meso-BBζ(靶向 Mesothelin)、Met-BBζ(靶向 Met)、CAR1-2-BBζ-GFP( 靶 向 IDH1 R132H)、CAR2-4-BBζ-GFP( 靶 向 IDH1 R132H)、Dupixent HL-BBζ-GFP(靶向 IL-4Rα)、Dupixent LH-BBζ-GFP(靶向IL-4Rα)6种CAR分子表达载体。
1.2.2 慢病毒包装及感染 将表达6种CAR的载体DNA与病毒包装质粒共转染入293T细胞,培养24 h和48 h时收集细胞培养液,高速离心浓缩。使用24 h和48 h的病毒感染Jurkat细胞系,得到稳定表达CAR的6种Jurkat细胞。
1.2.3 流式抗体染色及检测[7]取1 × 106个细胞,预冷的 1 × PBS(含 4% BSA)洗 3次,100 μL重悬,加入0.5 μg Biotin-protein L(Biotin-SP Goat Anti-Mouse IgG/Biotin-SP Rabbit Anti-Human IgG 5 μg),4℃,45 min;预冷的1 × PBS(含4% BSA)洗3次,50 μL 重悬,加入 2 μL PE-Streptavidin,避光 4℃,15 min;预冷的1 × PBS(含4% BSA)洗3次,流式细胞仪检测。
1.2.4 实时荧光定量PCR检测 绝对定量[13]:选择CAR载体上WPRE(woodchuck hepatitis virus posttranscriptional regulatory element)基因为定量检测基因,ALB(albumin)基因为内参基因。制备标准品的基因片段,标准品PCR引物:ALB,F- AGGCCATATTCAGTAGAAAAAGATG,R-TGGGGAGGCTATAGAAAATAAGG;WPRE,F-ACAGCCACCAAGGACACCTAC,R-GAAGGAAGGTCCGCTGGATTGA。检测标准品基因片段浓度,将标准品成比例稀释成4个梯度,计算每微升标准品质粒的拷贝数,对标准品进行梯度浓度稀释,取4个不同稀释比例(102-108拷贝)的标准品,标准品与细胞基因组样品同时进行实时荧光定量PCR,每一个标准品梯度和每一个样品均设置两个重复,得到标准品和样品的循环阈值,计算循环阈值的平均值。并根据标准品的Ct值和拷贝数绘制标准曲线,将待测样品的Ct值代入标准曲线,计算获得待测样品的WPRE 和Alb的拷贝数[13]。从而计算每个细胞整合的慢病毒数目,计算公式为:每个细胞CAR分子的拷贝数=(WPRE基因拷贝数均值/ALB基因均值)×2,进而推测CAR分子表达水平。相对定量:以Jurkat-Dupixent-HL-GFP细胞作为标准品,将Jurkat-Dupixent-HLGFP细胞用Jurkat细胞混合稀释成不同绿色荧光蛋白表达比例的细胞标准品,选择绿色荧光蛋白表达比例分别为0(Jurkat)、20%、40%、60%的标准品梯度。每一个梯度和样品细胞分别取1.5×106个细胞提取基因组,进行WPRE基因的实时荧光定量PCR,内参基因是ALB,每一个标准品梯度和每一个样品均设置两个重复,得到标准品和样品的循环阈值,计算循环阈值的平均值。计算得到WPRE相对于ALB基因的相对表达量,根据GFP比例和WPRE基因的相对表达量绘制曲线,将待测样品的WPRE基因的相对表达量代入标准曲线,可以确定CAR是否在细胞内表达以及大致表达水平。
2 结果
2.1 特异靶向间皮素、肝细胞生长因子受体、IDH1突变蛋白及IL-4Rα的CAR载体的构建
成功构建6种带有CAR分子的慢病毒载体。后4种CAR分子为新型的CAR分子,故构建其与绿色荧光蛋白GFP通过T2A系统同时表达的载体(图1)。对CAR载体进行双酶切(图2)及测序验证,确证其构建的正确性(图3)。
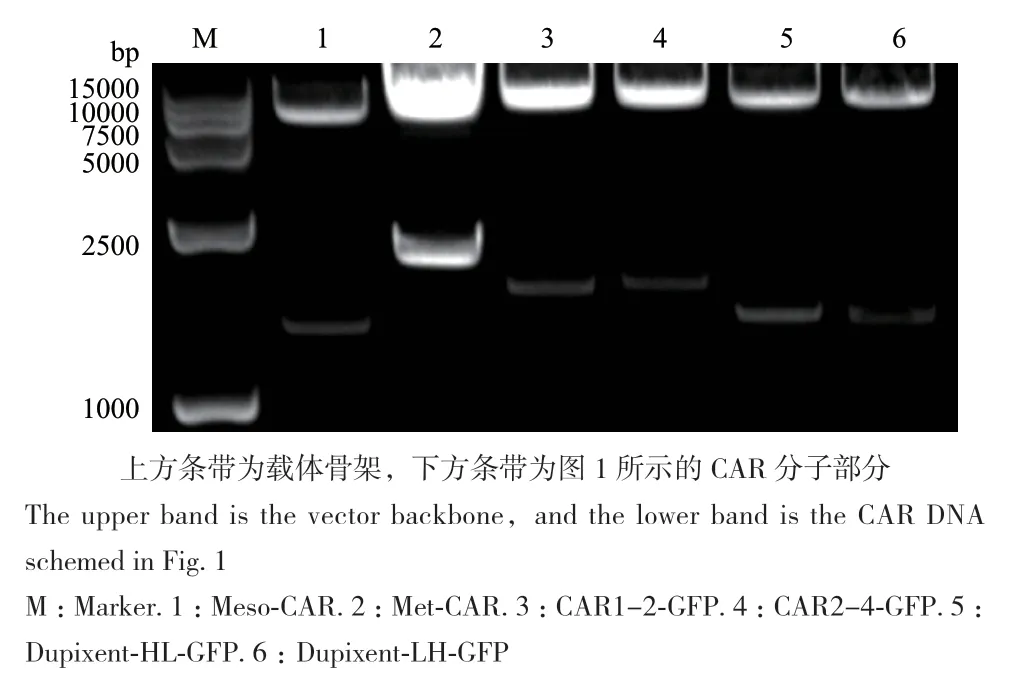
图2 CAR载体酶切图Fig. 2 Map of restriction enzyme digestion of CAR vectors

图3 CAR分子scFv段测序图谱(部分)Fig. 3 Sequencing profiles of scFv segments in CAR molecules(partial)
2.2 流式细胞法检测CAR分子的表达
包装慢病毒并感染Jurkat细胞,获得表达不同CAR分子的Jurkat细胞,即Jurkat-Meso,Jurkat-Met,Jurkat-CAR1-2-GFP,Jurkat-CAR2-4-GFP,Jurkat-Dupixent-HL-GFP 和 Jurkat-Dupixent-LH-GFP。流式细胞仪检测不同染色方法所示的CAR表达水平(图4)。分别计算IgG抗体染色和蛋白质L染色平均荧光强度(MFI),如图5所示。从平均荧光强度和阳性率来看,两种方法的配对t检验分析,均有显著性差异(P值均为0.031 3),IgG抗体染色较优。表明IgG抗体染色较蛋白质L染色阳性峰偏移程度更高,对CAR分子的反应灵敏性更高,染色效果好。
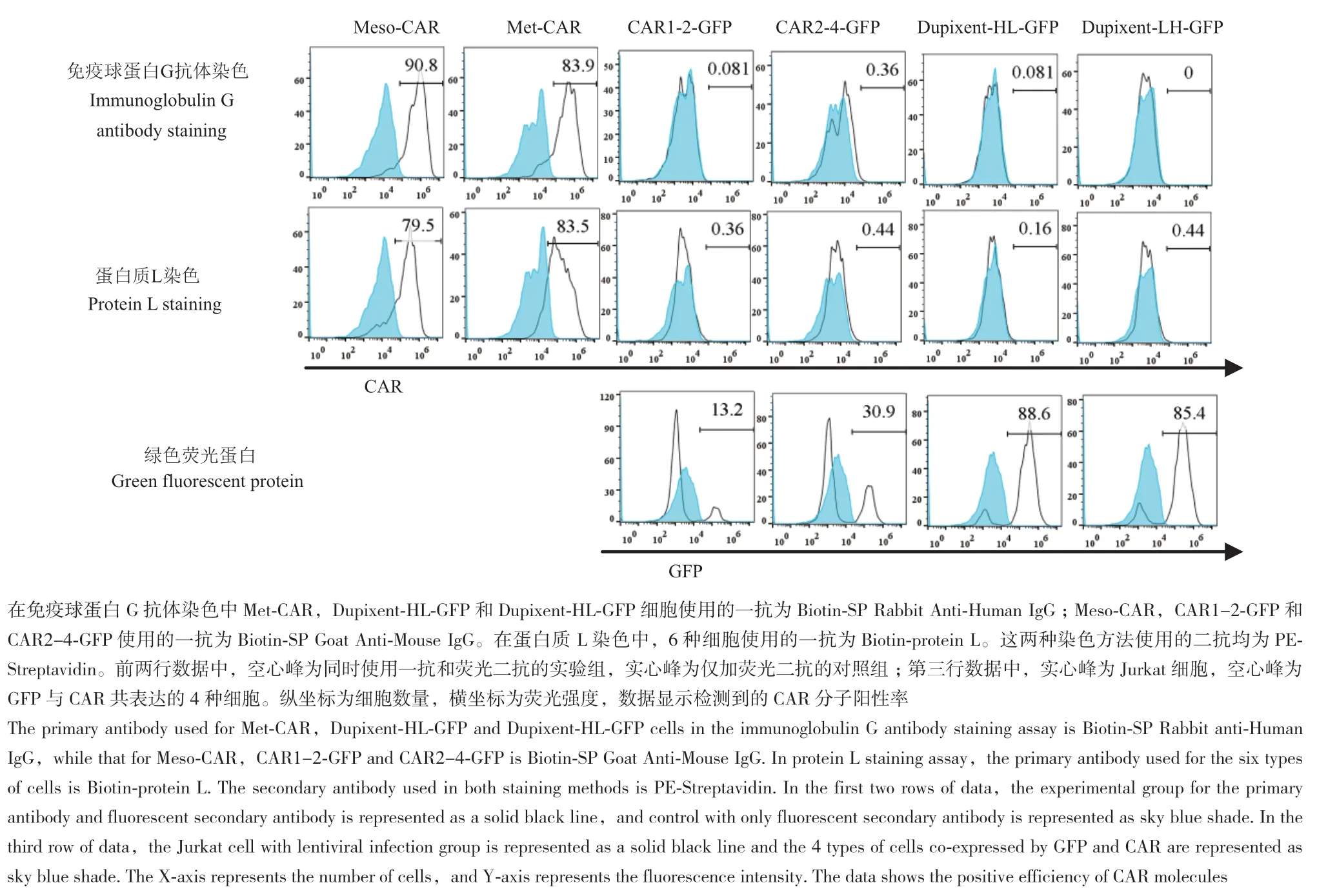
图4 流式细胞仪检测CAR表达结果Fig. 4 Results of CAR expression detected by flow cytometry
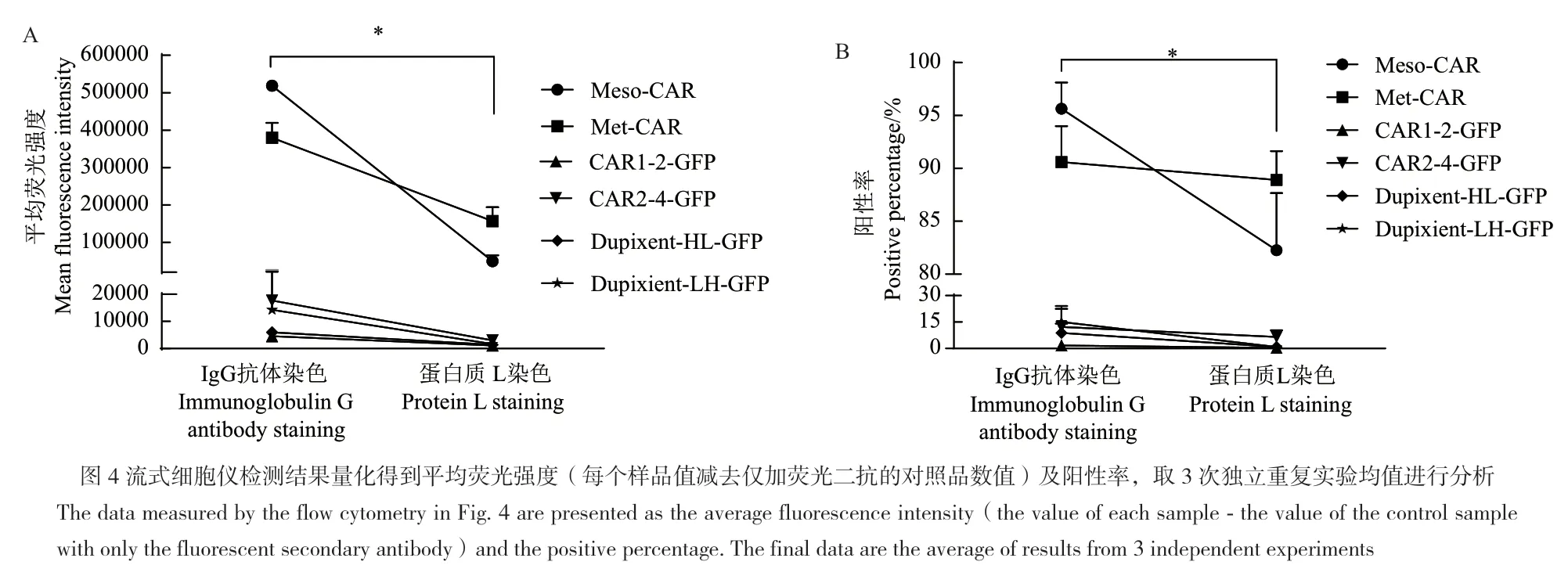
图5 两种染色方法平均荧光强度及阳性率比较Fig. 5 Comparison of two staining methods shown as average fluorescence intensity and positive percentage
对于Jurkat-CAR1-2-GFP,Jurkat-CAR2-4-GFP,Jurkat-Dupixent-HL-GFP和Jurkat-Dupixent-LH-GFP四种细胞,IgG抗体染色和蛋白质L染色法检测效率低,靶向同一位点的不同scFv序列以及同一scFv序列的不同轻重链排布的样品均没有显示染色优势。对荧光法染色检测不可行的CAR分子,GFP共表达的水平可体现编码CAR分子的慢病毒在细胞的感染效率。
2.3 绝对定量法和相对定量法qPCR检测编码CAR分子的病毒转染效率
PCR得到ALB和WPRE基因片段(图6)。在绝对定量法中,建立标准品起始拷贝数的对数值和循环阈值的标准曲线(图7)。标准品(按100倍稀释)WPRE拷贝数与循环阈值作图,得到标准曲线y=-4.016 9x+40.018(R2为0.995 4);标准品(按100倍稀释)ALB拷贝数与循环阈值作图,标准曲线y=-4.071x+38.493(R2为0.994 9)。根据样品循环阈值计算得到样品WPRE和ALB基因的拷贝数,继而得到每个细胞整合CAR拷贝数。其中,无法用IgG抗体和蛋白质L染色法检测的表达4种新型CAR分子Jurkat细 胞 :Jurkat-CAR1-2-GFP,Jurkat-CAR2-4-GFP,Jurkat-Dupixent-HL-GFP和Jurkat-Dupixent-LHGFP中每个细胞平均整合的CAR分子拷贝数分别为0.36、0.66、3.50、3.29。
图6 PCR片段DNA标准品的琼脂糖凝胶电泳图Fig. 6 Agarose gel electrophoresis profile of the standard DNA samples by PCR
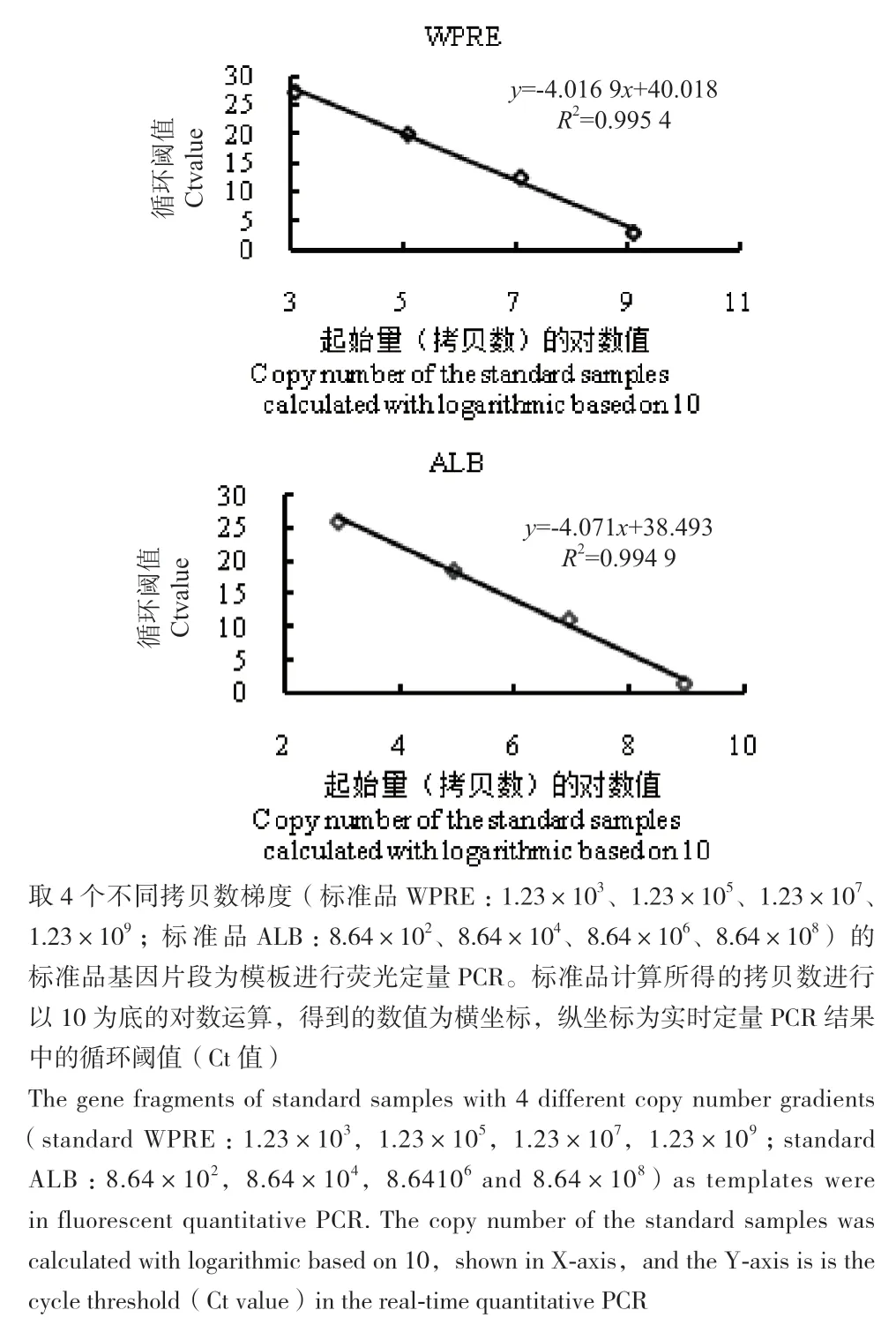
图7 标准品标准曲线图(绝对定量法)Fig. 7 Standard curve diagrams of standard samples(absolute quantitative method)
在相对定量法中,Jurkat-Dupixent-HL-GFP细胞按绿色荧光蛋白表达比例加入对照Jurkat细胞制备标准品梯度,与样品同时提取基因组,进行实时荧光定量PCR,建立不同绿色荧光蛋白表达比例和WPRE相对表达量之间的标准曲线(图8),得到R2为0.997 7的标准曲线y=0.988 9x+0.239 8。根据样品基因组中WPRE相对表达量,计算得到绿色荧光蛋白表达比例(CAR分子表达比例),可以推测CAR分子的表达水平,结果见图9。
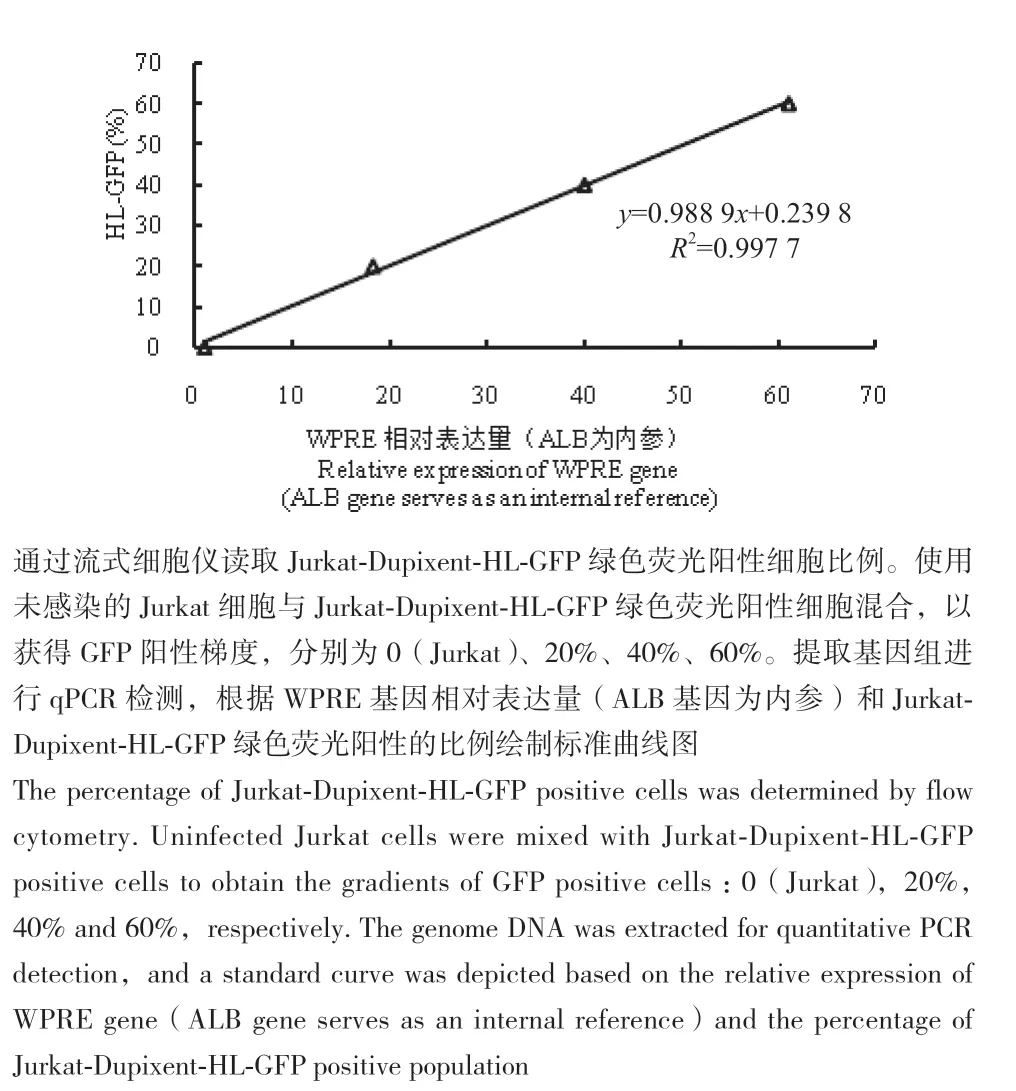
图8 HL-GFP百分比与WPRE相对表达量的标准曲线图(相对定量法)Fig. 8 Standard curve of the percentage of HL-GFP and the relative expression of WPRE(relative quantitative method)
2.4 五种实验方法检测结果比较
将定量qPCR法与GFP共表达的结果相比较,发现两种不同策略之间有一定的对应性,且进行配对t检验分析,相对定量法与绿色荧光蛋白共表达法的结果没有明显差异,即在标准曲线所示的范围内,WPRE基因含量越高,编码CAR分子的病毒转染效率越高。由此样品基因组中WPRE基因含量在一定程度上反映了编码CAR分子的病毒转染效率(图 9)。
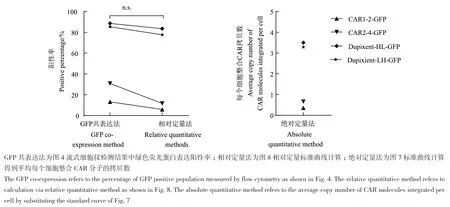
图9 四种新型CAR分子3种不同检测方法的比较图Fig. 9 Comparison of 3 different methods in detecting 4 novel CAR molecules
从适用性、直观性等方面比较5种实验方法(表1),绿色荧光蛋白与CAR分子共表达的流式细胞检测法、相对定量和绝对定量的实时荧光定量检测法可适用于所有的CAR分子检测;IgG抗体和蛋白质L染色的流式细胞检测法均可以直接反应CAR分子的表达比例。通过将CAR分子与不同颜色的荧光蛋白共表达,以及通过检测CAR分子上特定的序列来检测CAR分子的相对定量和绝对定量实时荧光定量检测法可间接反应CAR分子表达。
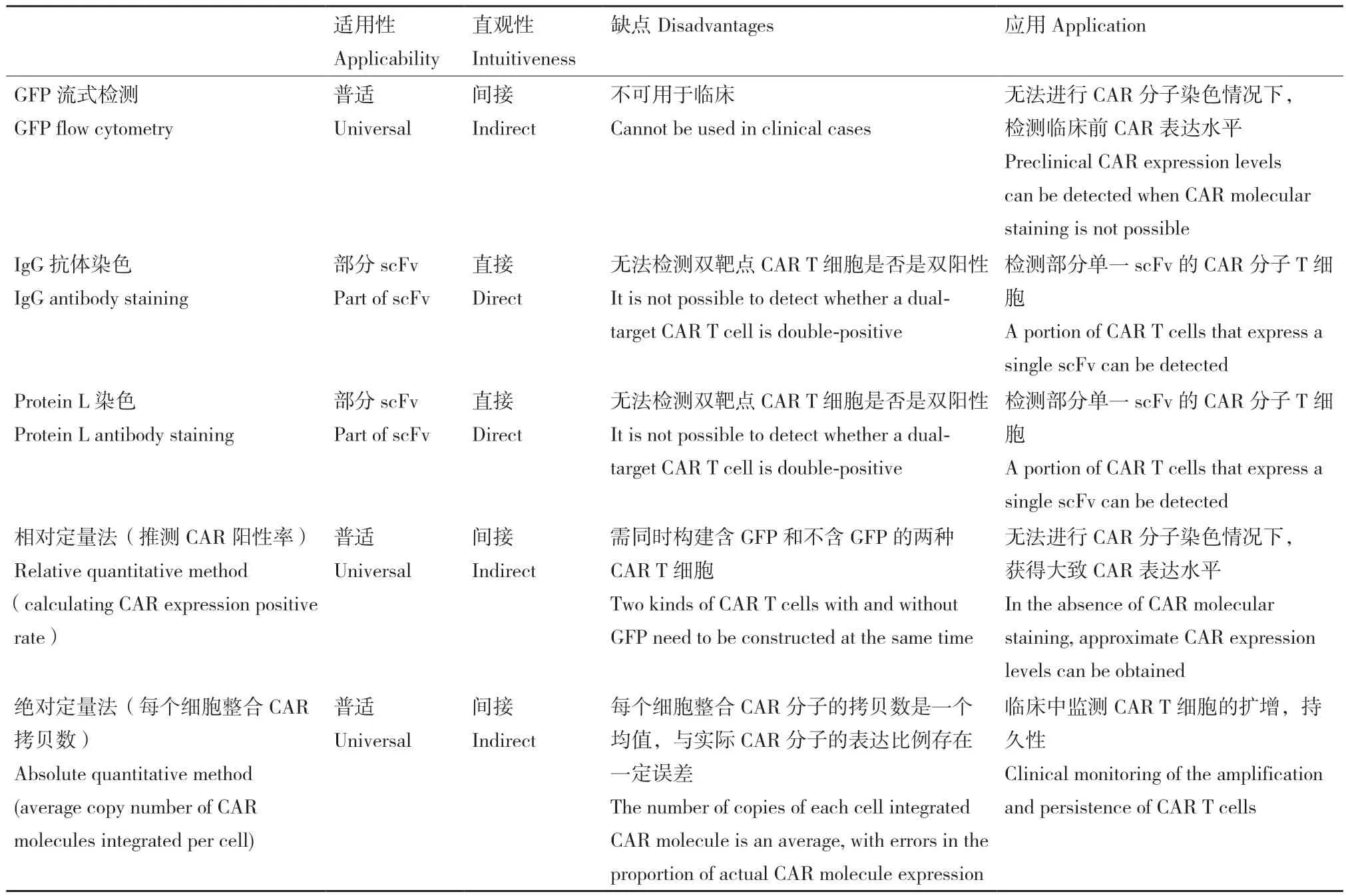
表1 五种方法CAR检测方法的优劣比较表Table 1 Comparison of the five methods in detecting CAR moleculars
此外,IgG抗体染色和蛋白质L染色的流式细胞检测适用于检测一部分CAR分子上的单链抗体片段,可直观反应能被染色CAR分子的表达比例,但是无法适用于本文中的4个新型CAR分子。
3 讨论
本研究以感染6种CAR分子(包括正在研发阶段的4种新型CAR分子)的Jurkat-Meso,Jurkat-Met,Jurkat-CAR1-2-GFP,Jurkat-CAR2-4-GFP,Jurkat-Dupixent-HL-GFP和Jurkat-Dupixent-LH-GFP细胞为样本,通过5种最常见的嵌合型抗原受体检测方法来比较这几种方法的优劣。
目前存在多种通过流式染色鉴定嵌合抗原受体表达的方法[14],其中比较常用的两种CAR分子检测方法是通过IgG抗体和蛋白质L结合细胞表面表达的CAR分子。这两种方法因IgG抗体和蛋白质L可能与细胞表面非CAR蛋白发生交叉反应可能引入假阳性。此外,对于一个细胞上表达两种不同CAR分子的检测也存在不适用的问题,同时这两种染色剂只能结合一部分CAR分子中单链抗体片段(scFv)的轻链部分,不能结合所有CAR分子中单链抗体片段(scFv)的轻链部分,如本文使用的Jurkat-CAR1-2-GFP,Jurkat-CAR2-4-GFP,Jurkat-Dupixent-HL-GFP和Jurkat-Dupixent-LH-GFP四株细胞就不能被这两种染色剂检测到,但Jurkat-Meso,Jurkat-Met两种细胞上的CAR分子可以通过IgG抗体染色和蛋白质L抗体染色检测到。从峰值偏移水平、阳性率以及平均荧光强度显著性分析可以看出IgG抗体染色比蛋白质L染色的效果更佳。随着嵌合抗原受体T细胞疗法的发展,更多检测嵌合抗原受体的方法报道相继出现,如数字PCR(dPCR)精确定量CAR-T细胞[15]、分析单细胞RNA测序数据集CAR mRNA的含量[16]、共聚焦显微镜以高空间分辨率可视化CAR[17]等。文章中使用的5种方法是目前最常见且廉价方便的检测方法,并在同一水平同时利用这些检测方法分析其敏感性和适用性,提供了系统化的参考。
将CAR分子通过T2A系统与绿色荧光蛋白共表达的方法可用于所有嵌合抗原受体表达水平的检测,然而此方法仅适用于研究。此外,在载体中额外引入GFP的序列会影响病毒的包装效率。在本文中,这为我们提供qPCR相对定量检测CAR表达水平的参考值,以便通过绿色荧光蛋白表达比例和qPCR循环阈值之间的标准曲线,从而计算表达CAR分子细胞的比例。qPCR绝对定量的方法早先应用于检测病毒滴度[13],近几年有关于监测外周血嵌合抗原受体T细胞的qPCR分析方法的报道[9],与相对定量的方法相比,结果精确性高,能计算得到平均每一个细胞基因组整合CAR分子的数目,可体现CAR分子表达水平的趋势。
综上所述,qPCR的绝对定量方法是在基因水平上检测细胞基因组中整合的CAR分子数目,可大致推测CAR分子表达水平趋势。而具体CAR分子的表达水平和含有CAR分子细胞比例的结果还需在蛋白质水平上得到验证,可通过qPCR的相对定量、流式抗体染色或偶联GFP蛋白,通过流式细胞仪直观的检测。
4 结论
在 稳 定 表 达Meso-CAR、Met-CAR、CAR1-2-GFP、CAR2-4-GFP、Dupixent-HL-CAR-GFP、Dupixent-HL-CAR-GFP的6种Jurkat细胞中,CAR分子与绿色荧光蛋白共表达可用于CAR表达水平的试验阶段的检测,免疫球蛋白G抗体染色的灵敏性较蛋白质 L染色好,对于免疫球蛋白G抗体及蛋白质 L无法识别的CAR分子,则可以使用相对或绝对定量实时荧光PCR方法,两者均可以反映CAR表达水平的趋势。