丁苯酞注射液治疗进展性脑卒中的临床效果
刘桂香
进展性脑卒中(PS)是指发病6 h~7 d内经规范治疗病情仍呈进行性的脑卒中,PS患者数量约占脑卒中的1/3,病情严重且变化迅速,治疗难度大[1]。目前,临床上治疗PS的方式包括溶栓、抗凝、控制脑水肿、改善脑灌注、营养神经等,多数PS患者经治疗后被成功挽救生命,但普遍遗留不同程度额神经功能障碍,导致预后效果差[2]。丁苯酞作为新兴脑保护类药物,具有抗血小板聚集、恢复脑组织血液循环、改善脑神经功能之效,已被列入《中国急性缺血性脑卒中诊治指南2010》指导用药[4]。因此,本研究观察丁苯酞注射液治疗PS的临床效果,以期为临床治疗该疾病提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年7月-2020年1月深圳市宝安区石岩人民医院收治的PS患者108例为研究对象,根据随机数字表法分为观察组(n=54)和对照组(n=54)。观察组男29例,女25例;年龄37~70(61.72±5.52)岁;发病时间2~48(10.46±2.31)h。对照组男31例,女23例;年龄41~68(61.05±4.91)岁;发病时间2~45(10.77±2.88)h。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:(1)患者均经头颅CT或MR扫描证实,符合《中国急性缺血性脑卒中诊治指南2018》中PS的诊断标准[4];(2)首次发病,发病时间<48 h,美国国立卫生院卒中神经缺损评估量表(NIHSS)评分≥3分;(3)年龄18~70岁;(4)患者家属均知晓研究内容并签署知情同意书。排除标准:(1)出血性卒中、瘤卒中者;(2)既往脑出血、脑外伤、脑肿瘤史者;(3)免疫系统疾病者;(4)严重器质性疾病者;(5)感染性疾病者;(6)出血性倾向者;(7)对本研究所用药物过敏者。
1.3 治疗方法 2组均遵循“中国急性缺血性脑卒中诊治指南2018”的原则治疗,予以降糖降压、吸氧、调节水电解质及酸碱平衡、抗血小板聚集等对症治疗。
对照组采取常规基础治疗,包括给予阿司匹林肠溶片(拜耳医药保健有限公司生产,国药准字J20171021,规格:100 mg)100 mg口服,每天1次;硫酸氢氯吡格雷片(赛诺菲杭州制药有限公司生产,国药准字J20180029,规格:75 mg)75 mg口服,每天1次;尼莫地平注射液(拜耳医药保健有限公司广州分公司/Bayer AG生产,国药准字J20140105,规格:50 ml ∶10 mg)80 ml+5%葡萄糖注射液500 ml静脉滴注,每天1次;胞磷胆碱钠注射液(山西晋新双鹤药业有限责任公司生产,国药准字H14021994,规格:2 ml ∶0.25 g)0.5 g+5%葡萄糖注射液500 ml静脉滴注,每天1次;依达拉奉注射液(国药集团国瑞药业有限公司生产,国药准字H20080056,规格:20 ml ∶30 mg)30 mg+生理盐水500 ml,于30 min内静脉滴注完,每天2次。连用2周结束疗程。
观察组在对照组基础上联合丁苯酞氯化钠注射液(石药集团恩必普药业有限公司生产,国药准字H20100041,规格:100 ml ∶25 mg)25 mg静脉滴注,每天2次。治疗2周结束疗程。
1.4 观察指标及方法 (1)于治疗前及治疗2周后抽取2组早晨空腹静脉血5 ml,3 000 r/min离心10 min,使用帝买血液分析仪检测凝血功能指标:凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、纤维蛋白原(FIB)、国际标准化比值(INR),使用瑞士进口罗氏cobas 8000型全自动生化分析仪检测血清高敏C反应蛋白(hs-CRP),采用美国伯滕ELX800型酶标仪检测血清脂蛋白相关磷脂酶A2(Lp-PLA2)、血管生成素-1(Ang-1);(2)于治疗前及治疗2周后采用NIHSS测评2组神经功能,共15个内容,总分42分,评分与神经功能呈负相关[5];(3)于治疗前及治疗2周后采用Barthel指数(BI)测评2组日常生活活动能力,共10个内容,总分100分,评分与生活能力呈正相关[6]。
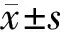
2 结 果
2.1 凝血功能指标比较 治疗前,2组患者凝血功能指标比较差异无统计学意义(P>0.05);治疗2周后,2组APTT、PT较治疗前延长,FIB水平较治疗前降低,INR较治疗前升高,且观察组各项指标优于对照组,差异均有统计学意义(P<0.01)。见表1。
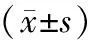
表1 2组患者治疗前后凝血功能指标比较
2.2 血清炎性因子水平比较 治疗前,2组患者hs-CRP、Lp-PLA2、Ang-1水平比较差异无统计学意义(P>0.05);治疗2周后,2组hs-CRP、Lp-PLA2水平较治疗前降低,Ang-1水平较治疗前升高,且观察组指标改善优于对照组,差异均有统计学意义(P<0.01)。见表2。
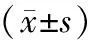
表2 2组患者治疗前后血清炎性因子水平比较
2.3 NIHSS评分、BI指数比较 治疗前,2组患者NIHSS评分、BI指数比较差异无统计学意义(P>0.05);治疗2周后,2组NIHSS评分较治疗前降低、BI指数较治疗前升高,且观察组变化幅度大于对照组,差异均有统计学意义(P<0.01)。见表3。

表3 2组患者治疗前后NIHSS评分、BI指数比较分)
3 讨 论
国内外研究报道,PS多发生于脑卒中后46~72 h,发病率为22%~44%,病情进展迅速,预后效果差,患者病死率、致残率较高[7]。因此,针对PS患者应及时予以有效治疗以降低患者的病死率、致残率,改善预后。丁苯酞为消旋正丁基苯酞,是从天然食用植物芹菜籽中提取的,具有抗血栓、抗血小板聚集、抑制神经细胞凋亡、减轻脑水肿等多种效果[8]。
有学者提出,炎性因子直接或间接参与PS发病前期阶段,发病时机体分泌、释放大量炎性因子,导致炎性连锁反应出现,进一步损伤脑细胞,加重脑组织功能障碍[9]。hs-CRP是由肝脏合成的炎性反应非特异性标志物,可作为心血管事件的预测因子。Ang-1在内皮细胞炎性反应中起着重要作用,可促进动脉粥样硬化发展。Lp-PLA2具有血管炎性反应关键启动因子的作用,其水平与炎性反应密切相关。本研究发现,观察组治疗后Ang-1水平明显高于对照组,Lp-PLA2、hs-CRP水平明显低于对照组(P均<0.01)。结果提示,丁苯酞注射液具有抗炎作用,可通过下调Lp-PLA2、hs-CRP浓度,上调Ang-1水平以减轻机体炎性反应,保护脑组织[10]。药理研究发现,丁苯酞注射液可抑制血小板聚集,抑制血栓形成,改善局部脑血流,其作用机制是通过抑制超氧阴离子自由基生成,抑制线粒体电子传递链细胞色素C释放,保护线粒体功能,选择性阻止花生四烯酸及其代谢产物引起的病理过程从而抑制血小板聚集,解除微血管痉挛,改善缺血脑区微循环,减轻血—脑脊液屏障破坏程度,减轻血流再灌注损伤[11]。本研究提示,经丁苯酞注射液治疗可抑制血小板聚集,增强纤溶酶活性,PS患者的凝血功能得到明显改善。表3中,观察组治疗后的NIHSS评分明显低于对照组,BI指数明显高于对照组(P<0.01)。提示丁苯酞注射液可减轻PS患者脑水肿,缩小梗死面积,减缓神经细胞凋亡速度,改善局部血液微循环,改善脑能量代谢,促进神经元细胞恢复,提高患者的神经功能,增强患者生活活动能力。
综上所述,在常规治疗基础上给予丁苯酞注射液可减轻PS患者的炎性反应,改善凝血功能,减轻神经功能受损程度,改善预后,值得推广应用。

