10-MDP-钙盐形成对牙本质粘接成绩影响的评价
王 琦,沈佳娣,吴欣祎,谢海峰,陈 晨
树脂与牙本质的粘接都依赖于“混合层(HL)”的形成,它是决定粘接强度的主要因素[1]。在牙科粘接剂体系中掺入功能性单体被发现可以防止HL层的降解[2],10-甲基丙烯酰氧基癸基磷酸二氢盐(10-MDP)是一种使用最广泛、最稳定的酸性功能单体,已有研究证明10-MDP可与羟基磷灰石建立稳定的化学相互作用并耐水解,从而延长HL的保存时间[3-4]。HL内暴露的胶原纤维水解是HL降解的主要因素之一,而暴露的胶原纤维极易受到人牙本质中内源性基质金属蛋白酶(MMPs)的影响,从而导致混合层水解,降低粘接强度[5]。既然10-MDP与羟基磷灰石能够形成钙盐,而这一化学结合是否有助于保护牙本质胶原纤维抵抗MMPs的降解尚值得研究。当前研究即通过微拉伸粘接强度、原位酶谱及X射线衍射分析评价10-MDP-钙盐的形成对牙本质粘接成绩的影响。
1 材料与方法
1.1 牙本质/树脂粘接样本制备
经南京医科大学伦理委员会批准,收集20颗新鲜拔除无龋人类第三磨牙,去除牙齿表面的杂质及软组织。在流水状态下使用低速金刚砂切割机(Isomet 1000, Buehler Ltd., Lake Bluff, IL, 美国)垂直于牙体长轴切割出16个3 mm厚的和4个1 mm厚的牙本质片,去除表面牙釉质,牙本质片表面依次使用400目和600目碳化硅砂纸湿抛光1 min,以制备玷污层。使用牙科显微镜(OMS2350牙科显微镜,Zumax,中国)仔细检查所有的牙本质表面,以确保没有残留的牙釉质或牙髓暴露。然后,将牙本质储存在4 ℃ Hanks平衡盐溶液中,用于制备牙本质粘接试件。
本实验所用的含10-MDP的底涂剂参照以下配方制备[6]:10%的10-MDP(DM Healthcare Products,美国); 88.8%的无水乙醇(上海沪试,中国); 0.3%樟脑醌(CQ,阿拉丁,中国);0.9%的4-二甲基氨基苯甲酸乙酯(4EDMAB,阿拉丁,中国)。所有牙本质表面均用35%磷酸酸蚀剂(Gluma Etch 35 Gel,德国)酸蚀15 s,然后用水彻底冲洗30 s,牙本质表面用吸水纸轻拭去除多余水分。然后将16个3 mm厚的牙本质片随机分为4组(n=4),按照表1分组进行处理。

表1 各组牙本质试件的表面处理Tab.1 Surface treatment of dentin specimens in each group
使用含10-MDP的底涂剂涂布于10-MDP组酸蚀后的牙本质表面20 s,并用光固化灯(EliparTMS10,3M ESPE,美国)光固化20 s;将CHX(维真园,中国)涂布于CHX组酸蚀后的牙本质表面60 s,牙本质表面用吸水纸轻拭去除多余水分。随后每组将各自使用的粘接剂涂布于牙本质表面,光固化20 s。然后,将复合树脂(Filtek Z250,3M ESPE,美国)分两层堆置到涂布粘接剂的牙本质表面上,每层2 mm,牢固压实并光固化40 s。将每组的牙本质/树脂粘接样本在37 ℃的蒸馏水中保存24 h和6个月。
1.2 微拉伸粘接强度测试
水储24 h或6个月后,用低速切割机将每个牙本质粘接的样本垂直牙体长轴切成约1 mm×1 mm的柱状试件,每个粘接样本中取最靠近中心的4~5根柱状试件,用电子游标卡尺(MNT-150,Meinaite,中国)测量并记录每根试件的横截面积,精确至0.01 mm。将每个柱状试件用氰基丙烯酸粘接剂粘接到微拉伸装置(micro tensile tester,BISCO,美国)的夹具上,并以1 mm/min的速度施加拉力,直到发生断裂,记录拉力F(N)。测量结果以MPa表示,是通过将断裂时的作用力F(N)除以单个样品的粘接面积得出的。记录每组24 h和6个月水储的微拉伸测试粘接强度(μTBS),并计算平均值和标准差。采用SPSS 25.0软件进行双因素方差分析(Two-way ANOVA),P<0.05为差异有显著性意义。
1.3 X射线衍射分析(XRD)
取0.3 g羟基磷灰石粉,分为3份,按照表1分组进行处理,反应4 h。反应完成后,加入丙酮,3 500 r/min离心20 min,倒出上清液,反复清洗3次,然后将反应残余物放置于37 ℃恒温箱干燥4 h。通过射线衍射仪上进行分析,工作电压为40 kV,电流为200 mA,以连续方式进行扫描,扫描2θ范围为0.6°~40.0°,速度为0.02°/s,记录实验结果。
1.4 原位酶谱分析
按照表1分组对4个1 mm厚的牙本质片表面进行处理。将厚度为1 mm的流动树脂(Filtek Flow,3M ESPE,美国)堆置到牙本质上并光固化20 s,然后用低速切割机将其垂直于粘接界面切成1 mm厚的薄片,从厚度为1 mm的薄片中心区域切取出1 mm的柱状试件,暴露出树脂-粘接剂-牙本质界面。
用砂纸将柱状试件磨至厚度为500 μm的样本,然后用氰基丙烯酸粘接剂粘到显微镜载玻片上以备用。使用DQ-明胶(dyequenched-gelatin)作为MMP底物(EnzChekTMGelatinase/Collagenase Assay Kit, Thermo Fisher Scientific, 美国)进行原位酶谱分析。通过向含有DQ-明胶的管中加入1.0 mL纯水制备成1.0 mg/mL荧光素标记的明胶溶液,将其储存在-20 ℃直至使用。用1∶1的PBS缓冲液以体积比1∶8稀释明胶原液,避光保存。用移液枪将50 μL明胶混合物置于载玻片上,使明胶混合液充分浸泡试件,并盖上盖玻片。将载玻片避光保存并在37 ℃恒温箱内孵育24 h。使用激光共聚焦显微镜(CLSM)(Zeiss LSM880 with NLO & Airyscan, 德国)进行分析,评估牙本质内源性明胶分解酶的活性。
2 结 果
2.1 微拉伸测试
4组试件分别在37 ℃水浴锅中储存24 h和6个月后的微拉伸强度测试值,见表2。

表2 在不同水储情况下,4组μTBS结果Tab.2 μTBS results of 4 groups under different water storage conditions MPa
上标大写(小写)字母表示表格中数值的横向(纵向)比较,相同上标大写(小写)字母表明两组μTBS数据没有统计学差异(P>0.05)
使用HSD检验法和最小显著性法统计分析发现,水储24 h后,不同处理方式的4组微拉伸粘接强度均无统计学差异(P均大于0.05),然而水储6个月后,对照组、10-MDP组、SBU组的微拉伸粘接强度相对于24 h者均显著降低(P<0.05),其中对照组最低;CHX组则在水储6个月后维持了微拉伸粘接强度的稳定(P=0.352)。
2.2 XRD
如图1所示:对照组,10-MDP组和SBU组反应残留物的XRD图谱,10-MDP组和SBU组分别在2θ=4.16°,7.34°和2θ=4.66°,7.02°(箭头所示)有两个特征性的峰,表明MDP-钙盐的形成[7]。
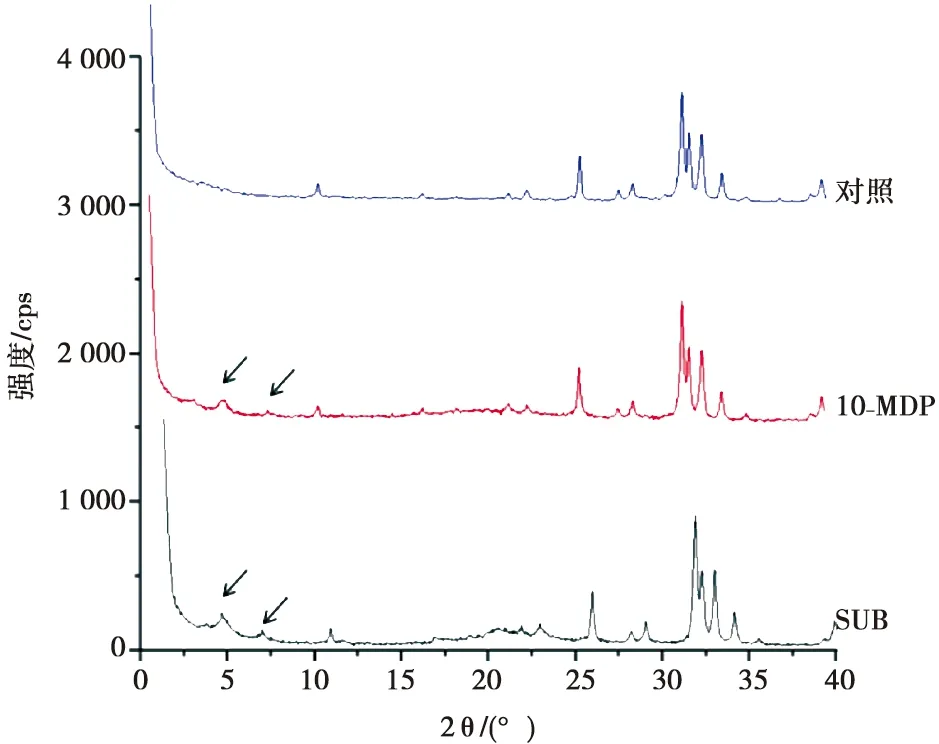
图1 XRD结果Fig.1 Results of XRD
2.3 原位酶谱
各组样本经过24 h孵育后,原位酶谱结果如图2显示,对照组中在混合层以及牙本质小管中可以看出强烈的绿色荧光标记,这表明对照组中的明胶水解较强烈;与对照组相比,10-MDP组与SBU组荧光强度明显减弱,表明这两组明胶有被水解,但水解程度低于对照组,而10-MDP组与SBU组间的荧光程度没有明显区别;CHX组的荧光强度也较对照组低。
3 讨 论

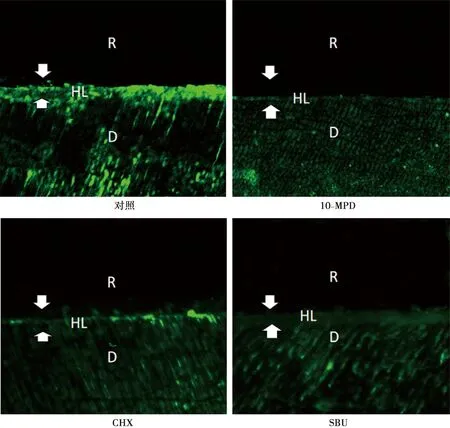
R:树脂;D:牙本质;HL:混合层图2 原位酶谱结果Fig.2 Results of in situ zymography
CHX是一种有效和非特异性的MMPs抑制剂,在微拉伸结果中显示,CHX组在24 h和6个月时的粘接强度无明显区别(P>0.05),这与原位酶谱结果一致,如图1所示,在CHX组表现为最低的荧光强度,这与先前的研究一致[16]。Favetti等[17]提出,CHX可以在6个月内保持粘接强度的耐久性。与CHX组比较,10-MDP组和SBU组微拉伸强度均有所降低(P<0.05),这表明虽然10-MDP-钙盐的形成对内源性牙本质MMPs的活性被表现为抑制,但其抑制能力并不强于CHX。
此外,在微拉伸的结果中,10-MDP组与SBU组从24 h到6个月,粘接强度表现为明显的降低(P<0.05)。这与一些研究结果不一致[18-19]。这可能是因为将牙本质粘接样本存储在水环境中时,粘接剂会吸收水分,使其内部的亲水性和疏水性成分发生相分离,会增加水解作用的敏感性,从而使树脂-牙本质界面水解,导致微拉伸强度的下降[20]。
4 结 论
酸性功能单体10-MDP之所以能发挥作用,离不开与羟基磷灰石之间相互作用形成的10-MDP-钙盐,通过10-MDP-钙盐保护暴露的胶原纤维不接触到MMPs而免于水解,这对延长树脂-牙本质粘接界面的保存时间有显著意义。

